基于全自动免疫磁珠净化技术快速测定中药材中4种黄曲霉毒素
2024-04-23黄晓静陈素云
黄晓静,陈素云,周 恒*,王 江,果 旗,王 雄,胡 青,季 申*
(1.上海市食品药品检验研究院,国家药品监督管理局中药质量控制重点实验室,上海 201203;2.北京中检维康生物技术有限公司,北京 100044)
黄曲霉毒素(AFs)是一类二氢呋喃香豆素的衍生物,主要由黄曲霉(A. flavus)和寄生曲霉(A.paraciticus)代谢产生,极易污染粮油食品和中药[1]。国际癌症研究机构(IARC)将黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)列为一级致癌物,其具有显著的肝毒性[2-4]。目前,全球各主要国家均出台了针对该4 种黄曲霉毒素的限量法规,以降低潜在的安全风险[5-7]。
目前在不同类型的中药材(CMM)中发现了黄曲霉毒素污染情况[6],如桃仁、柏子仁等种子类药材[8],延胡索、远志等根茎类药材[9-10],土鳖虫、僵蚕等动物类药材[11],以及神曲、淡豆豉等发酵类药材[6,12],中药材及饮片中黄曲霉毒素的污染情况不容乐观。然而,中药材中黄曲霉毒素检测存在诸多挑战和难点。相比于食品,中药材为干性物质,初级和次级代谢产物较多,含有不同类型干扰成分,给黄曲霉毒素的痕量分析带来了极大挑战[6]。
因此,对于中药中黄曲霉毒素的检测,样品前处理显得至关重要,直接影响结果的灵敏度、准确性及重现性。目前,AFs 的前处理方法主要包括直接提取[13]、液液微萃取(LLE)[14]、固相萃取(SPE)[15]、QuEChERS[16]和免疫亲和柱法(IAC)等[5,17-18]。其中IAC 具有高特异性、高选择性和稳定性,是目前测定食品、中药中黄曲霉毒素较为常用的前处理方法。中国药典、美国药典等官方标准以及国际标准化组织(ISO)等官方组织均推荐采用IAC 法对黄曲霉毒素进行富集净化[18]。然而,IAC 存在操作步骤繁琐、耗时长、成本高等缺点,亟需开发耗时短、成本低及适合批量检测的样品提取净化新方案。
近年来,免疫亲和磁珠(IMB)作为一种新型的分离材料,逐步应用于免疫检测、分子生物学等领域。IMB 是一种具有磁性的免疫微球[19],可依靠外界磁力实现快速分离,避免了繁琐的过滤或离心过程,消耗溶剂少,操作简单,大大缩短了前处理时间[3]。IMB 具有较大的比表面积和较好的分散特性,大大缩短了平衡时间,增强了抗原抗体间的相互作用,从而提高了吸附量和检测灵敏度;同时规避了IAC存在的阻塞问题[20]。近年来,IMB逐渐被应用于食品与粮油中各种真菌毒素的检测[21-23]。然而,其在中药中真菌毒素的检测研究相对较少。
本研究将黄曲霉毒素免疫磁珠试剂盒与自动化前处理程序相结合,基于中药基质特性和黄曲霉毒素特点,建立了一种适用于不同类型中药基质中黄曲霉毒素快速批量分析的高效液相色谱方法。该方法具有良好的线性、灵敏度、准确性和重现性;大大缩短了前处理时间,降低了人力和实验成本,有效减少了操作误差,克服了传统柱式净化方法的缺点,具有广阔的应用前景。
图1 4种黄曲霉毒素的结构式Fig.1 Chemical structures of 4 aflatoxins
1 实验部分
1.1 仪器与试剂
Mettler Toledo XS204电子天平(美国Mettler Toledo公司);IKA KS260平式振荡仪(德国IKA公司);Milli-Q超纯水仪(美国Millipore 公司);Fisher STD 迷你涡旋混合器(美国Fisher Scientific 公司);5415R型高速离心机、移液枪(德国Eppendorf公司)。
IMB-103A 20T 黄曲霉毒素总量免疫磁珠(IMB,北京中检维康生物技术有限公司);CNtest 黄曲霉毒素总量亲和柱-中药专用(北京中检维康生物技术有限公司);Inertsil ODS-3C18柱(250 mm×4.6 mm,5 µm,日本Shimadzu公司);Zorbax SB-C18柱(250 mm×4.6 mm,5 µm,美国Agilent公司);0.22 µm聚四氟乙烯微孔滤膜(PTFE滤膜,美国Agilent公司) 。
标准物质:AFB1、AFB2、AFG1和AFG2的混合标准溶液(质量浓度分别为1.0、0.3、1.0、0.3 µg·mL-1,天津阿尔塔科技有限公司);黄曲霉毒素总量免疫磁珠试剂盒(北京中检维康生物技术有限公司);乙腈(ACN)、甲醇(色谱纯,德国Merck公司)。
样品:莲子、槟榔、薏苡仁、土鳖虫、延胡索5 种药材样品均为国家或地方抽检样品,均由上海市食品药品检验研究院中药天然药物/保健食品所杨新华主管药师鉴定为正品。
1.2 溶液制备
标准储备液:精密量取黄曲霉毒素混合标准溶液1.0 mL,置于10 mL量瓶中,用甲醇稀释至刻度,摇匀,作为标准储备液(AFB1、AFB2、AFG1、AFG2的质量浓度分别为100、30、100、30 ng·mL-1);混合对照品溶液(1):精密量取标准储备液1.0 mL,置于10 mL量瓶中,用50%甲醇稀释至刻度,摇匀即得;混合对照品溶液(2):精密吸取对照品溶液(1)1.0 mL,置于10 mL 量瓶中,用50%甲醇稀释至刻度,摇匀即得。
磷酸盐缓冲液(PBS):称取8.0 g氯化钠、1.2 g磷酸氢二钠、0.2 g磷酸二氢钾和0.2 g氯化钾,加入990 mL水溶解,用盐酸调节pH值至7.0,加水稀释至1 000 mL,即得。
0.5%吐温20-磷酸盐缓冲液(0.5% PBST):吸取5 mL 吐温20,加入995 mL 磷酸盐缓冲液,混匀即得。
1.3 全自动免疫磁珠自动净化-高效液相色谱测定系统
自动净化富集系统:使用Auto IMB-24T 型真菌毒素全自动净化仪(北京中检维康生物技术有限公司)内置的黄曲霉毒素净化富集程序。
液相色谱系统:LC-20AD 型高效液相色谱仪(Shimadzu 公司),搭载CT0-20AC 柱温箱、PR-1000光化学衍生仪及RF-20AXS检测器。
1.4 色谱条件
Inertsil ODS-3C18柱(250 mm×4.6 mm,5 µm),以乙腈-甲醇-水(33∶11∶56)为流动相,等度洗脱,流速为1.0 mL·min-1;经光化学衍生,荧光检测器:激发波长为360 nm,发射波长为450 nm;柱温为30 ℃;进样量为20 µL。
1.5 样品前处理
将样品粉碎(过2 号筛),精密称取5.0 g,加入1.0 g 氯化钠置于50 mL 离心管中,精密加入20 mL乙腈-水(9∶1),置于平板振荡仪(490 r/min)中振荡提取30 min,以3900 r/min 离心5 min;精密吸取1 mL上清液加入免疫磁珠试剂盒的结合孔中(孔中加入5 mL 0.5%吐温20-PBS结合液,2个淋洗孔中加入2 mL水,洗脱孔中加入0.5 mL 0.5%乙酸甲醇),在磁棒外部套上一次性磁棒套。设置黄曲霉毒素自动净化程序:结合时间5 min,洗脱时间5 min,开启净化程序,待结束后吸取洗脱液,加水定容至1 mL,涡旋混匀后过0.22 µm PTFE滤膜。全自动免疫磁珠净化检测流程如图2所示。

图2 全自动免疫磁珠净化检测流程图Fig.2 Flow chart of automatic purification based on immunomagnetic beads

图3 槟榔中不同提取溶剂条件下4种黄曲霉毒素的回收率Fig.3 Recoveries of 4 aflatoxins in different extraction solvents in Arecae semen
2 结果与讨论
2.1 中药研究品种的选择
《中国药典》2020年版一部中收录黄曲霉毒素限量要求的中药品种增至24种[24]。为保证分析方法的适用性,本研究以药典中有黄曲霉毒素限量要求且日常监测中黄曲霉毒素检出频次较高的品种为主要对象,尽可能涵盖不同药用部位和不同大类成分的药材基质,最终选择5 种易污染黄曲霉毒素的中药材,分别为果实种子类药材莲子、槟榔与薏苡仁,动物类药材土鳖虫及根茎类药材延胡索。
因槟榔的初级和次级代谢产物种类较多,色素含量高,且易污染黄曲霉毒素,是典型的果实种子类中药材,故主要以槟榔基质为代表进行方法优化,然后将建立的方法应用于其余4 种基质进行方法学验证,考察其适用性。
2.2 提取条件的优化
黄曲霉毒素的极性较大,常采用不同比例的甲醇或乙腈水溶液作为提取溶剂。《中国药典》2020年版四部<2351真菌毒素测定法>中采用70%甲醇作为提取溶剂[25],而文献表明,乙腈相比甲醇提取体系可获得更高的提取效率[2,13]。在1.5 µg·kg-1(以AFB1计)水平下进行加标实验(n=3),比较了不同比例的甲醇-水和乙腈-水作为提取溶剂时的效果。实验发现以乙腈-水(8∶2)、乙腈-水(9∶1)为提取溶剂时,4 种黄曲霉毒素的提取效率最高,回收率均能达到80%以上(见图2),且杂质提取最少。以乙腈-水为提取溶剂时的提取效率高于甲醇-水,而减少水相的比例,可更大程度减少基质中极性干扰成分的共提取,提高后续净化时免疫亲和的效率,因此选择乙腈-水(9∶1)为提取溶剂。
进一步考察了样品提取步骤中添加氯化钠的必要性,实验发现添加氯化钠的供试品溶液相对澄清,而不添加氯化钠的供试品溶液则较为浑浊,且4 种黄曲霉毒素的提取效率也受到较大影响。推测引入氯化钠可增加蛋白质的析出,同时能有效减少样品中杂质的提取,进而提高了黄曲霉毒素的提取效率,最终确定添加1 g氯化钠。
2.3 全自动免疫磁珠净化仪参数的优化
2.3.1 结合液种类与体积的优化不同类型中药材基质的提取液pH 值存在差异,且提取液中某些干扰成分会占据抗体结合位点,影响免疫磁珠的抗体活性,造成黄曲霉毒素的加标回收率偏低。因此,针对样品结合液种类及体积(即样品稀释比)进行了优化。吸取1 mL 样品上清液,加至装有5 mL不同结合液的结合孔中,使用200 µL 磁珠进行净化,0.5 mL 甲醇洗脱,结合时间与洗脱时间均设为10 min。实验发现样品结合液采用0.5%吐温20-PBS 时,4 种黄曲霉毒素均能获得较高的回收率(见图4)。
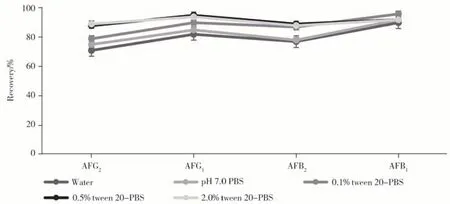
图4 槟榔中不同结合液条件下4种黄曲霉毒素的回收率Fig.4 Recoveries of 4 aflatoxins in different capture solvents in Arecae semen
进一步考察了吐温20的添加比例,发现以0.5%吐温20-PBS 作为结合液时,对槟榔基质的富集净化效果达到最佳,且其它基质在此条件下的富集净化效果均较好,回收率均较高。
由于样品提取溶剂为乙腈-水(9∶1),有机相比例高会导致免疫抗体失活而影响净化效率。对结合液体积进行了考察,发现在样品液-结合液的体积比为1∶5条件下,4种黄曲霉毒素的回收率均达到最高,增大结合液的体积并未展现出更多优势。可见采用5 倍的结合液体积稀释,能获得最佳的富集净化效果。综上,实验选择结合液为0.5%吐温20-PBS,结合液体积为5 mL。
2.3.2 免疫磁珠的载量及使用量确认免疫磁珠的载量将直接影响黄曲霉毒素的分析容量,为保证免疫磁珠对黄曲霉毒素的吸附量达到市售免疫亲和柱的同等载量,需对免疫磁珠的载量进行确认。分别将50、100、200、250 µL的免疫磁珠与阳性槟榔样品提取液1 mL(上样黄曲霉毒素总量约为200 ng)在5 mL 0.5%吐温20-PBS 结合液中充分混合,进行富集净化,结合时间与洗脱时间均设为10 min,采用0.5 mL 甲醇洗脱。如表1 所示,免疫磁珠的用量不低于200 µL 时的测定结果与免疫亲和柱基本一致。最终确认免疫磁珠用量为200 µL,以达到市售3 mL规格免疫亲和柱的分析容量。
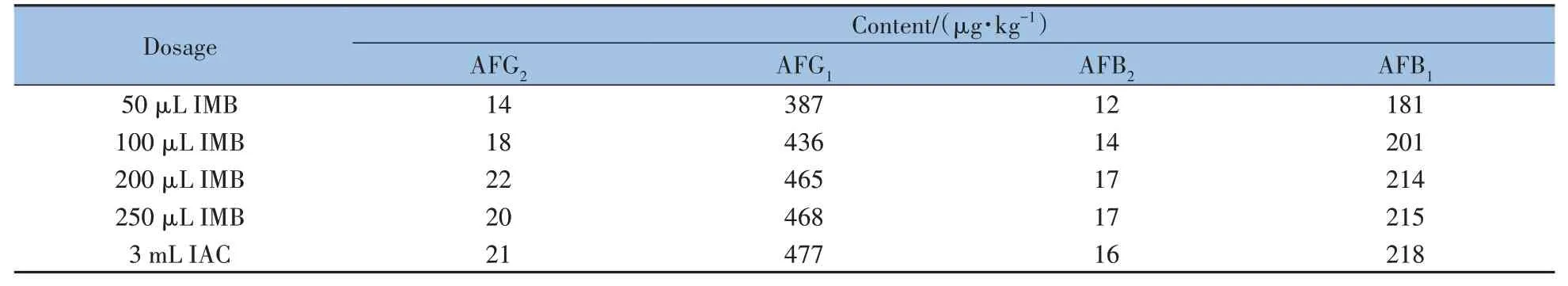
表1 不同免疫磁珠用量下阳性槟榔样品中的黄曲霉毒素含量Table 1 Aflatoxin contents of positive Arecae Semen sample under different dosage of IMBs
2.3.3 富集净化时间的优化在0.5%吐温20-PBS 结合液及室温条件下,考察了不同富集净化时间下免疫磁珠对4种黄曲霉毒素的富集净化效果。添加黄曲霉毒素混合对照品总量260 ng(即1.0 mL标准储备液)于结合液中,分别在不同结合时间下进行富集净化后,吸出免疫磁珠,取出结合液上清液,直接检测剩余黄曲霉毒素量。结果表明,免疫磁珠对4 种黄曲霉毒素的富集量在4 min 后基本达到饱和,最终确定富集净化时间为5 min。
2.3.4 洗脱溶剂与洗脱时间的优化考察了不同洗脱溶剂和洗脱时间对黄曲霉毒素洗脱效果的影响。取1 mL样品上清液,采用5 mL 0.5%吐温20-PBS结合液稀释,使用200 µL磁珠净化,结合时间设为5 min,分别采用0.5 mL 甲醇和0.5%乙酸甲醇为洗脱溶剂,分别测定洗脱时间为2、4、5、6、8 min 时洗脱液中的黄曲霉毒素量。研究发现,0.5%乙酸甲醇的洗脱效率与甲醇相近,但所需洗脱时间更短,甲醇完全洗脱需要6 min,而0.5%乙酸甲醇仅需4 min。为保证不同基质洗脱完全,最终选定0.5%乙酸甲醇为洗脱溶剂,洗脱时间为5 min。
2.4 方法学考察
2.4.1 专属性对5 种中药材基质进行专属性验证,发现本方法的专属性良好,5 种药材基质中杂质的色谱峰均不干扰4种黄曲霉毒素的测定,分离度良好。
2.4.2 线性关系取黄曲霉毒素混合对照品溶液(2)分别进样2、5、10 µL,另取黄曲霉毒素混合对照品溶液(1)分别进样5、10、20 µL,记录色谱图,以黄曲霉毒素的质量(X,pg)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线。该方法的线性关系良好,相关系数(r2)均达到0.9999(见表2)。

表2 4种黄曲霉毒素的线性关系、检出限与定量下限Table 2 Linear relationship,limits of detection and limits of quantitation of 4 aflatoxins
2.4.3 检出限与定量下限在5 种阴性中药基质样品中分别进行0.2、0.4µg·kg-1(以AFB1计)2 个水平的加标实验,按建立的方法进行样品前处理和测定。分别以3 倍信噪比(S/N=3)和10 倍信噪比(S/N=10)确定检出限(LOD)和定量下限(LOQ),得到4种黄曲霉毒素的检出限为0.06~0.2 µg·kg-1,定量下限为0.12~0.40µg·kg-1(见表2)。
2.4.4 精密度取黄曲霉毒素混合对照溶液(2),进样10 µL,连续进样6 次,记录峰面积。计算AFG2、AFG1、AFB2、AFB1的相对标准偏差(RSD)分别为0.20%、0.90%、0.20%、0.60%,表明仪器精密度良好。
2.4.5 稳定性取5 种中药材基质的阴性样品,在5µg·kg-1(以AFB1计)的水平下添加黄曲霉毒素混合对照品储备溶液,按建立的方法制备供试品溶液,于制备后0、4、8、12、24 h进样分析,记录峰面积。莲子、槟榔、薏苡仁、土鳖虫和延胡索中4 种黄曲霉毒素峰面积的RSD分别不大于1.9%、1.6%、1.4%、1.9%和1.1%,表明供试品溶液在24 h内稳定。
2.4.6 加标回收率及相对标准偏差取5 种中药材基质的阴性样品,进行0.4、5、25µg·kg-1(以AFB1计)3 个水平的加标回收实验,每个水平下按“1.5”方法分别制备6 份样品,采用“1.4”色谱条件进行测定。结果表明,5 种中药材基质中4 种黄曲霉毒素的平均回收率为71.9%~116% ,RSD 为0.10%~6.9%(表3),能够满足《中国药典》的方法学验证要求[25]。
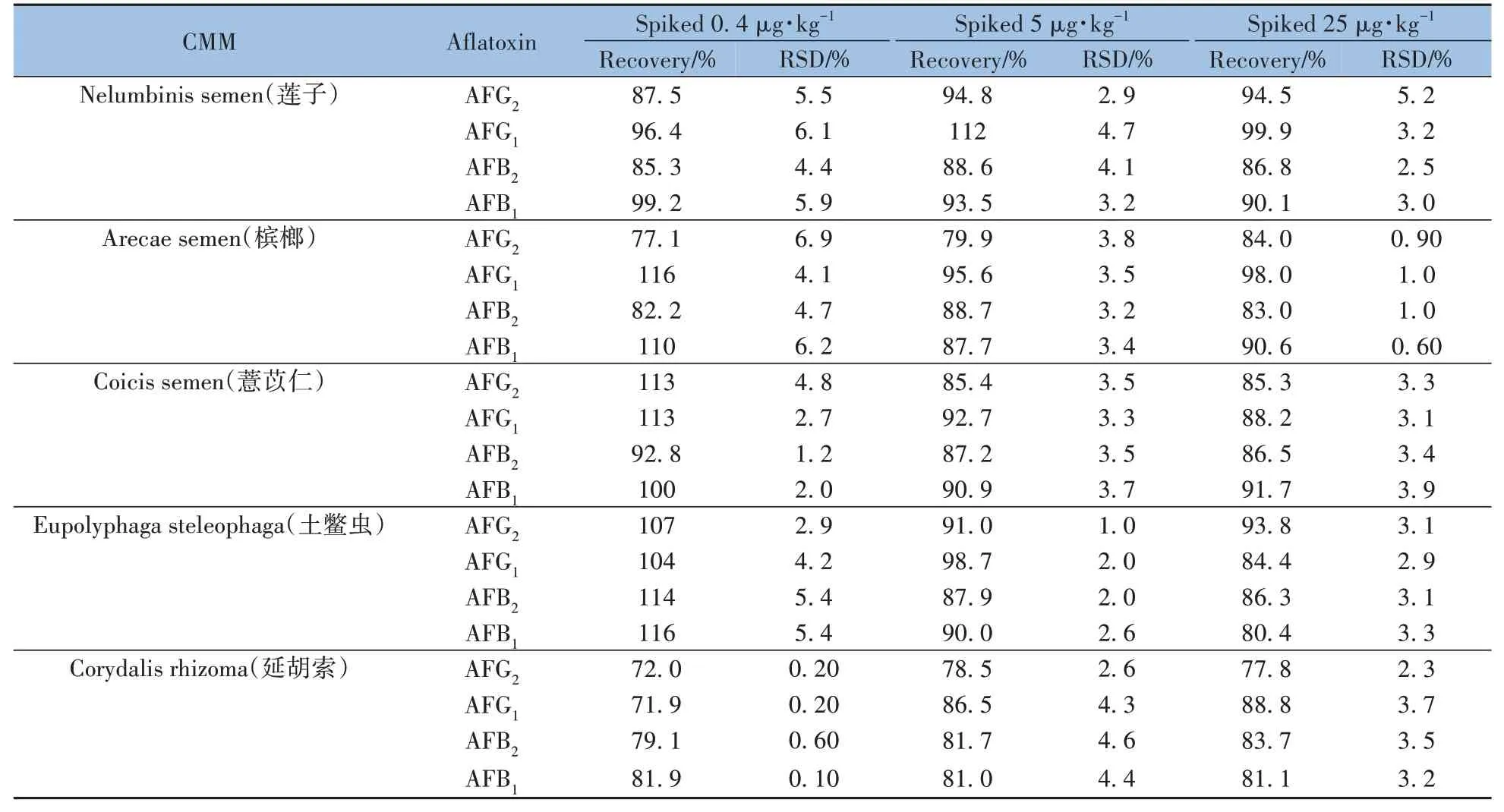
表3 5种中药基质中4种黄曲霉毒素的加标回收率及相对标准偏差(n=6)Table 3 Recoveries and relative standard deviations of 4 aflatoxins in 5 CMMs(n=6)
2.5 方法对比
2.5.1 实际样品测定采用免疫磁珠净化方法和传统免疫亲和柱净化方法分别测定了20 批槟榔及莲子阳性样品中4种黄曲霉毒素的含量。结果表明,两种方法测定的含量基本一致。以AFB1为例,两者测定结果拟合曲线的r2为0.997(图5)。

图5 20批阳性样本中IMB和IAC方法测定AFB1的结果对比Fig.5 Comparison of IMB and IAC methods for the determination of AFB1 in 20 batches positive samples
2.5.2 加样平行性对比以槟榔、土鳖虫和延胡索为基质样品,在5µg·kg-1(以AFB1计)加标水平下,分别采用本方法及IAC 测定法(n=6)进行回收率对比实验。结果表明,本方法的准确性和平行性更优,相比IAC 法RSD 降低2~3 倍(见表4)。特别是对于延胡索中AFG2的加标回收率可提高约10%~20%,这可能与磁珠具有更大的比表面积及结合效率有关。
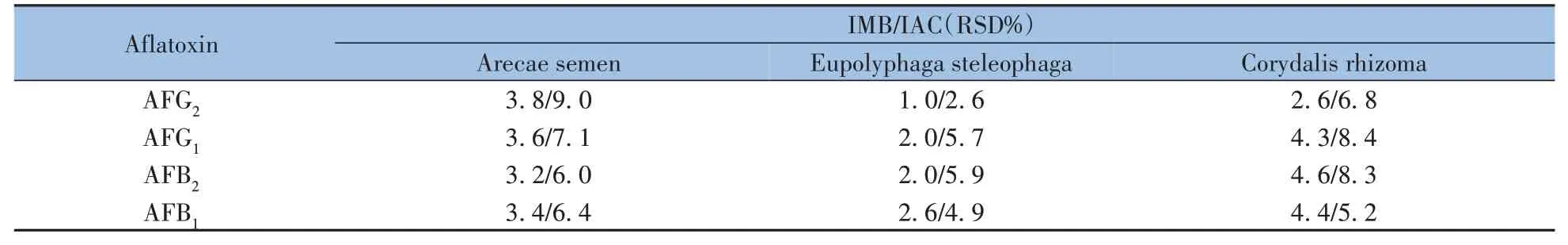
表4 不同基质中IMB和IAC方法重复性的比较Table 4 Comparison of IMB and IAC methods for the repeatabilities in different matrices

表 5 IMB和IAC方法对比Table 5 Comparison of IMB and IAC methods
2.5.3 其他指标对比如表5 所示,基于自动化程序,免疫磁珠净化方法可同时处理24 份样品,前处理时间仅需18 min,而传统IAC 方法约需2 h,前处理效率提高了近85%,特别适用于通量高、时间短的快速定量分析场景。此外,免疫磁珠前处理过程中消耗试剂、产生废液均大幅减少,更符合绿色环保的分析要求。
3 结 论
本研究基于全自动免疫磁珠净化前处理技术,通过优化提取溶剂、IMB 用量、结合液种类与体积等参数,建立了中药材中4种黄曲霉毒素的快速测定方法,并应用于5 种中药材基质进行方法学验证。结果表明,所建方法具有良好的线性、检出限、定量下限、准确性和重现性。未来,随着免疫磁珠可搭载抗体种类的逐渐丰富以及抗干扰能力的提升,全自动免疫磁珠技术将在中药材、饮片及中成药的单类或多类真菌毒素快速分析领域发挥更为重要的作用。
