伴自杀意念首发抑郁症患者小脑-大脑功能连接的fMRI研究
2024-04-23姜雨陈苑韩少强郑瑞平周冰倩李淑英程敬亮
姜雨,陈苑,韩少强,郑瑞平,周冰倩,李淑英,程敬亮
抑郁症是最常见的情感性精神障碍类疾病之一,通常表现为抑郁情绪,并伴有植物神经系统的相关症状如食欲改变、睡眠障碍和精神运动发育迟缓等[1-2]。自杀是中国15~24岁青年的主要死因[3]。与健康人群相比,抑郁症患者的自杀率较高[4-5]。伴有自杀意念(suicidal ideation,SI)的抑郁症患者抗抑郁治疗反应差,治疗时间长,对社会和家庭造成了沉重负担[6]。
既往有研究结果表明,伴自杀意念的抑郁症患者中负责调节情绪、认知和行为功能的额-边缘环路及额-丘脑环路存在连接障碍[7-8]。然而既往的研究中主要分析大脑区域,针对小脑的研究较少。小脑不仅参与运动协调、平衡和姿势保持,而且在人类的认知、情绪调节和决策方面亦发挥着重要作用[9]。在解剖学上,正常小脑结构被分为十个小叶(命名为Ⅰ-Ⅹ)。小脑与许多大脑区域存在功能连接(functional connectivity,FC),如前额叶、颞叶、丘脑、运动皮层和动眼区[10]。最近的研究表明,小脑-大脑间FC的改变与精神类疾病相关,如孤独症、强迫症、精神分裂症、双相情感障碍和抑郁症等[11-15]。既往有研究结果显示小脑-大脑间FC的改变可能在抑郁症的病理生理学机制中发挥一定的作用,并与临床症状的严重程度相关[15-16]。然而,对于伴有SI抑郁症患者的小脑-大脑间FC的改变及其与临床症状的关系目前尚不明确。因此,本研究采用基于种子点的FC分析方法探讨伴SI的首发抑郁症患者小脑-大脑间FC的异常改变,及其与病程和临床症状之间的关系,扩展了研究领域,旨在进一步阐明抑郁症患者的病理生理机制。
材料与方法
1.研究对象
将2018年2月-2022年1月就诊于本院精神科就诊且符合本研究要求的100例抑郁症患者纳入本研究。入组标准:①符合美国精神障碍诊断与统计手册第四版(Diagnostic and Statistical Manual of Mental Disorders,Fourth Edition,DSM-Ⅳ)中抑郁症的诊断标准;②临床24项汉密尔顿抑郁量表(Hamilton Depression Scale,HAMD24)评估中,总分≥20分;③首次发病,既往未进行任何抗抑郁治疗;④汉族人,右利手。排除标准:①有其它精神类疾病史;②存在脑外伤、器质性疾病或严重躯体性疾病;③药物滥用或酒精依赖者;④具有磁共振检查禁忌证。
依据患者对Beck自杀意念量表中文版(Beck scale for suicide ideation-Chinese version,BSI-CV)中第4和第5项评估内容的答案将患者进行分组:若两项中任一项的答案为“弱”或“中等到强烈”,则判定患者伴有SI;若两项答案均为“无”,则为不伴SI(NSI)组。同时招募49例健康对照者(healthy controls,HC),按DSM-Ⅳ诊断标准对每例HC进行评估,排除任何精神障碍类疾病,且结合临床病史除外有严重躯体性疾病或脑外伤、有药物滥用或酒精依赖病史者。
本研究获得本院伦理委员会批准(2018-KY-88),所有被试或其家属签署了知情同意书。
2.临床资料及量表评估
由2位精神科主治医师搜集所有被试的性别、年龄、教育水平和病程等基本信息,并采用HAMD24对受试者进行评估。HAMD24包括7项评估内容,即焦虑/躯体化(0~16分)、体质量(0~2分)、认知障碍(0~22分)、日夜变化(0~4分)、阻滞(0~14分)、睡眠障碍(0~6分)和绝望感(0~12分)共7个因子,得到每个因子的得分及HAMD24总分(总体评估抑郁症的严重程度,0~78分)。BSI-CV共19项评估内容,其中自杀意念因子(0~3分)评估自杀意念的强度,自杀危险因子(0~100分)评估自杀行为的可能性。
3.影像学数据采集
使用GE Discovery 750 3.0T磁共振仪采集功能MRI数据。扫描时嘱被试保持平卧闭眼、正常呼吸和避免意向性思维。采用梯度回波EPI序列,扫描参数:TR 2000 ms,TE 40 ms,翻转角90°,矩阵64×64,视野240 mm×240 mm,层厚4.0 mm,层间距0.5 mm,层数32,采集180个时间点的数据,共获得5760帧图像,扫描时间约6 min。
4.图像预处理
使用基于Matlab平台运行的DPABI软件进行图像预处理,主要步骤包括格式转换、弃除前10个时间点的数据、时间校正和头动校正(头动范围平移≤3 mm,旋转≤3°,平均帧位移<0.5 mm)、空间标准化、去线性漂移、回归协变量(Friston24头动参数、全脑信号、白质和脑脊液信号)及在0.01~0.08 Hz的频段内滤波。
5.小脑-大脑间FC的计算
为了识别小脑-大脑功能网络,本研究中选取小脑各亚区进行基于种子点的FC分析。基于既往的研究结果,小脑种子点能够识别小脑-大脑功能网络,包括执行网络(executive network,EN)、默认模式网络(default-mode network,DMN)、情感-边缘网络(affective-limbic network,ALN)和运动网络(motor network,MN)[17]。本研究以小脑种子点的蒙特利尔神经科学研究所(Montreal Neurological Institute,MNI)空间坐标为球心,绘制半径为6 mm的球体作为ROI,计算每个小脑ROI与大脑不同区域之间的FC值。所绘制的小脑种子点ROI与大脑FC的相关功能网络及空间定位详见表1。其中Crus-Ⅰ和Crus-Ⅱ属于小叶Ⅶ的一部分。经过Z值变换后得到每个小脑种子点与大脑不同区域之间的FC图。最后采用全宽半高为6 mm的平滑核对数据进行高斯平滑。
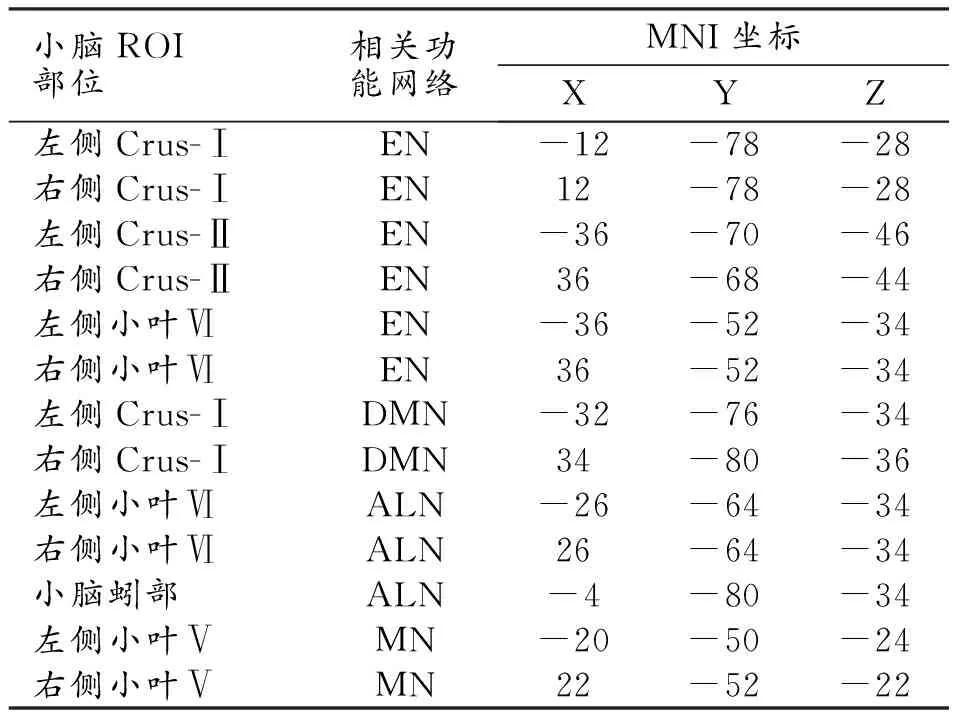
表1 小脑各种子点ROI的空间定位及与功能网络的关系
6.统计学分析
使用SPSS 24.0软件对临床资料进行统计学分析。计数资料的组间比较采用卡方检验。服从正态分布的计量资料以均值±标准差来表示,组间比较使用单因素方差分析(3组比较)或独立样本t检验(2组比较);不服从正态分布者以中位数(上、下四分位数)表示,组间比较采用Kruskal-WallisH检验(3组比较)或Mann-whitneyU检验(2组比较)。使用SPM 12.0软件对三组被试的FC图进行单因素方差分析,对协变量(性别、年龄、教育水平、平均帧位移)进行回归分析,进一步组间多重比较使用FDR校正(P<0.05)。使用REST软件提取3组间差异脑区的FC值,并使用SPSS 24.0软件进行事后分析。最后将组间差异有统计学意义(SI组、NSI组和HC组两两比较)的小脑-大脑间FC值与病程、HAMD24评分和BSI-CV评分进行相关性分析,符合双变量正态分布者使用Pearson相关分析,否则采用Spearman相关分析。以P<0.05为差异有统计学意义。
结 果
1.临床资料的比较
三组被试临床资料的比较结果详见表2。三组之间基本临床资料(年龄、性别和受教育程度)的差异均无统计学意义(P>0.05)。对SI组与NSI组的量表评估结果进行比较,结果显示SI组的HAMD24总分、认知障碍因子和绝望感因子高于NSI组,差异有统计学意义(P<0.05);而病程及焦虑/躯体化、体质量、日夜变化、阻滞和睡眠障碍因子的差异均无统计学意义(P>0.05)。

表2 三组被试临床资料的比较
2.小脑-大脑间FC分析
对HC、SI和NSI组的小脑-大脑间FC值进行比较,三组之间总体差异有统计学意义脑区的特征详见表3和图1~2。小脑右侧Crus-IEN与右侧颞上回、双侧颞中回、左侧颞下回、左侧角回及右侧中央前回的FC值在三组之间的差异有统计学意义(FDR校正,P<0.05);左侧Crus-IDMN与右侧额中回、左侧颞上回、双侧角回、右侧后扣带回、左侧中央钩盖及左侧中央旁小叶之间的FC值在三组之间的差异均有统计学意义(FDR校正,P<0.05)。
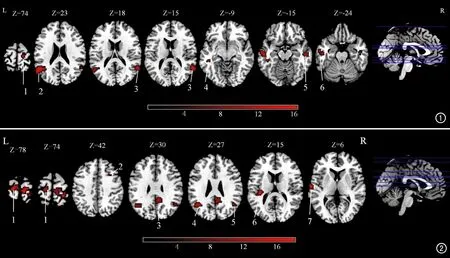
图1 右侧Crus-IEN-大脑间FC值在3组间有显著差异的大脑脑区分布图。下方彩条代表方差分析F值(FDR校正,P<0.05)。图中线条1~6分别代表右侧中央前回、左侧角回、 右侧颞上回、左侧颞中回、右侧颞中回和左侧颞下回。 图2 左侧Crus-IDMN-大脑间FC值在3组间有显著差异的大脑脑区分布图。下方彩条代表方差分析F值(FDR校正,P<0.05)。图中线条1~7分别代表左侧中央旁小叶、右侧额中回、右侧后扣带回、左侧角回、右侧角回、左侧中央钩盖和左侧颞上回。
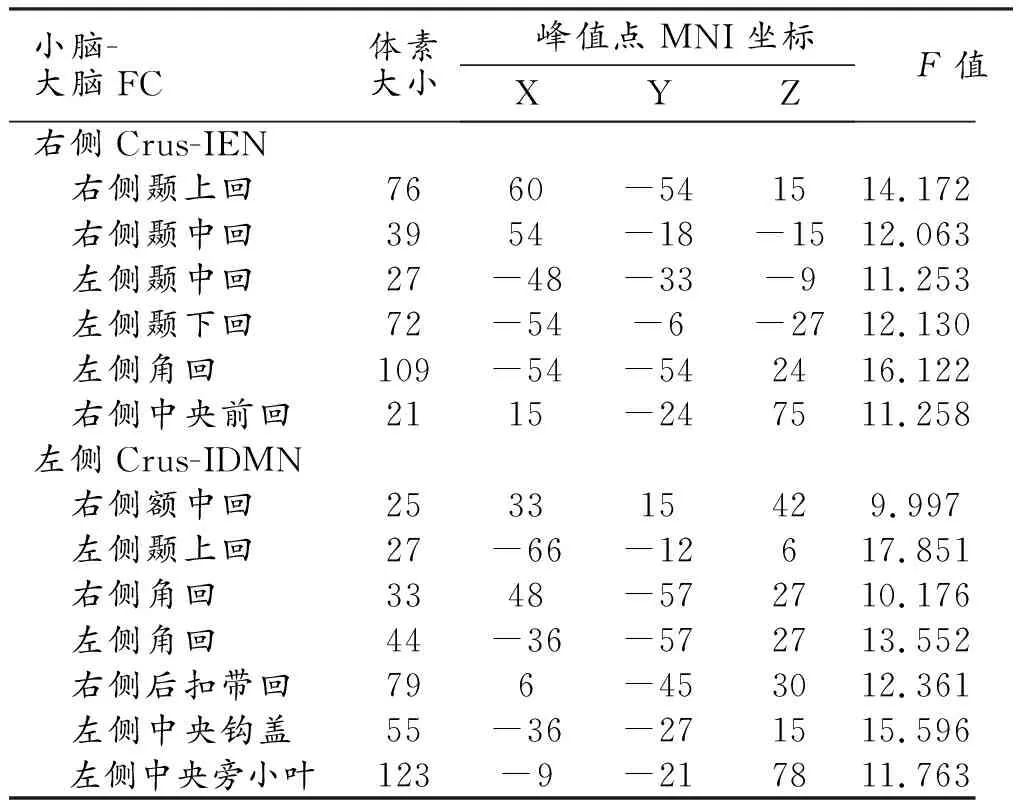
表3 三组被试小脑-大脑间功能连接差异脑区的特征
对小脑-大脑间FC值进行组间两两比较,结果详见图3~4。与HC组相比,SI组和NSI组小脑右侧Crus-IEN与右侧颞上回、双侧颞中回、左侧颞下回和左侧角回的FC值降低,与右侧中央前回的FC值升高,组间差异均有统计学意义(P<0.05)。SI组右侧Crus-IEN与左侧颞中回和左侧颞下回的FC值较NSI组升高,差异有统计学意义(P<0.05)。与HC组相比,SI组和NSI组左侧Crus-IDMN与右侧额中回、左侧角回和右侧后扣带回的FC值降低,与左侧颞上回、左侧中央钩盖和左侧中央旁小叶的FC值升高,组间差异均有统计学意义(P<0.05)。与NSI组和HC组相比,SI组左侧Crus-IDMN与右侧角回的FC值显著降低(P<0.05)。

图3 三组被试右侧Crus-IEN-大脑间FC值的组间多重比较结果的条形图。 图4 三组被试左侧Crus-IDMN-大脑间FC值的组间多重比较结果的条形图。
3.相关性分析结果
右侧Crus-IEN与左侧角回的FC值与HAMD24总分和阻滞因子呈负相关(r=-0.308,P=0.019;r=-0.315,P=0.016);右侧Crus-IEN与右侧颞上回的FC值与体质量因子和日夜变化因子均呈负相关(r=-0.273,P=0.038;r=-0.311,P=0.017);右侧Crus-IEN与左侧颞下回的FC值与认知障碍因子呈负相关(r=-0.263,P=0.046)。左侧Crus-IDMN与右侧额中回、右侧后扣带回的FC值与体质量因子均呈负相关(r=-0.295,P=0.025;r=-0.289,P=0.028);左侧Crus-IDMN与左侧中央钩盖的FC值与体质量因子呈正相关(r=0.278,P=0.035);左侧Crus-IDMN与左侧中央旁小叶的FC值与睡眠障碍因子呈正相关(r=0.382,P=0.003);左侧Crus-IDMN与左侧颞上回的FC值与自杀危险因子呈负相关(r=-0.277,P=0.035)。
讨 论
小脑的多种功能主要依赖于其内功能独立的各个子区域[18]。小脑的各个子区域与大脑的不同区域之间相互连接,形成复杂的小脑-大脑环路,参与调节执行控制、默认模式、情感和运动功能[17]。既往有研究发现抑郁症患者的小脑子区域与执行控制、DMN、情感-边缘相关的大脑区域之间静息态FC值发生了改变,表现出FC值的减少或增加[16,19]。本研究首次分析了伴SI的抑郁症患者静息状态下小脑-大脑间FC的改变及其与病程、临床症状、自杀意念因子和自杀危险因子之间的关系,发现伴SI抑郁症患者在与执行网络、DMN有关的小脑子区域与大脑之间表现出静息态FC值的异常,且这些异常改变的FC值与患者的临床症状和自杀危险程度具有相关性。执行网络是一个任务积极网络,与注意力控制、计划和决策有关[20]。DMN在没有目标导向任务时被激活,与情绪的调节和认知功能有关,包括自我参照心理活动、自传体记忆和内外环境监测等[21]。伴SI的抑郁症患者还可见小脑与运动和感觉相关的大脑区域(中央前回、中央旁小叶)之间的FC值升高。本研究结果提示伴SI的抑郁症患者小脑-大脑间FC的改变可能是其认知和情绪处理功能障碍的生理基础,为伴SI的抑郁症患者的小脑-大脑间交流提供了新的见解。
本研究中发现与NSI组相比,SI组的右侧Crus-IEN与左侧颞中回和颞下回之间的FC值升高;SI组和NSI组的右侧Crus-IEN与左侧颞中回和颞下回之间的FC值降低。左侧颞中回属于执行网络的一部分,参与语义控制功能,能够整合来自DMN的信息[22]。颞下回属于DMN,与情绪加工和社会认知功能有关[23]。研究表明抑郁症患者颞中回、颞下回的脑活动减低,提示抑郁症患者存在颞叶的功能障碍[24]。Chen等[25]发现与NSI组相比,SI组的左侧颞中回局部脑活动增加,表明伴自杀意念抑郁症患者在语义处理方面较不伴自杀意念者存在代偿性脑活动增加。此外,右侧Crus-IExec1与颞下回的FC值与认知障碍因子呈负相关,这说明小脑-颞下回的FC值越低,伴SI的抑郁症患者的认知障碍越严重。颞叶FC障碍可能与伴SI的抑郁症患者的语义处理、情绪加工和认知障碍相关。
与NSI组和HC组相比,SI组的左侧Crus-IDMN与右侧角回的FC值降低,提示DMN功能受损可能与抑郁症患者的自杀意念有关。有研究结果表明青少年抑郁症患者的自杀行为可能与DMN的异常FC有关[26]。角回是DMN的关键脑区,参与语义处理和语句理解[27]。Lee等[28]发现自杀未遂的抑郁症患者角回的体积缩小,与患者的绝望感呈负相关,可能是抑郁症患者自杀倾向的神经生物学标志。本研究发现SI组和NSI组右侧Crus-IExec1、左侧Crus-IDMN与左侧角回的FC降低。研究表明抑郁症患者的DMN与执行网络存在功能上的联系[29]。小脑与左侧角回的FC值与HAMD24总分和阻滞因子评分呈负相关,提示伴自杀意念抑郁症患者的小脑与角回的FC越低下,抑郁症状越严重,行动越迟缓。
额中回、后扣带回和颞上回均属于DMN。本研究结果显示抑郁症患者的小脑与颞上回之间的FC值升高,推测其可能是小脑与额中回、后扣带回之间FC值降低的代偿途径,抑郁症患者在DMN有关的小脑区域与大脑之间存在FC异常改变,可能会出现情绪调节和认知功能障碍。此外,小脑-大脑间的FC值与体质量因子、自杀危险因子评分呈负相关,说明小脑-大脑间的FC值越低,抑郁症患者的体重下降越严重,实施自杀的可能性越大。研究表明抑郁症患者在DMN有关的小脑区域与额下回、内侧前额叶皮层和颞上回的FC值升高[19,30],与本研究结果有所不同,笔者认为可能与不同研究中研究对象、数据处理方法、扫描参数和校正水平存在差异有关。此外,本研究中SI组的HAMD24总分及认知障碍、绝望感因子的评分均高于NSI组,说明伴SI的抑郁症患者疾病严重程度、认知障碍和绝望感均较不伴SI者严重,提示需对伴SI的抑郁症患者给予更多的关注和制订更精准的治疗方案。
本研究存在几项局限性:①本研究是一项横断面研究,需加入纵向研究进一步深入分析;②样本量相对较少;③基于既往研究中对小脑-大脑间FC的分析结果[11,12,15,16],本研究中主要关注每个小脑子区域与大脑间FC的改变,没有对基于ROI的FC分析的次数以及相关性分析进行多重比较校正。本研究为探索性研究,研究结果有助于初步理解小脑-大脑间FC的异常改变及其与临床症状之间的关系,在未来需要采用更为严格的校正方法进一步进行验证。
总之,伴自杀意念首发抑郁症患者存在小脑-大脑间FC的紊乱,主要分布在执行网络和DMN,颞叶和角回的FC障碍可能与自杀意念有关,小脑-大脑间FC的改变可作为区分伴或不伴自杀意念抑郁症患者的影像学特征。参与认知和情感处理的小脑和大脑间的信息交流障碍进一步证明了小脑参与伴自杀意念抑郁症患者疾病早期的病理生理学发生机制,表明小脑-大脑环路可能是改善患者临床症状的干预靶点,这可能用于未来进一步研究伴自杀意念抑郁症患者的个体化治疗。
