MRI影像组学无创预测脑胶质母细胞瘤MGMT启动子甲基化状态的价值
2024-04-23马千昂卢俊董亚锋曲金荣
马千昂,卢俊,董亚锋,曲金荣
胶质母细胞瘤(glioblastoma,GBM)是脑内最常见的原发恶性肿瘤,预后较差。2021年第五版WHO中枢神经系统肿瘤分类中,对GBM做出了全新的定义,不仅将异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)野生型的WHO Ⅳ级星形细胞瘤定义为GBM,而且对于组织学分级较低的IDH野生型弥漫性星形细胞瘤,如果其存在预后不良分子特征,也将其归类为GBM[1]。目前,胶质瘤的分类更加依赖于分子标志物,分子特征与胶质瘤患者的治疗方案及预后密切相关。O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)是一种DNA修复酶,MGMT启动子甲基化状态(promoter methylation,PM)可以增加GBM对替莫唑胺等烷基化剂的敏感性,在GBM患者,尤其是年老体弱失去手术机会的患者中,评估MGMT启动子的甲基化状态对治疗方案的选择和预后评估具有重要临床价值[2-3]。目前,对该分子特征的评估是有创性的,检测周期长,费用昂贵,且因病理标本取样时存在空间和时间异质性,可能会导致结果不准确[4]。已有研究表明MRI定量参数在胶质瘤的鉴别诊断、分级评估、分子特征预测及预后评估中显示出一定的潜力,尤其是影像组学技术通过高通量获取肿瘤的特征,能够无创性评估肿瘤全域的异质性,发挥出更大的临床价值[5-8]。既往采用影像组学特征预测MGMT启动子甲基化的相关研究中,AUC差异较大(0.590~0.916),且均未纳入对比增强序列[7]。本文探讨基于术前表观扩散系数(ADC)和三维对比增强T1加权成像(3D contrast enhanced T1-weighted imaging,3D-CE-T1WI)序列建立的影像组学模型无创性预测MGMT启动子甲基化状态的价值,旨在为临床提供更多参考。
材料与方法
1.一般临床资料
回顾性分析2018年1月-2021年10月在本院经病理证实且符合本研究要求的130例GBM患者的病例资料。纳入标准:①病理证实为IDH野生型WHO Ⅳ级星形细胞瘤,或WHOⅡ~Ⅲ级IDH野生型弥漫性星形细胞瘤且存在TERT启动子突变、EGFR扩增和+7/-10拷贝数变化三种分子分型中任一类型改变者;②有完整的ADC和3D-CE-T1WI图像资料;③对肿瘤的病理标本进行了焦磷酸测序,获得了肿瘤的MGMT甲基化状态的相关结果,甲基化率≥8%视为MGMT-PM阳性,否则视为MGMT-PM阴性[9]。排除标准:①MRI检查前未接受过抗肿瘤相关治疗;②MRI图像质量差。最终,将130例GBM患者纳入研究,按7∶3的比例将所有患者随机分为训练集(91例)和验证集(39例)。
2.检查方法
使用Siemens Skyra 3.0T MR扫描仪和头部专用8通道相控阵线圈进行检查。①首先完成常规序列(T1WI、T2WI和FLAIR)MRI扫描;②然后行DWI扫描,并由系统自动生成ADC图像,扫描参数:TR 2610 ms,TE 55 ms,矩阵160×160,层厚6.0 mm,层间距0.6 mm,激励次数1,b=0、1000 s/mm2。③最后,行3D-CE-T1WI扫描,扫描参数:TR 1700 ms,TE 2.5 ms,层厚1.0 mm,层间距0 mm,矩阵288×288,视野256 mm×256 mm;对比剂为Gd-DTPA,剂量0.1 mmol/kg,注射流率2.5 mL/s。
3.肿瘤分割和特征提取
使用3D Slicer软件(版本号:4.11.20210226)中General registration(BRAINS)工具箱将每例患者的ADC和3D-CE-T1WI图像进行配准。然后,使用Volumes模块调节图像亮度,以便更好地观察病灶。由两位具有3年以上影像诊断经验的放射科医师独立在3D-CE-T1WI图像上逐层沿肿瘤边缘勾画ROI,勾画时应避免将瘤周水肿纳入;然后,由系统生成肿瘤全域的容积感兴趣区(volume of interest,VOI),将VOI存为标签(label);最后,将标签复制到配准后的ADC图像上,得到相同位置的ROI和VOI(图1)。将VOI的数据导入软件PyRadiomics 3.0.1中提取影像组学特征。

图1 患者,女,66岁,IDH野生型、MGMT-PM+、WHO Ⅳ级星形细胞瘤。由两位医生独立在3D-CE-T1WI上逐层沿肿瘤边缘勾画ROI,得到VOI,将VOI存为标签,复制到配准后的ADC图像上,得到一致的每层ROI及VOI。a)CE-T1WI图像,绿色区域代表该层面的ROI,由医生勾画获得;b)逐层勾画ROI后,软件自动生成肿瘤全域的三维容积VOI;c)ADC图,绿色区域代表复制VOI后获得的该层面的ROI。
1个月后,随机选取50例患者的图像,由高年资医师再次勾画ROI。采用组间和组内相关系数(interclass correlation coefficient,ICC)评价两位医师之间以及同一医师不同时间段勾画ROI所提取的各项组学特征的一致性。ICC均>0.85的特征参数被认为一致性较好而被保留,然后将其由高年资医师勾画获得的结果用于后续分析。
4.特征筛选和预测模型的构建
采用最小绝对收缩和选择算法(least absolute shrinkage and selection operator,LASSO)结合10折交叉验证对提取的组学特征进行降维。将保留下来的特征与其对应的系数进行线性组合,得到组学模型并计算其影像组学评分(Radscore)。分别基于ADC、3D-CE-T1WI及两者的联合序列进行计算,可获得3个组学模型和对应的Radscore(RadscoreADC、RadscoreCE-T1WI和Radscore联合)。采用ROC曲线评估3个模型的预测效能,将其中预测效能最优的影像组学评分与临床资料中的年龄、性别等特征联合纳入多因素logistic回归分析,构建术前无创预测MGMT-PM状态的临床-组学综合模型,并绘制其诺模图实现模型的可视化。
5.统计分析
使用SPSS 22.0、MedCalc和R4.1.0软件进行统计学分析。计数资料的组间比较采用卡方检验或Fisher确切概率法;对计量资料先进行数据正态性和方差齐性检验,然后分别采用独立样本t检验(呈正态分布)或Mann-WhitneyU检验(非正态分布)进行组间比较。采用ROC曲线评价模型的预测效能。采用Hosmer-Lemeshow检验及校准曲线评价MGMT-PM预测模型的拟合优度,并采用bootstrap法抽样1000次进行内部验证。采用决策曲线评价模型的临床价值。以P<0.05为差异具有统计学意义。
结 果
1.临床特征的比较
训练集和验证集中临床资料的组间比较结果详见表1。两个数据集之间年龄、性别、WHO分级和MGMT-PM状态的差异均无统计学意义(P>0.05)。
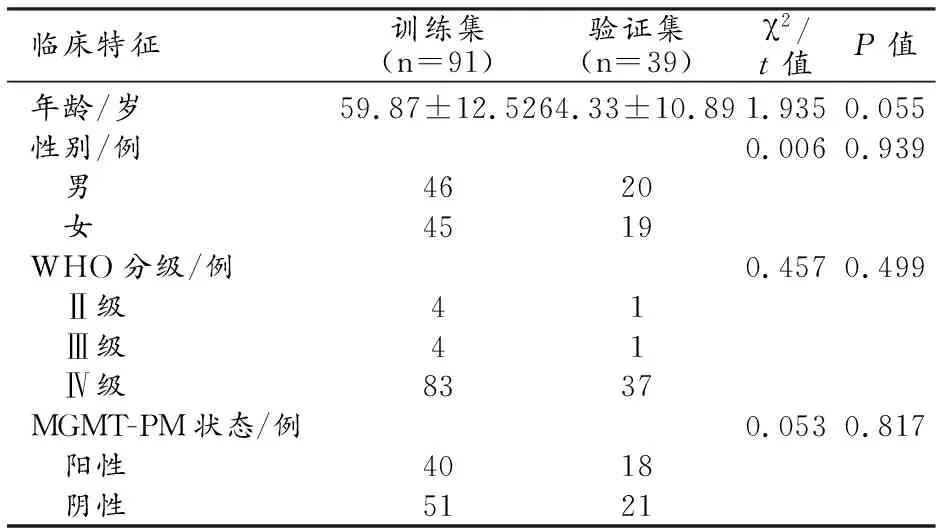
表1 训练集和验证集中临床资料的比较
2.特征筛选和模型的构建及评估
基于ADC图和3D-CE-T1WI序列分别提取851个组学特征,其中形状特征14个、一阶特征18个、纹理特征75个和小波特征744个。75个纹理特征中,灰度共生矩阵(gray-level co-occurrence matrix,GLCM)特征 24个,灰度游程矩阵(gray-level run-length matrix,GLRLM)特征16个,灰度大小区域矩阵(gray-level size zone matrix,GLSZM)特征16个,灰度相关矩阵(gray level dependence matrix,GLDM)特征14个,邻域灰度差矩阵(neighbouring gray tone difference matrix,NGTDM)特征5个。
基于ADC图和3D-CE-T1WI序列分别提取的组学特征中,ICC均>0.85的特征分别为409和591个。经组间差异性分析,MGMT-PM阳性组与MGMT-PM阴性组之间有统计学差异的特征参数分别为40和29个。经LASSO回归分析,自ADC图、3D-CE-T1WI序列以及二者联合序列中分别筛选出4、7和12个特征参数。每个特征与其对应的系数进行线性结合,可计算得到3个模型和3个Radscore。
采用ROC曲线评估模型的预测效能,结果详见表2。其中,Radscore联合的预测效能最高,其线性计算公式:Radcore联合=0.1162653+0.0000642499×Maximum(ADC)+4.8124×MaximumProbability(ADC)+7.339205×LowGrayLevelRunEmphasis(ADC)+0.009419942×GrayLevelVariance(ADC)+6.898011×Coarseness(ADC)+2.674768×Contrast(ADC)-0.0009392796×10Percentile(CE-T1WI)+1.231613×Idmn(CE-T1WI)-0.000395875×Maximum(CE-T1WI)-0.02996155×DependenceVariance(CE-T1WI)-0.02651271×Skewness(CE-T1WI)-1.187679×MCC(CE-T1WI)。
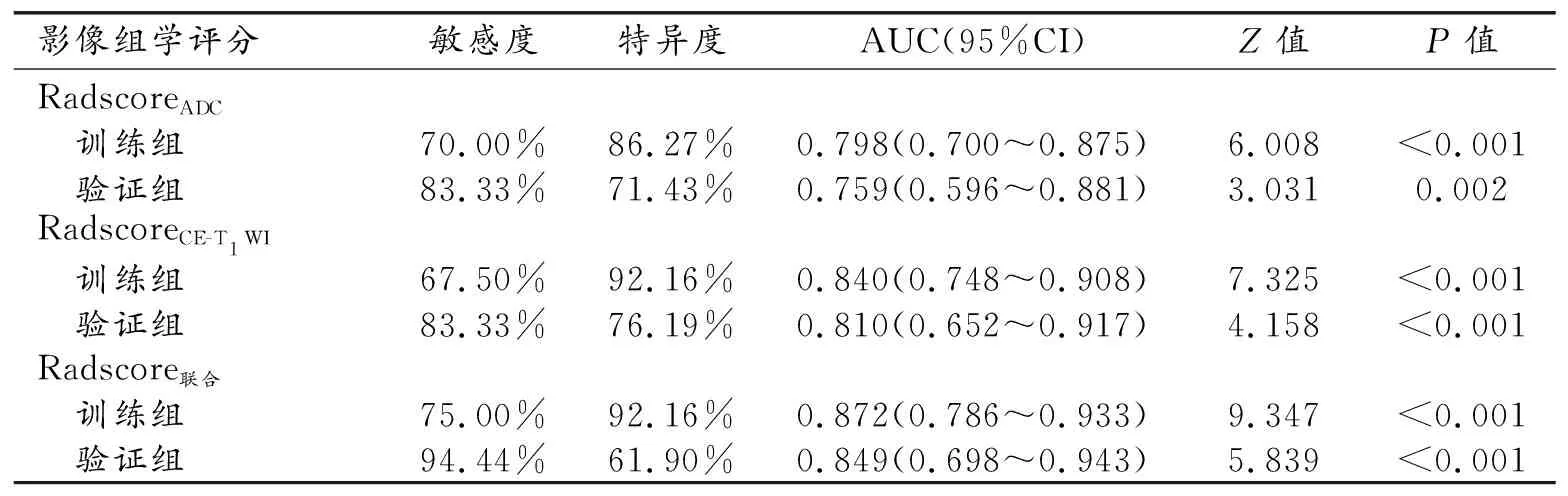
表2 影像组学评分在训练集和验证集中预测MGMT-PM状态的效能
联合Radscore联合、年龄和性别等特征,通过逻辑回归分析构建MGMT-PM状态的术前无创性综合预测模型,采用ROC曲线评估其诊断效能,并绘制诺模图将模型可视化,结果见图2~3。在训练集中,综合模型的AUC、敏感度和特异度分别为0.904(95%CI:0.825~0.956)、92.50%和78.43%;在验证组中,其AUC、敏感度和特异度分别为0.881(95%CI:0.737~0.962)、83.33%和80.85%(图2)。
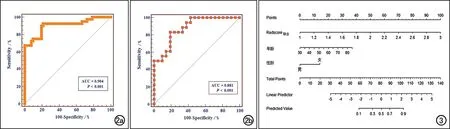
图2 预测GBM患者MGMT-PM状态的综合模型的ROC曲线。a)训练集;b)验证集。 图3 预测GBM患者MGMT-PM状态的综合模型的诺模图。
Hosmer-Lemeshow检验结果表明:在训练集和验证集中,综合模型的拟合度均较好(P=0.051、0.284)。校准曲线显示综合模型的预测概率与实际概率之间无明显统计学差异(图4)。决策曲线的曲线下面积代表预测模型净获益的大小,相对于所有患者均行焦磷酸测序获取MGMT-PM状态和所有患者均不行此项分子检测,该预测模型能为GBM患者带来较高的临床获益,具有一定的临床价值(图5)。

图4 预测MGMT-PM状态的综合模型的校准曲线,在训练集和验证集中,模型的拟合度均较好。a)训练集中,模型预测概率与实际概率之间的差异无统计学意义(P=0.051);b)验证集中,模型预测概率与实际概率之间的差异无统计学意义(P=0.284)。 图5 综合模型预测MGMT-PM状态的决策曲线。X轴代表阈值概率,Y轴代表净获益,曲线下面积代表获益大小。在训练集和验证集中,该预测模型均表现出较高的临床获益,表明模型具有一定的临床应用价值。a)训练集;b)验证集。
讨 论
本研究基于ADC图和3D-CE-T1WI序列提取的影像组学特征,联合年龄和性别等临床特征,构建了术前无创性预测GBM患者MGMT-PM状态的综合模型。诊断效能分析结果显示,多序列联合的影像组学分数的预测效能优于单一序列,临床特征的引入进一步提高了模型的预测效能,综合模型在训练集和验证集中均取得了较好的预测效能,表明基于影像组学分析多序列MRI构建的综合模型在术前无创性预测GBM患者MGMT-PM状态、指导临床制订个性化治疗方案及预后评估方面可能均具有一定的临床应用价值。
理论上,MGMT可以通过血管内皮生长因子A和血管内皮生长因子受体2等正性调节因子调节血管生成,而在MGMT启动子甲基化的GBM患者中这一途径可能被抑制,从而增加了肿瘤对烷化剂的敏感性[10]。Lu等[11]和He等[12]利用MRI定量参数建立模型来评估MGMT-PM状态,构建的模型的AUC为0.802~0.849,但是该模型未在验证集中进行验证。本研究引入了临床特征,丰富了模型的评价尺度,并且在验证集中得到了相似的结论,验证了模型的可靠性,与Wei等[7]的结论基本一致。王岩等[13]基于DWI和T2WI建立多序列影像组学预测模型,并与单一序列模型的效能进行比较,结果显示多序列模型的预测效能有所提高,与本研究结果一致。
本研究中联合两个序列的影像组学特征构建的联合模型的预测效能优于单一序列,笔者分析原因为:ADC图像能够反映水分子扩散受限区域,但是图像上病灶的边界较模糊,而3D-CE-T1WI图像对病灶的边界等形态学特征的显示较好,两个序列的信息正好互补,即联合分析既提供了肿瘤全域的细胞增殖信息,又包含了血脑屏障破坏的信息,而且这与临床诊疗时的阅片经验也是一致的。Chen等[9]的研究结果表明,同时评估细胞增殖和血流情况可以提高对MGMT-PM状态的预测效能。经查阅文献,发现既往的相关研究中尚未纳入增强扫描序列,而本研究证实了增强扫描序列预测MGMT-PM状态的可行性。在3D-CE-T1WI序列上可准确识别病灶边界,为后续开展深度学习、保证病灶标注的准确性等奠定了研究基础。此外,本研究中采用三维CE-T1WI,与以往二维成像时常规采用的3.0~5.0 mm的层厚相比,1.0 mm的扫描层厚可能提供了更为准确的影像组学特征信息。但是,本研究中采用的手动分割ROI的方法提高了时间成本,确认了基于3D-CE-T1WI提取的影像组学特征有助于识别MGMT-PM状态后,在今后的研究中可借助半自动图像标注工具,完成有监督学习的数据标注,减少ROI的勾画时间,节约研究的时间成本。
影像组学特征可以在像素水平上定量评估肿瘤的异质性[14]。最近的研究已经表明,影像组学模型在胶质瘤分子特征的预测中具有一定的潜力,在本研究中也得到了证实。在影像组学模型建立的过程中,特征选择也是构建组学模型的核心步骤,避免特征共线性才能提高预测效能,本研究中Hosmer-Lemeshow检验结果表明模型拟合度较好,模型的预测概率与实际概率之间一致性较高。本研究中还通过绘制诺模图实现了模型可视化,将影像组学分数、年龄和性别等特征带入诺模图得到每一项对应的分数,再将各项的分数相加得到一个总分,向下投影即可得到预测MGMT-PM状态的概率值。利用简单的图形工具完成复杂的统计学预测,增强结果的可读性,有助于该模型在临床的推广。
本研究存在一定的局限性:首先,样本量有限,今后需进一步扩大样本量,积极开展多中心、大样本实验来提高模型的稳健性;其次,今后还可结合病理进一步探讨影像组学模型的生物学意义,进一步提高模型临床应用的可行性[15]。
总之,基于ADC图和3D-CE-T1WI序列提取的影像组学特征构建的预测模型有助于术前无创性预测胶质母细胞瘤MGMT启动子甲基化状态,绘制模型的诺模图有助于临床应用和推广,可为临床治疗决策和预后评估提供较可靠的影像学依据。
