肝豆状核变性患者默认模式网络变化及模型构建
2024-04-23吴素红武红利王弈王安琴
吴素红,武红利,王弈,王安琴
肝豆状核变性(Wilson’s disease,WD)是一种由ATP7B基因突变引起的遗传性常染色体隐性疾病,可导致铜代谢缺陷,铜在身体器官,尤其是大脑基底神经节中逐渐蓄积[1]。铜过量堆积可引起神经元损伤,包括中枢神经髓鞘溶解、脱髓鞘和星形胶质细胞病变、空洞化和铁的异常沉积等,导致神经系统相关疾病和神经精神症状,如运动和行为功能障碍[2]。临床上青霉胺可用于“驱铜”治疗,以减缓病情恶化的进程[3]。然而,WD患者的预后仍然无法确定,大多数患者长期受到神经系统症状甚至残疾的困扰。
近年来,神经影像技术的发展为探索WD患者脑损伤的潜在神经功能机制提供了新的途径,大量的神经影像学相关研究均证实了WD患者大脑结构和功能发生了异常改变,包括大脑中不同程度的功能连接(functional connectivity,FC)变化[4-5]。人们已经认识到,大脑是一个由高度互联的神经元组成的复杂网络,由多个功能子网络组成并相互作用以维持整个大脑的活动[6-7]。Han等[8]以扣带皮层为种子点,基于图论分析功能脑网络探索WD患者中默认模式网络(default-mode network,DMN)的变化,结果显示:与健康对照组相比,WD患者的局部和全局功能网络的效率降低,左下颞叶皮层和右外侧顶叶皮层之间的功能连接与注意功能障碍相关。独立成分分析(independent component analysis,ICA)是一种数据驱动的多变量方法,无需先验假设和传统的模型驱动,适用于对静息态脑功能网络的分析[9]。同时,人工智能技术在医学领域发展迅速,其中机器学习方法是应用最多的方法之一,其主要作用是通过训练模型来实现对疾病的分类和预测[10]。目前还尚未见利用机器学习方法训练和构建预测WD患者脑功能变化的预测模型的相关研究。
本研究尝试采用ICA方法探索WD患者DMN功能连接的改变及其与临床神经精神特征评估结果之间的关系,了解潜在的病理生理学和中枢补偿性机制,并通过机器学习方法以DMN功能连接作为特征构建预测模型,旨在识别WD患者早期脑网络功能连接变化,提高对疾病发展的预测效能。
材料与方法
1.研究对象
将2021年1月-2021年12月就诊于本院脑病中心的85例WD患者的临床和MRI资料。纳入标准:①临床根据神经精神症状、Kayser-Fleischer环、低血清脑磷脂酶水平、铜依赖性氧化酶活性降低和24小时尿中铜排泄量增加等指标,确诊为WD患者[11];②无其它神经精神疾病,也未使用过神经或精神类疾病的相关药物;③无磁共振检查禁忌证,如幽闭恐惧症或安装了心脏起搏器;④右利手。
采用统一肝豆状核变性评分量表(UWDRS)对患者的行为认知功能进行评估,此量表包括两部分内容:神经部分(UWDRS-neurological characteristic examination,UWDRS-N),包括日常活动(分值为0~36分)和神经功能检查(分值为0~112分);精神部分(UWDRS-psychiatric symptoms examination,UWDRS-P),分值为0~76分。
同期招募了年龄和性别相匹配的85例健康受试者(healthy control,HC)。纳入标准:①无神经精神类疾病;②未使用过神经或精神类药物;③无磁共振检查禁忌证;④右利手。
WD患者及健康对照者均签署了知情同意书。本研究获得了本院伦理委员会的批准。
2.MRI数据采集
使用GE Discovery MR750 3.0T扫描仪进行全脑扫描。静息态fMRI采用血氧水平依赖梯度回波序列,扫描参数: TR 2000 ms,TE 30 ms,层厚3.0 mm,层间距1.0 mm;视野220 mm×220 mm,采集矩阵64×64;翻转角90°,扫描层数36。常规结构像3D-T1WI扫描参数:TR 8.2 ms,TE 3.2 ms,厚度1.0 mm;层间距0,视野256 mm×256 mm,采集矩阵256×256,翻转角12°,层数166。每例被试扫描完成后均及时核查各序列MRI图像,避免因伪影或头部移动而影响随后的图像后处理和分析。
3.数据分析
静息态fMRI数据预处理:利用MRIcroN软件将图像格式转换成nii格式;基于MATLAB R2016b(MathWorks,Natick,MA)软件平台,使用DPARSFA 6.0软件(http://rfmri.org/DPABI)对图像进行一系列预处理步骤:①考虑到患者对扫描环境的适应过程及扫描过程中磁化的稳定性,剔除了前10个时间点的fMRI数据;②将剩余175个时间点的fMRI数据进行时间层校正和头动校正,以确保图像在各采集时间点保持一致,并删除各时间点图像上头动超过2 mm或最大旋转角度超过2°的被试;③使用非线性配准,将个体图像配准到蒙特利尔神经科学研究所(Montreal Neurological Institute,MNI)标准空间,重采样体素大小为3 mm×3 mm×3 mm;④使用平滑核为6mm的全高半宽进行高斯平滑。
ICA是一种没有先验假设数据驱动的多变量方法。本研究使用GIFT软件(http://icatb.sourceforge.net/,version 3.0c)来提取DMN的成分。具体步骤和方法:①采用分组ICA方法将不同时间点的个体数据串联起来,随后计算特定主体的成分和时间过程;②采用ICA进行数据还原,基于最小描述长度来估计网络数量。③为保证数据的可重复性,采用Infomax算法提取每个分量的独立空间图和时间历程,在ICASSO工具箱中进行了100次运算。④用群体ICA反向重构法接收个体时间历程和空间图。反向重建后,个体水平空间图被转换为Z-score。Z-score反映了功能连接的强度。识别DMN后,对患者组与HC组的相应Z-score图进行了单样本t检验,并建立掩膜校正(体素水平FWE校正,P<0.05),簇体素大小>100体素。随后,对掩膜内的Z-score图进行双样本t检验,将年龄和性别作为回归的协变量,以探寻组间脑功能网络的区域差异(团块水平FWE校正,P<0.05)。得到具有显著组间差异的脑区,提取该脑区的FC值,并将其与临床量表评分进行Pearson相关性分析。
构建支持向量机(support vector machine,SVM)分类器:将WD组和HC组中提取的前DMN(ante-rior-DMN,aDMN)和后DMN(posterior-DMN,pDMN)内每个体素的FC值作为特征,采用MATLAB平台提供的MVPANI软件包进行分析[12]。使用10折交叉验证进行数据迭代,对特征进行标准化,再使用ICA对参数进行降维处理,得到WD组与对照组之间最优的SVM模型并进行置换检验。再基于UWDRS评分将WD患者分为2组(二分类),即根据UWDRS评分将患者分为神经精神症状重度组(>10分)和轻度组(≤10分),同样使用10折交叉验证迭代算法对特征进行标准化,然后采用ReliefF算法进行每个体素的FC值的特征选择,采用F分数值位于前百分之十的特征,得到高UWDRS评分组与低UWDRS评分组之间最优的SVM模型并进行置换检验。
4.统计学分析
使用SPSS 27.0统计软件包进行统计分析,以P<0.05为差异具有统计学意义。连续变量的组间比较采用独立双样本t检验,分类变量的组间比较采用χ2检验。采用MVPANI软件包对模型的效能进行ROC曲线分析,计算AUC、敏感度和特异度等指标,并对模型效能进行5000次置换检验。采用独立双样本t检验对HC组与WD组之间的FC值进行组间比较,以Cohen′s d值表示功能连接的差异强度。提取有差异脑区的FC值,并与临床指标(包括UWDRS-N评分、UWDRS-P评分和病程)进行Pearson相关性分析。以P<0.05为差异有统计学意义。
结 果
1.人口学资料的比较
WD组男53例、女32例,HC组男49例、女36例;WD组年龄(27.40±8.05)岁,对照组(25.83±5.5)岁;两组之间性别构成和年龄的差异均无统计学意义(χ2=0.39,P>0.05;t=1.56,P>0.05)。
2.DMN的提取
ICA提取大脑DMN的成分(图1),主要包括aDMN和pDMN,aDMN包括内侧前额叶皮层、前扣带回,pDMN包括后扣带回、顶下小叶、楔前叶及双侧颞叶。
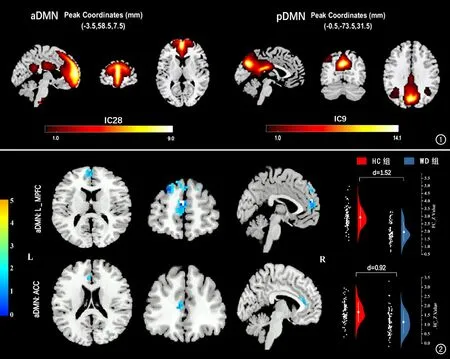
图1 不同方位结构像上显示基于ICA提取的DMN成分图,包括前默认模式网络(aDMN)和后默认模式网络(pDMN),彩色条代表T值,反映的是功能连接差异的显著性。 图2 不同方位结构像上蓝色区域为WD患者aDMN内功能连接变化脑区,右侧为小提琴图,d值代表标准差差异效应大小,圆点代表中位数位置。 与HC组比较,患者组的左侧内侧前额叶(L_ MPFC)及前扣带回(L_ACC)的FC值减低(双样本t检验,团块水平FWE校正,P<0.05)。
3.静息态DMN内功能连接的比较
在aDMN及pDMN内部,与对照组相比,WD患者表现出广泛的功能连接减低(表1),主要包括aDMN内的L_ MPFC和L_ACC(图2),pDMN内的 L_ANG、PCUN、L_IPG和L_PCC(图3)。
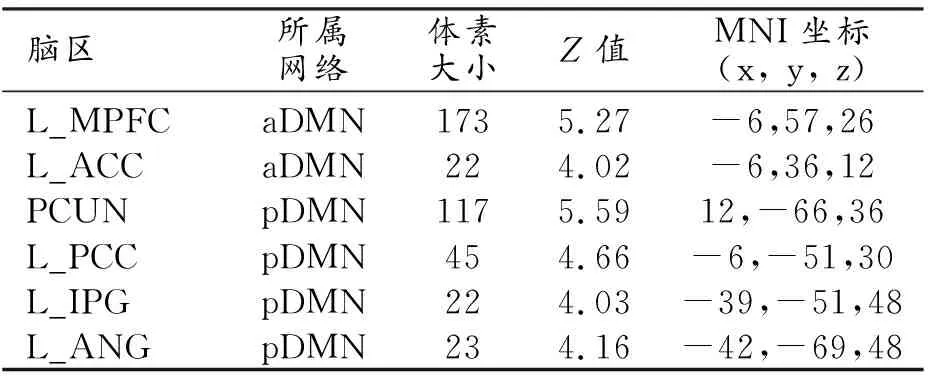
表1 与HC组比较WD组DMN内FC发生变化的脑区

图3 不同方位结构像上蓝色区域为与HC组比较,WD患者pDMN网络内功能连接变化脑区,右侧为小提琴图,d值代表标准差差异效应大小,圆点代表中位数位置。 可以看出WD患者的楔前叶(PCUN)、左侧角回(L_ANG)、顶下小叶(L_IPG)和后扣带回(L_PCC)的FC值减低(团块水平FWE校正,P<0.05)。
4.组间差异脑区的FC值临床资料的相关性
对于WD组与HC组之间FC值的组间差异有统计学意义的脑区,提取这些脑区的FC值与临床量表评分进行相关性分析,结果详见图4~5。aDMN内L_MPFC、L_PCC的FC值与UWDRS-N评分呈负相关(r=-0.27,P<0.05;r=-0.27,P<0.05),与UWDRS-P评分呈负相关(r=-0.35,P<0.01;r=-0.32,P<0.05)。pDMN内PCUN的FC值与UWDRS-N评分呈负相关(r=-0.27,P<0.05),L_IPG的FC值与UWDRS-P评分呈负相关(r=-0.25,P<0.05)。
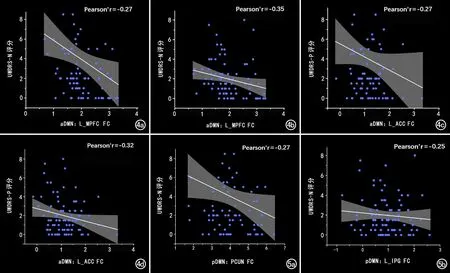
图4 WD患者aDMN内异常脑区的FC值与UWDRS量表评分的相关性分析点线图。a)L_MPFC的FC值与UWDRS-N呈评分负相关(r=-0.27,P<0.05);b) L_MPFC的FC值与UWDRS-P评分呈负相关(r=-0.35,P<0.01);c)L_ACC的FC值与UWDRS-N评分呈负相关(r=-0.27,P<0.05);d)L_ACC的FC值与UWDRS-P评分呈负相关(r=-0.32,P<0.05)。 图5 pDMN内异常脑区的FC值与UWDRS量表评分的相关性。a)PCUN的FC值与UWDRS-N评分呈负相关(r=-0.27,P<0.05);b)L_IPG的FC值与UWDRS-P评分呈负相关(r=-0.25,P<0.05)。
各组间差异脑区的FC值与患者病程之间均无显著相关性(P>0.05)。
5.SVM分类器的构建
使用10折交叉验证进行数据迭代,将DMN内每个体素的FC值作为特征,然后采用主成分分析(Prin-cipal Component Analysis,PCA)方法进行降维或采用ReliefF算法进行特征选择后,训练出最优SVM模型。在WD组与HC组之间,以aDMN和pDMN内体素的FC值作为特征,通过训练得到最优模型 ,其鉴别WD与HC的符合率为80.23%,AUC为0.865(图6a);经过5000次置换检验后,得到P<0.0002(图6b)。在高与低UWDRS评分组之间,同样以aDMN和pDMN的FC值作为特征,训练得到最优SVM模型,其鉴别高与低UWDRS评分组的符合率为70.89%,AUC为0.723(图7a);经过5000次置换检验后,P=0.0094(图7b)。
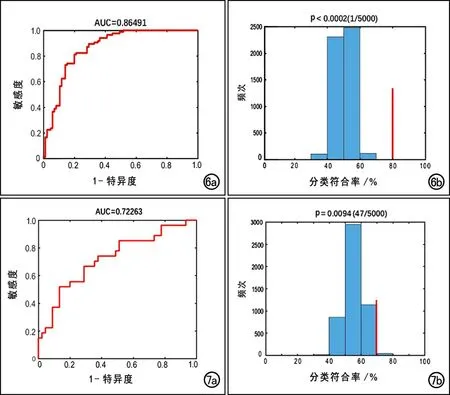
图6 aDMN和pDMN内FC值鉴别WD和HC的诊断效能分析。a)ROC曲线,AUC=0.86;b)条形图显示对FC的分类准确率进行5000次置换检验的结果,图中红色线条代表真实的分类准确率,进行5000次置换检验的分类准确率均小于真实准确率,得到的P<0.0002,提示其鉴别效能有统计学意义。 图7 aDMN和pDMN内FC值对高、低UWDRS评分的鉴别诊断效能分析。a)ROC曲线,AUC=0.72;b)条形图显示对FC的分类准确率进行5000次置换检验的结果,图中红色线条代表真实的分类准确率,进行5000次置换检验的分类准确率均小于真实准确率,得到的P=0.0094,提示其鉴别效能有统计学意义。
讨 论
既往的研究结果表明WD患者的大脑在功能和微观结构上发生了一定程度的变化[7,13]。在本研究中,我们基于rs-fMRI和ICA来研究WD患者大脑DMN内功能连接的变化,并与临床UWDRS量表评分进行相关性分析,结果显示:与对照组比较,WD患者DMN内表现出广泛的连接性减低,包括aDMN内的L_ MPFC和L_ACC,以及pDMN内的L_ANG、PCUN、L_IPG和L_PCC;而且,aDMN内的L_MPFC、L_PCC的FC值和pDMN内PCUN的FC值均与UWDRS-N评分呈负相关(P<0.05),aDMN内的L_MPFC、L_PCC和pDMN内的L_IPG的FC值均与UWDRS-P评分呈负相关(P<0.05)。
据文献报道,DMN在认知控制中起着核心作用[14],其在网络间的动态整合是高效认知操作和适应性行为的基础[15]。DMN作为人脑中与意识维持有关的基线状态的重要结构,与初级感知和高级认知处理的整合有关[16-17]。在本研究中,WD患者的DMN内出现了FC的改变。与HC组相比,WD患者的L_MPFC、L_ACC和PCUN的FC值减小;此外,L_MPFC、L_ACC和PCUN的FC值降低且其与UWDRS-N评分呈负相关,L_MPFC、PCUN的FC值降低且其与UWDRS-P评分呈负相关。这表明,DMN中脑组织的FC值降低可能导致WD患者出现神经和精神系统的相关症状。本研究结果与Han等[8]的研究结果基本一致, Han等[8]报道WD患者与正常对照组相比,DMN的FC发生了改变,局部和整体网络效率降低。作为DMN的一个关键节点,MPFC被认为是额叶中最高的联想设施之一,参与认知策略和自动传记检索,可以根据当前目标和未来计划协调心理过程和行动[18],MPFC不仅参与大脑对内外环境的整合,对价值判断和事件决策等发挥至关重要的作用。另外,一些研究已经证明了PCUN的贡献,它是一个参与高度综合认知任务的联想皮层[19],PCUN在情景记忆和自传体记忆等多种认知活动中发挥重要作用,是DMN中的重要节点。对WD患者的神经心理学损害的研究结果表明,WD患者的认知领域存在广泛的明显缺陷[20-21],而本研究中招募的患者在执行功能方面也有明显损害。因此,DMN网络的内的连接中断,导致高阶认知过程的失败,这可能是WD患者认知相关障碍的一种神经病理学基础。
近年来,机器学习方法已经较广泛地应用于解码隐藏在脑成像数据中的潜在规律,对认知功能障碍相关疾病的诊断和病情转归的预测等方面具有较大的优势[22-23]。目前应用较多的方法包括聚类算法、K近邻、随机森林和支持向量机(SVM)。SVM是一种对数据进行二分类的监督学习分类器,其边界就是距离两样本之间最大间隔的超平面,在处理高危多元特征中具有明显优势,被广泛应用于基于脑影像特征的分类问题[24-25]。在本研究中,我们将aDMN和pDMN内每个体素的FC值作为特征构建鉴别WD组与HC组的分类器,该分类模型的诊断符合率为80.23%,AUC为0.865,显示出在预测WD方面具有良好的效能。而WD是一种伴随终身且为数不多的可治疗的遗传性疾病[26],因此,对疾病转归趋势的预测,可为临床干预治疗提供坚实的理论基础。本研究中,根据UWDRS评分将WD患者分为神经精神症状较重组和较轻组,并基于前述的方法构建2组的分类器,其诊断符合率为70.89%,AUC为0.723,并对该分类器采用5000次置换检验进行校正后,其鉴别效能均具有统计学意义(P<0.01)。据本研究团队查阅文献,截至完稿,本研究是国内外首次在WD患者中利用静息态fMRI技术提取脑功能网络的FC值来构建分类模型。
本研究存在一定的局限性:WD是一种较罕见遗传性疾病,样本的搜集难度较大,虽然本研究的样本量不少,但是就机器学习而言,样本量仍然不够大,增加样本量以及增加外部数据集进行验证可进一步提高模型的诊断效能,进一步验证本研究结果的鲁棒性;其次,本研究中仅分析了DMN的特征,未分析其它功能网络的特征,训练模型的特征相对有限,在后续研究中,需纳入多维特征,如整个大脑区域脑图谱的功能及结构相关特征值,以提高模型的预测效能;最后,本研究中未考虑治疗因素,不同疗程及不同疗效的患者大脑静息状态下脑功能网络是否存在差异等,还需要进一步深入研究。
综上所述,WD患者的默认模式网络中存在广泛的功能连接减低,并可能是导致患者神经精神症状(如高阶认知障碍)的潜在神经病理机制。SVM分类器可提高DMN的特征在鉴别WD疾病及预测病情转归中的效能。
