丙酮酸激酶同工酶M2介导长非编码RNA RP11-879F14.2发挥抑制心肌细胞肥大作用
2024-04-23温艺红伍华燕姜佳雪陈凯茵刘宇鹏单志新
李 艺, 温艺红, 伍华燕, 姜佳雪, 欧 涛, 陈凯茵, 刘宇鹏, 单志新*
(1)南方医科大学附属广东省人民医院(广东省医学科学院)医学研究部广东省临床药理学重点实验室, 广州 510080;2)华南理工大学医学院, 广州 510006;3)南方医科大学附属广东省人民医院(广东省医学科学院)心内科, 广州 510080)
心肌肥厚是心脏在受到长期压力负荷后的代偿反应,可分为生理性或病理性肥厚,其特征为心肌细胞的体积增加和结构改变,并伴随着心肌收缩力的提高[1]。生理性心肌肥厚通常是由于体育锻炼等正常生理刺激所导致[2],而病理性心肌肥厚则与心血管病理性改变紧密相关,增加心衰(heart failure, HF)和其他严重心血管疾病的风险[3-5]。因此,深入研究心肌肥厚发生的病理机制将为心肌肥厚和心衰的治疗研究提供科学依据,具有重要意义。
长非编码RNA (long non-coding RNA, lncRNA)是指长度超过200个核苷酸的RNA分子,与mRNA不同,lncRNA不具有编码蛋白质功能,但它们对细胞生物学过程的调控发挥重要作用[6]。研究表明,lncRNA通过调控染色质结构、基因表达和细胞周期发挥重要生物学功能[7-9],与肿瘤、神经系统疾病和心血管疾病的发生密切相关[10,11]。研究lncRNA参与疾病发生的作用机制,为探寻潜在的疾病治疗靶点提供新的视角[12-14]。
丙酮酸激酶(pyruvate kinase, PK)是糖酵解中的关键酶[15],其参与催化磷酸烯醇式丙酮酸转化为丙酮酸,同时产生三磷酸腺苷(ATP)为细胞供能[16,17]。哺乳动物中主要有肌型丙酮酸激酶和肝型丙酮酸激酶。肌型丙酮酸激酶(pyruvate kinase muscle,PKM)包括PKM1和PKM2两种亚型[18]。PKM1主要分布于对能量需求较大的肌肉组织中,而PKM2分布更为广泛,它在胚胎发育、肿瘤细胞和某些成年组织中都有表达[19,20]。鉴于PKM2对能量代谢和生长的调控作用具有多样性和复杂性,研究PKM2在细胞代谢的调节网络中的作用机制,将有助于加深对于疾病发生机制的认识[21,22]。
课题组前期研究证实,lncRNA RP11-879F14.2能够与PTBP1(polypyrimidine tract binding protein 1,PTBP1)相互作用来发挥抑制人心房肌成纤维细胞纤维化相关基因表达的作用[23],而RP11-879F14.2对心肌肥厚是否具有调控作用及其可能机制尚不清楚。本研究利用原代分离培养乳小鼠心室肌细胞(neonatal mouse ventricular cardiomyocytes, NMVCs)和乳大鼠心室肌细胞(neonatal rat ventricular cardiomyocytes, NRVCs),利用重组腺病毒载体介导表达RP11-879F14.2,探究RP11-879F14.2对心肌细胞肥大表型的调节作用及可能机制。
1 材料与方法
1.1 组织标本
利用HF患者和健康器官捐献者的心肌组织进行lncRNA表达谱分析和RP11-879F14.2表达的定量PCR检测。本研究经广东省人民医院伦理委员会批准(批准号No.GDREC2019238H(R1)),手术标本来源:广东省心血管病研究所,病例资料同以往报道。
1.2 实验动物
新生(1~3日龄)SPF级C57BL/6乳小鼠,新生(1~3日龄)SPF级Sprague dawley(SD)乳大鼠,雌雄不限,购自广东省医学实验动物中心,许可证号为SCXK(粤)2022-0002。
1.3 主要试剂
胎牛血清(fetal bovine serum,FBS)(ZETA LIFE);胰蛋白酶(0.25 % Trypsin-EDTA)和DMEM/F12细胞培养基(Gibco);去氧肾上腺素(phenylephrine,PE)(Sigma Aldrich);iFluorTM647标记鬼笔环肽(Yeasen);4×SDS 加样缓冲液(loading Buffer)(TaKaRa);预混型qPCR试剂盒(2×STBR Green Premix)和逆转录试剂预混液(Evo M-MLV RT Premix)(Accurate Biology);RIPA蛋白质裂解液(Beyotime);蛋白酶磷酸酶抑制剂混合物(碧云天);BCA蛋白质定量试剂盒(Thermo Fisher Scientific);线粒体压力测试试剂盒(Agilent);PVDF膜(Millipore);超敏ECL化学发光试剂盒(TINYA BIOTECH);逆转录试剂盒(Takara);Trizol裂解液和转染试剂Oligofectamine(Invitrogen);兔抗β-肌球蛋白重链(β-myosin heavy chain,β-MHC)抗体(abcam);兔抗骨骼肌肌动蛋白抗体α1(skeletal muscle actin alpha 1,ACTA1)抗体、鼠抗GAPDH抗体(Protein Technology);兔抗心房钠尿肽(atrial natriuretic peptide,ANP)抗体(Bioworld);PCR引物由广州睿博公司合成(Table 1)。
1.4 C57BL/6乳小鼠和SD乳大鼠心肌细胞的原代分离、培养和处理
取新生1~3日龄的SPF级C57BL/6乳小鼠或SD乳大鼠心脏置于高压灭菌后预冷的PBS溶液中,修剪心脏周围的血管组织及挤压心腔内残留的血液,转移至50 mL离心管,加入5 mL胰蛋白酶(0.25 % trypsin-EDTA)和7 mL预冷的PBS,4 ℃、70 r/min水平震荡消化过夜。次日,仍可见完整的心组织,加入10 % F12完全培养基终止消化后留取心组织,加入7 mL无血清F12和70 μL胶原酶II,37 ℃、70 r/min水平震荡10 min,用巴士管吹打直至组织完全消化,立即用完全培养基终止消化,用70 μm滤网过滤,300 ×g离心5 min,弃上清,用完全培养液重悬沉淀,转移至T75瓶中,置于37 ℃、5 % CO2细胞培养箱中培养1.5~2 h,进行差速贴壁,未贴壁的即为乳鼠心肌细胞,将分离的乳鼠心肌细胞悬液均匀铺于预先用鼠尾胶原I包裹的12孔板,待细胞稳定生长24 h,用PBS清洗细胞,更换新的完全培养液继续培养24 h后处理。

Table 1 The PCR primer sequences
1.5 RT-qPCR检测
使用Trizol法从人心肌组织或NMVCs样本中提取总RNA。取1 μg总RNA采用逆转录试剂预混液(Evo M-MLV RT Premix)逆转录得到cDNA,利用Vii7 Quantitative PCR System(Applied Biosystems)进行qPCR检测RP11-879F14.2以及MYH7、Acta1、PKM2和NPPA等基因表达水平。以Actb作为检测的内参对照基因。以2-ΔΔCt或2-ΔCt法计算检测基因的表达水平。所用引物序列见Table 1。
1.6 Western 印迹检测
细胞实验完成后去掉培养基,每孔细胞加500 μL高压灭菌后的PBS轻轻清洗2次,每次5 min,吸干PBS,加入适量提前配好的含有蛋白酶/磷酸酶抑制剂的RIPA裂解液,4 ℃静置10 min待细胞充分裂解,刮取细胞裂解液至1.5 mL EP管中,全程保持4 ℃。提前预冷离心机,刮取完成后置于离心机中并配平,离心条件:4 ℃,12 000 ×g,15~20 min,吸取上清,去除细胞沉淀。蛋白质定量10 μg(用DEPC水或者RIPA裂解液补齐),加入4×SDS-PAGE 加样缓冲液,金属浴或水浴锅中99 ℃蛋白质变性10 min,10 % SDS-PAGE凝胶电泳,转膜。根据检测的目标蛋白质大小裁下PVDF膜,利用对应的特异性抗体β-MHC(1∶1 000)、ACTA1(1∶2 000)、ANP(1∶1 000)、和GAPDH(1∶5 000),4 ℃孵育过夜,第 2 d用TBST溶液漂洗3次,每次5 min,常温孵育对应二抗1 h,TBST溶液漂洗3次,每次5 min。使用LAS 500 GE-化学发光成像仪。Image J (National Institutes of Health(NIH)开发)对图像进行灰度分析,采用目的蛋白质/内参的灰度值比值比较蛋白质的表达水平,GAPDH作为内参照。
1.7 鬼笔环肽染色
将分离的NRVCs悬液均匀铺于预先用鼠尾胶原I包裹的共聚焦皿,24 h后更换为无血清F12培养基同步化处理12 h,利用50 μmol/L PE 处理NRVCs 24 h,用RP11-879F14.2重组腺病毒感染处理24 h,弃去培养基,用PBS漂洗2次;加入500 μL 4 %多聚甲醛固定液,室温静置15~30 min,弃去多聚甲醛固定液,PBS漂洗2次,每次5 min;加入500 μL 0.1 % TritonX-100透化液,室温静置5 min,弃去透化液,PBS漂洗2次;每个共聚焦皿中加入500 μL新鲜配置的鬼笔环肽工作液(1 mL 1 % BSA溶液加入1 μL 1 000×iFluorTM647标记鬼笔环肽),室温避光染色60 min,PBS漂洗2次,每次5 min,滴入3滴DAPI封片剂,置于4 ℃避光保存,使用LSM 900 蔡司-激光共聚焦显微镜拍照。
1.8 Seahorse检测
Seahorse XF96能量代谢仪分析细胞能量代谢变化。将NMVCs接种于XF96孔细胞培养板稳定生长过夜,第2 d用重组腺病毒感染处理24 h,随后上机检测细胞外酸化速率(extracellular acidification rates, ECAR)。在ECAR检测过程中,在3次检测间隙依次加入10 mmol/L葡萄糖、1.0 μmol/L寡霉素和50 mmol/L 2-脱氧葡糖,加入寡霉素后的ECAR即为糖酵解能力。另外,检测NMVCs的细胞氧耗速率(oxygen consumption rates, OCR)。在OCAR检测过程中,在3次检测间隙依次加入1.5 μmol/L寡霉素、2.0 μmol/L 线粒体解偶联剂FCCP和0.5 μmol/L鱼藤酮/抗霉素A(Rot/AA)。加入FCCP后的OCAR达到最大耗氧量。
1.9 统计学分析
数据的统计分析在GraphPad软件上进行。两组间的数据比较用t检验的统计方法;多组间的数据比较用单因素方差分析的统计方法,组间的两两比较用Bonferroni校正的t检验。
2 结果
2.1 RP11-879F14.2在心衰患者心肌组织中表达上调
麦胚凝集素(wheat germ agglutinin,WGA)染色结果显示,与健康对照组相比,HF患者心肌的心肌细胞面积显著增大,大约增加2倍(P<0.01)(Fig.1A)。RT-qPCR结果显示,相较于健康器官捐献者,RP11-879F14.2在HF患者心肌组织中表达显著升高,大约升高5倍(P<0.001)(Fig.1B)。
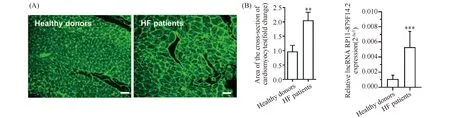
Fig.1 Up-regulation of RP11-879F14.2 in the myocardium of patients with heart failure (HF) (A) Representative images with WGA staining showed that the cross-sectional area of cardiomyocytes was increased in the myocardium of HF patients (WGA staining, scale bar=100 μm). (B) The expression of RP11-879F14.2 in the myocardium of healthy controls and heart failure patients was detected by RT-qPCR. Mean ± SD, n=3.**P<0.01 vs Vector group,***P<0.001
2.2 过表达RP11-879F14.2抑制乳小鼠心肌细胞肥大表型
为探究RP11-879F14.2对生理情况下心肌细胞肥大表型的影响,本文利用重组RP11-879F14.2腺病毒感染NMVCs。在倒置荧光显微镜下可见充分的共表达的绿色荧光蛋白(green fluorescence protein,GFP),显示重组RP11-879F14.2腺病毒可有效感染NMVCs,进一步的RT-qPCR结果证实,RP11-879F14.2在NMVCs中表达显著增加(Fig.2A),同时检测到肥大相关基因MYH7、Acta1和NPPA的表达显著降低(P<0.05,P<0.01)(Fig.2B)。Western 印迹结果显示,在过表达RP11-879F14.2的NMVCs中,心肌肥厚相关蛋白β-MHC、ACTA1以及ANP水平显著降低(P<0.01,P<0.001)(Fig.2C)。利用去氧肾上腺素(PE)诱导NRVCs造成细胞肥大模型,发现过表达RP11-879F14.2可逆转PE诱导NRVCs中心肌肥厚相关蛋白质表达(P<0.01,P<0.001)(Fig.2D),并抑制PE诱导的NRVCs表面积增加(P<0.01)(Fig.2E)。因此,以上结果显示,RP11-879F14.2具有抑制心肌细胞中肥大相关基因表达和心肌细胞面积增加的作用。
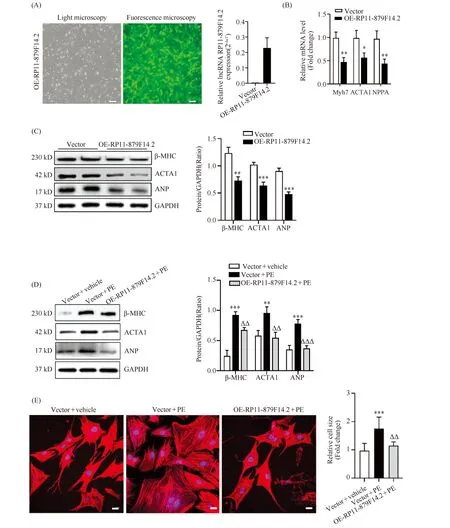
Fig.2 Overexpression of RP11-879F14.2 inhibits the hypertrophic phenotype in NMVCs and in PE-induced NRVCs (A) Adenovirus-mediated efficient over-expression of RP11-879F14.2 in NMVCs. The infection of recombinant RP11-879F14.2 adenovirus (rAD-RP11-879F14.2) was monitored by the co-expressed marker of GFP; scale bar=100 μm. (B) The mRNA expression of Myh7, ACTA1 and NPPA was detected by RT-qPCR. (C) The protein expression of β-MHC, ACTA1 and ANP in NMVCs was determined by Western blot. (D) The protein expression of β-MHC, ACTA1 and ANP was suppressed in PE-induced NRVCs upon overexpression of RP11-879F14.2. (E) Morphological observation of NRVCs by Phalloidin-iFluor 647 staining assay revealed that overexpression of RP11-879F14.2 attenuated PE-induced nRVC hypertrophy (scale bar=20 μm). Mean±SD, n=3.*P<0.05,**P<0.01,***P<0.001 vs Vector in B and C,**P<0.01,***P<0.001 vs Vector+vehicle in D and E,ΔΔP<0.01,ΔΔΔP<0.001 vs Vector+PE in D and E
2.3 丙酮酸激酶同工酶M2介导RP11-879F14.2抑制心肌细胞肥大相关基因的表达
为进一步探究RP11-879F14.2抑制心肌细胞肥大的具体机制,本文对健康器官捐献者和心衰患者心肌组织的RNA样本进行了转录组测序,RNA-seq结果显示,过表达RP11-879F14.2可引起NMVCs中显著的差异基因表达改变(Fig.3A)。进一步的RT-qPCR和Western 印迹结果证实,过表达RP11-879F14.2的NMVCs中 PKM2表达显著增加(P<0.01)(Fig.3B,3C)。在NMVCs中过表达PKM2和RP11-879F14.2可一致地抑制心肌肥厚相关蛋白β-MHC、ACTA1和ANP表达(P<0.05,P<0.01)(Fig.3D)。同时,利用PE诱导NRVCs造成细胞肥大模型,证实过表达RP11-879F14.2和PKM2可显著下调PE诱导的NRVCs中心肌肥厚相关基因表达(P<0.01,P<0.001)(Fig.3E),并能有效逆转PE诱导的NRVCs细胞面积增加(P<0.01)(Fig.3F)。
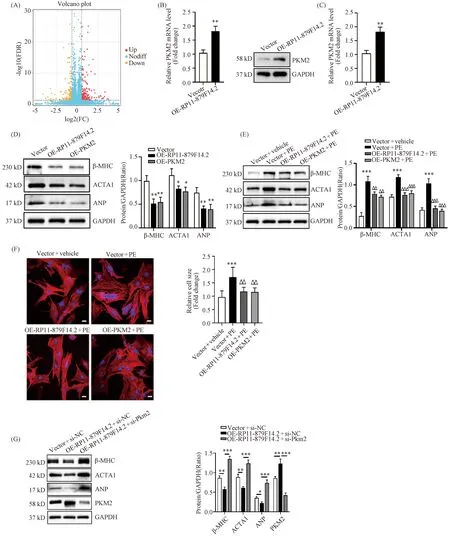
Fig.3 RP11-879F14.2 inhibits the hypertrophy-related genes via PKM2 (A) RNA-seq results reveals the differentially expressed genes. (B) PKM2 mRNA expression in NMVCs with over-expression of RP11-879F14.2 was detected by RT-qPCR with over-expression of RP11-879F14.2. (C) PKM2 protein expression in NMVCs with over-expression of RP11-879F14.2 was determined by Western blot. (D) The protein expression of β-MHC, ACTA1 and ANP in NMVCs was analyzed by Western blot. (E) The protein expression of β-MHC, ACTA1 and ANP was consistently inhibited in PE-induced NRVCs upon overexpression of RP11-879F14.2 and PKM2. (F) Morphological changes of NRVCs exposed to PE treatment were visualized by phalloidin-iFluor 647 staining. Overexpression of RP11-879F14.2 and PKM2 could markedly reverse PE-induced increase of cell size of NRVCs (scale bar=20 μm). (G) The protein expression of β-MHC, ACTA1, ANP and PKM2 in NMVCs was detected by Western blot assay. Mean ± SD, n=3.*P<0.05,**P<0.01,***P<0.001 vs Vector in B, C and D,ΔΔP<0.01,ΔΔΔP<0.001 vs Vector +PE in E and F
利用针对小鼠PKM2 mRNA的小干扰RNA(small interfering RNA, si-RNA)抑制NMVCs中PKM2表达。Western印迹结果显示,沉默NMVCs中PKM2表达可以显著逆转RP11-879F14.2抑制NMVCs中心肌肥厚相关蛋白质表达的作用(P<0.001)(Fig.3G)。因此,以上结果显示,RP11-879F14.2通过增加PKM2表达发挥抑制心肌细胞肥大的作用。
2.4 过表达RP11-879F14.2和丙酮酸激酶同工酶M2升高乳小鼠心肌细胞葡萄糖代谢能力
为明确RP11-879F14.2和PKM2对NMVCs中葡萄糖代谢的影响,本文利用Seahorse XF96细胞能量分析仪检测了过表达RP11-879F14.2和PKM2的NMVCs内ECAR和OCR水平。结果显示,过表达RP11-879F14.2与PKM2可一致增加了NMVCs的糖酵解(P<0.05,P<0.01)(Fig.4A,4B)和氧化磷酸化能力(P<0.05)(Fig.4C,4D)。RT-qPCR检测结果显示,沉默PKM2表达对于RP11-879F14.2上调NMVCs中糖酵解相关基因(Glut1、Hk2、Ldha)、三羧酸(TCA)循环相关基因(Idh2)和线粒体电子传递链(ETC)相关基因(NDUFS1、ND、MT-CO2、SDHB、CYC1)的表达有显著的抑制作用。因此,以上结果提示,PKM2通过增加心肌细胞的葡萄糖代谢能力来介导RP11-879F14.2发挥抑制心肌细胞肥大的作用。

Fig.4 Overexpression of RP11-879F14.2 and PKM2 elevates the glucose glycolysis and oxidative phosphorylation of NMVCs Measurement of glucose glycolysis activity in NMVCs with over-expression of RP11-879F14.2 (A) and PKM2 (B) by ECAR assay. Measurement of extracellular acidification rate in NMVCs with over-expression of RP11-879F14.2 (C) and PKM2 (D) by OCR assay. MRNA expression of glycolysis-related genes (E), the tricarboxylic acid (TCA) cycle-related genes (F) and mitochondrial electron transport chain (ETC)-related genes (G) in NMVCs by RT-qPCR assay. Mean ± SD, n=3.*P<0.05,**P<0.01,***P<0.001
3 讨论
心肌肥厚是心脏应对多种生理和病理刺激时的代偿性反应,以维持心血管的正常功能,而长期的病理性心肌肥厚不加以干预和治疗,将最终会导致心衰的发生[3-5]。本文发现RP11-879F14.2在HF患者心肌组织中表达升高,过表达RP11-879F14.2可以显著抑制NMVCs中心肌肥厚相关β-MHC、ACTA1和ANP表达,而过表达RP11-879F14.2也可以显著抑制PE诱导NRVCs中心肌肥厚相关基因表达和细胞面积增加,因此,HF心肌中高表达的RP11-879F14.2具有抑制心肌细胞肥大的作用。进一步通过RNA-seq筛选、RT-qPCR检测证实RP11-879F14.2可特异地增加NMVCs中PKM2表达;功能实验结果显示PKM2介导RP11-879F14.2发挥抑制心肌细胞肥大相关基因表达的作用。
丙酮酸激酶作为糖酵解通路中的一个关键酶,在调节细胞能量代谢中发挥着关键作用[24]。PKM1和PKM2是PKM的2种RNA可变剪切亚型,PKM1和PKM2都有共同的外显子1~8、11~12,只有外显子9和10导致最终转录本的差异(PKM2不含外显子9)[25]。本文发现RP11-879F14.2可特异地增加PKM2剪切体水平,但具体机制尚有待于进一步研究阐明。PKM2是一种重要的糖酵解酶,同时也具有非糖酵解功能[26]。PKM2在心肌重构和心肌功能调节中发挥重要作用,但现有的相关报道存在不一致性[24, 27],而本文结果证实PKM2具有抑制心肌细胞肥大的作用。研究表明,心肌肥厚会伴随发生心肌代谢重塑,其特征是脂肪酸氧化减少,葡萄糖摄取和糖酵解增加[28,29]。本文检测了RP11-879F14.2和PKM2对NMVCs的葡萄糖代谢相关ECAR和OCR的影响,发现过表达RP11-879F14.2与PKM2可一致增加NMVCs的糖酵解和氧化磷酸化水平。定量PCR检测结果显示,沉默PKM2表达对于RP11-879F14.2上调NMVCs中糖酵解相关基因、TCA循环相关基因和线粒体电子传递链相关基因表达有显著的抑制作用。因此,本文揭示PKM2除了自身的促糖酵解作用,也可增加NMVCs的氧化磷酸化,相关深入的分子调节机制,还有待于进一步的研究证实。
综上,本文证实RP11-879F14.2通过上调PKM2发挥抑制心肌细胞肥大的作用。后续我们将建立心肌特异表达RP11-879F14.2的转基因小鼠,继续在细胞和整体水平探究RP11-879F14.2通过PKM2抑制心肌肥厚的分子机制,并在整体动物水平明确过表达RP11-879F14.2对小鼠心肌肥厚和心脏结构、功能的影响,为开展基于RP11-879F14.2的心肌肥厚治疗研究提供科学依据和资料。