PSME2和STAT3双重抑制通过合成致死效应诱导食管鳞癌细胞死亡
2024-04-23刘永萱康永安吴晓爽程月月程浩东刘其伟高社干齐义军
孙 魁, 陈 攀, 刘永萱, 康永安, 吴晓爽, 程月月, 程浩东,刘其伟, 高社干, 齐义军*
(1)河南科技大学临床医学院,河南科技大学第一附属医院,肿瘤医院,省部共建食管癌防治国家重点实验室,河南省微生态与食管癌防治重点实验室,河南省肿瘤表观遗传重点实验室,河南, 洛阳 471003;2)许昌学院医学院细胞行为学重点实验室,河南, 许昌 461000)
蛋白酶体(proteasome)是具有蛋白质水解酶活性的26S多亚基大分子复合物,包含1个20S核心颗粒和2个19S调节颗粒,其普遍存在于生物体内,且可通过选择性降解多聚泛素化修饰的蛋白质分子,维持蛋白质稳态[1]。除了19S调节颗粒外,PA28(包含PA28α、PA28β、PA28γ等3种亚型)、PA200等复合物均能调节蛋白酶体活性[2]。蛋白酶体功能紊乱引起泛素化蛋白质的异常积聚,不仅影响细胞正常功能,还与多种疾病的发生发展密切相关[3,8]。除了蛋白酶体系统,自噬-溶酶体系统是真核生物中另一种蛋白质降解途径。正常生理条件下,蛋白酶体系统主要降解K48连接的多聚泛素化蛋白质底物,而自噬-溶酶体系统降解的蛋白质底物主要由K63多聚泛素链标记[4]。尽管如此,蛋白酶体系统和自噬-溶酶体系统并非完全独立、互不影响的蛋白质降解系统,而是相互补充或协同作用,共同维持细胞内蛋白质稳态[22]。研究表明,Bortezomib(蛋白酶体抑制剂)和Tubacin(HDAC6自噬抑制剂)联合作用于多发性骨髓瘤细胞,细胞内泛素化蛋白质明显升高,胱天蛋白酶8(caspase-8)和PARP(poly ADP-ribose polymerase)剪切体也同时升高,细胞凋亡增加[6]。因此,同时抑制蛋白酶体和自噬-溶酶体的功能,消除二者的互补代偿作用,能够诱导联合致死作用[6]。
PSME2(proteasome activator complex subunit 2,编码PA28β蛋白)表达异常见于多种肿瘤,高表达的PSME2与HIF-1、TNF、IL-17、NF-κB等多个信号通路异常激活相关,并引起细胞因子-细胞因子受体相互作用增强[17]。本文发现,PSME2在食管鳞癌(esophageal squamous cell carcinoma, ESCC)中表达上调,提示蛋白酶体介导的蛋白质降解功能增强参与了ESCC进展。因此,本研究进一步分析了PSME2沉默后ESCC细胞增殖、迁移和自噬活性变化,发现了激活自噬的关键分子STAT3,探讨了PSME2和STAT3双重抑制的联合致死作用。
1 材料与方法
1.1 细胞与试剂
ESCC细胞系KYSE30和NE6-T细胞保存于河南科技大学第一附属医院肿瘤表观遗传重点实验室。RPMI 1640培养基(SH30027.01)购自Hyclone公司;胎牛血清(FBS, SA210407)购自Pricell公司;HiScript®II 1st Strand cDNA Synthesis Kit (R211-02)、AceQ qPCR SYBR Green Master Mix (Q111-02)购自南京诺唯赞生物科技有限公司;TRIzol(15596026)购于Invitrogen公司;CCK-8试剂盒购于Invigentech(IV08-1000)公司;GAPDH和PSME2引物由上海生工生物工程股份有限公司合成;转染试剂及相关siRNA购于上海吉玛制药技术有限公司;PSME2 (2409S)、LC3 (2741S)、p62 (88588S)、STAT3 (9139S)、p-STAT3 (9145S)、GAPDH (5174S)等抗体均购于CST公司;BCA蛋白质定量试剂盒(CW0014)购于康为世纪生物科技股份有限公司;WP1066 (HY-15312)和LMT28 (HY-102084)购于MCE公司;ECL曝光液(SQ101)购于上海雅酶生物医药科技有限公司;LDH细胞毒性检测试剂盒(CYTODET-RO)购于MERCK公司;EdU (C0071S)、Calcein/PI (C2015M)细胞活性与细胞毒性检测试剂盒购于上海碧云天生物技术有限公司。
1.2 公共数据库和组织样本
ESCC转录物组数据和临床信息来源后TCGA(the Cancer Genome Atlas, htttp://portal.gdc.cancer.gov)和GEO(Gene Expression Omnibus, htttp://www.ncbi.nlm.nih.gov/geo)公共数据库,分别有92例、179例ESCC。8对ESCC与匹配癌旁组织样本来自河南科技大学第一附属医院手术切除未接受放化疗的ESCC患者,且术后病理诊断证实为ESCC。本项目已获得河南科技大学第一附属医院医学伦理委员会的批准。
1.3 细胞培养、转染
ESCC细胞(KYSE30和NE6-T)培养于37 ℃、5% CO2恒温培养箱,取对数生长期细胞用于实验。本文应用siRNA阴性对照(siControl,siNC)与siPSME2转染细胞后进行相应细胞学实验。siRNA不同靶点序列见Table 1。具体分组:siNC(阴性对照组),siPSME2(沉默PSME2组),WP1066(STAT3信号通路抑制组),siPSME2+WP1066(沉默PSME2联合WP1066组),LMT28(IL-6抑制组),siPSME2+LMT28(沉默PSME2联合LMT28组)。

Table 1 List of the sequences for siRNA targets
1.4 细胞活性和细胞增殖检测
CCK8实验:将ESCC细胞以3 000细胞/孔接种于96孔板中,经不同处理后在不同时间点加入10 μL/孔的CCK8试剂,37 ℃下避光孵育2 h,测量并记录A450处吸光度。
EdU细胞增殖实验:将ESCC细胞以5 000/孔接种于共聚焦皿中,经不同处理后用10 μmol/L EdU标记所培养的细胞2~4 h,4%甲醛固定细胞1 h用PBS冲洗3次,加入200 μL Click反应混合液避光孵育30 min,使用PBS冲洗,最后加入DAPI对细胞核进行染色定位,共聚焦显微镜拍照,Image J软件进行定量分析。
1.5 RNA提取与RT-PCR
本文采取TRIzol法提取细胞与组织样本RNA,按照HiScript II 1st Strand cDNA Synthesis Kit应用说明进行反转录,AceQ qPCR SYBR Green Master Mix进行PCR,以GAPDH mRNA为内参进行标准化,采用2-ΔΔCt方法计算PSME2 mRNA相对表达量。引物序列见Table 2。

Table 2 List of primer sequences
1.6 平板克隆实验
将不同处理组细胞以1 000个/孔接种于6孔板中,于37℃、5% CO2条件下持续培养10~14 d,弃去培养基,PBS洗涤3次,4%甲醛室温固定1 h,结晶紫染液染色30 min后PBS洗去多余染料,晾干后进行拍照。
1.7 Transwell侵袭与迁移实验
制备106/mL的细胞悬液,水化Matrigel胶包被Transwell小室用于细胞侵袭实验,上室加入无血清细胞悬液100 μL,下室加入300 μL含10%FBS1640培养基,于37℃、5% CO2条件下持续培养36~48 h,4%甲醛室温固定1 h,结晶紫染液染色30 min,PBS洗去多余染料,棉签擦除内层细胞后拍照,Image J定量分析。
1.8 蛋白质提取与Western 印迹分析
细胞或组织中加入RIPA裂解缓冲液提取相关蛋白质,BCA法测定蛋白质浓度。SDS-PAGE法进行蛋白质电泳和转膜,5%脱脂奶粉封闭2 h,分别孵育一抗(1∶1 000-1∶2 500)和相应二抗(1∶5 000),以GPADH(1∶2 500)对目的蛋白质表达量进行标准化,ECL显示目的蛋白质条带。
1.9 细胞上清IL-6检测
采用Human IL-6 ELISA检测试剂盒检测不同处理组细胞分泌上清中IL-6。样本孔加入不同处理组细胞培养上清和检测抗体,室温孵育2 h,洗涤后加入稀释的辣根过氧化物酶标记的链霉亲和素,室温孵育45 min,洗涤后加入底物显色,适时加入终止液,A450测吸光度值。
1.10 乳酸脱氢酶细胞毒性检测
采用细胞毒性检测试剂盒检测不同处理组细胞LDH(lactate dehydrogenase)含量。将细胞接种于96孔板中,接受不同处理后加入100 μL的反应混合物,37 ℃下避光孵育1 h,测量A490吸光度。
1.11 活细胞/死细胞检测
采用Beyotime Calcein/PI细胞活性与细胞毒性检测试剂盒进行检测。将细胞接种于96孔板中,经Calcein和PI对不同组细胞进行染色30 min,共聚焦微镜拍照,Image J软件进行荧光数据半定量分析。
1.12 RFP-GFP-LC3标记细胞自噬流检测
表达RFP-GFP-LC3双荧光KYSE30细胞和NE6-T细胞置于共聚焦皿中,经不同处理后加入4%甲醛室温固定1 h,PBS洗涤3次后加入DAPI染色细胞核进行定位,共聚焦显微镜拍照。
1.13 GSEA富集分析
GEO53625 ESCC数据库中PSME2高、低表达组差异表达基因进行GSEA(Gene Set Enrichment Analysis, http://www.gsea-msigdb.org/gsea/index.jsp)分析,鉴定差异表达基因富集的生物学功能,c2.cp.v7.2.symbols.gmt (Curated)为参考基因集,FDR (q-value) <0.25和P<0.05具有统计学差异。
1.14 统计学处理
用SPSS26.0和Graphpad Prism软件进行数据统计分析。实验数据以均数±标准差表示,Western 印迹、免疫荧光、PCR等结果差异分析采用t检验或单因素方差分析,Kaplan-Meier绘制生存曲线,log-rank检验确定不同组别生存曲线差异,检验水准α= 0.05。
2 结果
2.1 食管鳞癌中蛋白酶体激活物复合物亚基 2上调与预后不良相关
为确定蛋白酶体功能在ESCC中的作用,本文分析了TCGA(TCGA-ESCC)和GEO数据库(GSE53625)的ESCC样本中蛋白酶体活性调节分子的表达特征。在GSE53625数据库中,PSME2、PSME3、PSME4在肿瘤组织表达量明显高于癌旁组织(Fig.1A),并且PSME2和PSME4高表达ESCC患者预后较差(HR = 1.89, 95% CI, 1.28-2.79,P<0.05; HR = 1.75, 95% CI, 1.19-2.59,P<0.05),而在TCGA-ESCC数据库中,PSME1和PSME2高表达组仅具有预后不良趋势(HR = 1.88, 95% CI, 0.92-3.87,P= 0.0804; HR = 2.02, 95% CI, 0.98-4.17,P= 0.0524, Fig.1B)。因此,本研究进一步用Western 印迹检测了8例ESCC和癌旁组织中PSME2蛋白表达,同时应用Imag J以PSME2/GAPDH灰度比值进行半定量分析,发现其中4对ESCC中PSME2蛋白表达明显高于癌旁组织(Fig.1C)。上述结果提示,PSME2可能参与ESCC恶性演进过程。
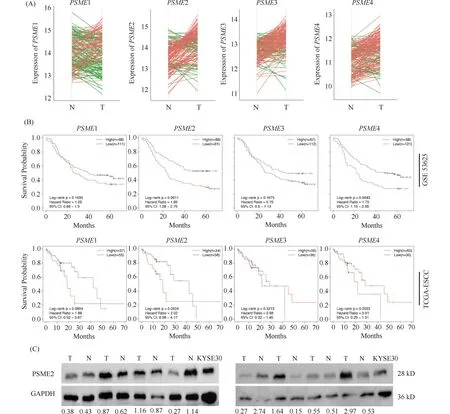
Fig.1 PSME2 upregulation is correlated with poor prognosis in esophageal squamous cell carcinoma (A) PSME1-4 mRNA expression in cancer and adjacent non-tumor tissues from the GSE53625 database. (B) Kaplan-Meier survival curves show the overall survival in high- and low- PSME1-4 group of patients with ESCC in GEO53625 and TCGA-ESCC datasets, respectively. (C) Western Blot shows PSME2 protein in 8 pairs of ESCC and matched adjacent non-tumor tissue samples, with KYSE30 as a control. N, Adjacent non-tumor, T, Tumor. Quantitative analysis shows PSME2/GAPDH gray values
2.2 蛋白酶体激活物复合物亚基 2沉默抑制食管鳞癌细胞增殖、迁移和侵袭
本文应用PSME2 siRNA转染KYSE30细胞与NE6-T细胞,RT-PCR和Western 印迹结果表明,与siControl(siNC)转染细胞相比,PSME2 siRNA转染细胞的PSME2 mRNA和蛋白质分子明显降低(Fig.2A,2B)。CCK8、EdU和平板克隆结果表明,沉默PSME2表达后,KYSE30细胞与NE6-T细胞的增殖能力也明显降低,其中EdU实验显示,与siNC相比,PSME2 si#1和PSME2 si#3沉默后,KYSE30增殖率由36.6%分别下降至17.8%和20.1%,NE6-T由44.3%下降为22.3%和22.0%(Fig.2C-2E)。此外,Transwell实验结果表明,PSME2沉默也显著降低了KYSE30细胞与NE6-T细胞的迁移和侵袭能力(Fig.2F,2G)。与siNC相比,PSME2 si#1和PSME2 si#3处理的KYSE30迁移和侵袭能力分别下降为59.2%、72.6%和60.2%、76.2%;NE6-T中上述下降比例为44.1%、66.7%和41.3%、42.9%。上述结果表明,PSME2促进了ESCC生长和转移。

Fig.2 Silencing of PSME2 inhibits proliferation, migration, and invasion of ESCC cells (A) RT-PCR shows PSME2 mRNA expression in NE6-T and KYSE30 cells transfected with siNC or siPMSE2. (B) Western blot shows PSME2 protein expression in NE6-T and KYSE30 cells transfected with siNC or siPMSE2. (C) CCK8 assay shows the cell viability of different groups. (D) Immunofluorescent images and quantitative analysis of EdU assay (Scale bars, 50 μm). (E) Images and quantitative analysis of clone formation assay. (F &G) Representative images of cells showed the effects of PSME2 silencing by Transwell migration and invasion assays , respectively. The quantitative data are presented as means ± SD (n=3).***P <0.001,**P <0.01,*P < 0.05
2.3 蛋白酶体激活物复合物亚基 2沉默增强食管鳞癌细胞自噬发生
鉴于PSME2沉默抑制了蛋白酶体对蛋白质的激活与降解,本文进一步检测了PSME2沉默后自噬的变化,Western 印迹结果表明,LC3-II/LC3-I表达明显升高,而p62蛋白表达则降低(Fig.3A)。应用RFP-GFP-LC3标记的KYSE30细胞与NE6-T细胞检测自噬流变化,与siControl转染ESCC细胞相比,PSME2沉默组ESCC细胞中红色斑点和绿色斑点均明显升高,叠加后黄色斑点也明显增加(Fig.3B &3C)。上述结果表明,PSME2沉默抑制了蛋白酶体功能,进而代偿性激活了自噬。
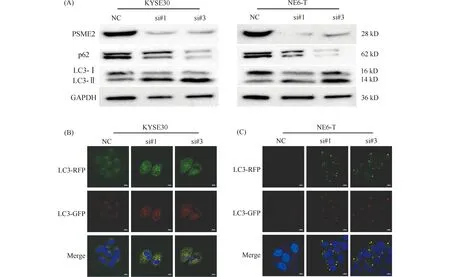
Fig.3 Silencing of PSME2 enhances autophagy in esophageal squamous cell carcinoma (A) Western blot shows the protein levels of PSME2, p62, LC3, and GAPDH. (B &C) The measurement of autophagic flux and autophagosome under the fluorescent microscopy, with yellow fluorescence indicating early autophagosomes, and red fluorescence indicating late autolysosomes. (Scale bars, 10 μm)
2.4 食管鳞癌中蛋白酶体激活物复合物亚基 2沉默激活IL-6/STAT3通路介导的自噬发生
对GSE53625中PSME2高表达和低表达的ESCC差异表达基因进行GSEA富集分析表明,IL-6/STAT3、TGF β等信号通路在PSME2低表达组显著富集,提示沉默PSME2与IL-6/STAT3信号通路激活相关(Fig.4A)。应用Western 印记检测PSME2沉默后(siPSME2#1)STAT3活性变化,发现PSME2表达沉默后,STAT3蛋白磷酸化明显增加(Fig.4B)。此外,ELISA结果表明,PSME2沉默组对比siNC组KYSE30和NE6-T细胞上清中IL-6含量分别增加1.35、1.13倍和1.24、1.19倍(Fig.4C)。上述结果表明,PSME2沉默激活了IL-6/STAT3信号通路。
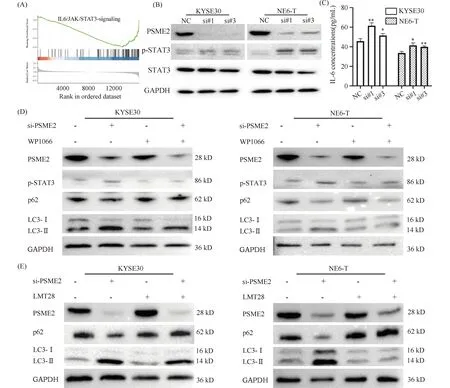
Fig.4 Silencing of PSME2 activates IL-6/STAT3 pathway-mediated autophagy in esophageal squamous cell carcinoma (A) GSEA analysis shows the enriched pathways of IL-6/STAT3 in PSME2-low subgroup. (B) Western blot shows the protein levels of PSME2, p-STAT3, STAT3, and GAPDH. (C) IL-6 levels were analyzed by ELISA assay. (D) Western blot shows the protein levels of p62, LC3I/II,PSME2, and p-STAT3. (E) Western blot shows the protein levels of PSME2, p62, and LC3-I/LC3-II. Quantitative data are presented as means ± SD (n=3).**P <0.01,*P <0.05
为进一步探讨IL-6/STAT3信号通路与自噬的相关性,分别应用LMT28抑制IL-6活性或WP1066抑制STAT3活性,检测LC3和p62蛋白质表达变化。Western 印迹结果表明,与仅PSME2沉默的ESCC细胞相比,PSME2沉默联用LMT28或WP1066,LC3-II/LC3-I表达明显降低,而p62蛋白表达升高,同时伴随p-STAT3表达显著降低(Fig.4D,4E)。上述结果表明,ESCC中PSME2沉默通过激活IL-6/STAT3信号通路增强自噬。
2.5 联合蛋白酶体激活物复合物亚基 2沉默和STAT3抑制诱导食管鳞癌细胞合成致死
KYSE30细胞和NE6-T细胞中沉默PSME2表达,同时应用WP1066抑制自噬,发现联合PSME2沉默和WP1066处理的细胞,细胞培养上清中LDH含量分别为siNC组3.84和2.27倍,但WP1066单独处理组细胞上清中LDH变化不明显,表明代偿性自噬激活增加PSME2沉默的ESCC细胞存活能力(Fig.5A,5B)。应用Calcein/PI染色不同处理组ESCC细胞,发现PSME2沉默和WP1066联合处理,KYSE30和NE6-T红色死亡细胞比例分别为36.69%和32.55%,其中KYSE30细胞中PSME2沉默和WP1066单独处理组死亡细胞分别比例为6.78%和18.34%、NE6-T细胞中则为6.74%和9.70%(Fig.5C)。上述结果表明,PSME2和STAT3双重抑制诱导了ESCC细胞的合成致死。
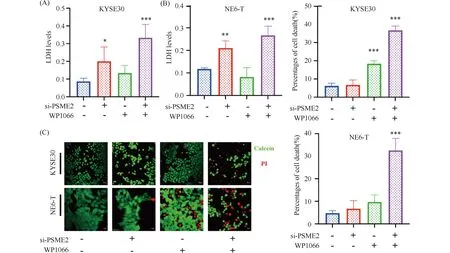
Fig.5 Combination of PSME2 knockdown and STAT3 inhibition induces synergistic cell death in esophageal squamous cell carcinoma (A &B) LDH levels in ESCC cells with different treatments (A: KYSE30; B: NE6-T). (C) Fluorescent images and quantitative data of Calcein-AM/PI staining in different groups (green for live cells, red for dead cells; Scale bars: 10 μm). Quantitative data are presented as means±SD (n=3).***P <0.001 ,**P <0.01 ,*P < 0.05
3 讨论
食管癌发病率和死亡率分别位居全球所有恶性肿瘤的第七位和第六位[9]。2020年全球约有54.4万例食管癌死亡患者,其中约50%死亡患者来源于东亚和中亚,尤其是中国[7]。食管癌主要的组织学类型分为ESCC和食管腺癌(esophageal adenocarcinoma, EAC),中国90%以上的食管癌属于ESCC[9]。目前,手术、放疗、放化疗、免疫治疗等多学科的综合治疗为食管癌的标准治疗方案,但仍有较高的复发率[10],其5年总体生存率<25%[11]。肺癌、乳腺癌、结肠癌等多种肿瘤的分子分型推动了分子靶向药物的开发和个体化精准治疗,提高了肿瘤治疗效果[12]。然而,ESCC仍缺乏特异的分子标志物和治疗的分子靶点,严重制约着ESCC临床治疗疗效和预后的改善。
蛋白酶体功能异常与多种疾病的发生、发展密切相关,例如神经退行性疾病、心血管疾病、糖尿病和恶性肿瘤等[13]。具有调节蛋白酶体活性的PA28β蛋白由PSME2基因编码,表达于肝、肺、结肠、脾等器官实质细胞的胞质中,与PA28α形成异源七聚体,参与MHC I 类抗原提呈[5,14]。PSME2表达上调见于多种肿瘤,如胃癌、透明细胞肾癌、黑色素瘤、伯基特淋巴瘤和乳腺癌等[15-20],但在ESCC中PA28β蛋白表达降低[21],与本研究的结果不一致,具体的原因及机制目前尚不清楚,需进一步的研究阐明。相对于正常细胞,肿瘤细胞分裂和增殖加快,生物合成增加,代谢活性增高,因此,对蛋白酶体的干预更敏感[14]。硼替佐米(Bortezomib)是FDA批准上市用于治疗多发性骨髓瘤的蛋白酶体抑制剂,能够通过降低ICAM-1(intercellular cell adhesion molecule-1)、VCAM-1(vascular cell adhesion molecule-1)等黏附分子表达,抑制骨髓瘤细胞与骨髓间质细胞黏附与连接,并激活JNK和胱天蛋白酶,诱导原代骨髓瘤细胞和多种骨髓瘤细胞凋亡[6,23]。本文应用GSE53625和TCGA公共数据库中的ESCC数据,发现ESCC中PSME2 mRNA表达上调,并与ESCC预后不良呈正相关;Western 印迹结果也表明,ESCC样本中PSME2蛋白表达升高,提示蛋白酶体活性增加是ESCC细胞增殖的前提条件,PSME2可能是ESCC临床治疗的潜在靶点分子。
为维持细胞内稳态,蛋白酶体功能干扰能够诱导自噬活性增加,抵抗蛋白酶体抑制所引起的细胞死亡[6,17]。肾癌细胞系786-O细胞和CAKI-1细胞转染siPSME2能够降低转染细胞的侵袭能力,但786-O细胞和CAKI-1细胞的增殖活性并无明显变化,同时LC3-II/LC3-I蛋白质表达增加、p62蛋白表达减少,表明PSME2敲降激活了自噬,以代偿蛋白酶体功能受阻时蛋白质降解途径[17]。蛋白酶体抑制剂硼替佐米处理多发骨髓瘤细胞系,能够抑制ERK和STAT3磷酸化,并诱导IL-6效应分子gp130(glycoprotein 130)表达下调;5 nmol/L和10 nmol/L硼替佐米分别诱导了26%和66%的RPMI8226细胞凋亡,与5 nmol/L Tubacin联合应用时,RPMI8226细胞的凋亡率分别增加至87%和91%,联合指数CI为0.37,表明硼替佐米和Tubacin 2种药物的强联合作用[6]。
本研究表明,沉默PSME2降低了ESCC细胞增殖、迁移和侵袭能力,但同时激活的IL-6/STAT3信号通路诱导了代偿性自噬活性增强;应用WP1066抑制STAT3活性,不仅可以阻断PSME2沉默伴随的自噬,还能明显增加ESCC细胞凋亡,表明PSME2和STAT3双重抑制对ESCC细胞具有联合致死性作用。
综上所述,本研究表明,PSME2促进了ESCC进展,是ESCC预后不良的分子标志物;沉默PSME2激活的IL-6/STAT3信号通路诱导了代偿性自噬活性增强,PMSE2和STAT3双重抑制对ESCC细胞具有联合致死性作用,有望为ESCC临床治疗的提供新策略。
