基于ERIC-PCR技术分析黄连解毒汤对2型糖尿病大鼠肠道菌群结构及DNA同源性的影响*
2024-04-23陈吕张庚鑫韩雪唐秋梅苏钢杨光勇陈瑞何光志
陈吕,张庚鑫,韩雪,2,唐秋梅,苏钢,杨光勇,陈瑞,何光志
1.贵州中医药大学,贵州 贵阳 550025; 2.德江县人民医院,贵州 德江 565200
我国糖尿病的发病率逐年增高,2型糖尿病(diabetes mellitus type 2,T2DM)是其中的主要类型[1]。糖尿病会引发多器官病变,如糖尿病视网膜病变、糖尿病肾病、糖尿病神经病变等。T2DM患者还常伴有心血管疾病的重要危险因素,如高血压、血脂紊乱等[2]。不良的生活习惯(如吸烟)也会增加糖尿病并发大血管病变的风险。T2DM是一种终身性疾病,以胰岛素缺乏、胰岛素抵抗、高血糖等为特征,对人体健康的危害极大。中医药可通过调节肠道菌群改善2型糖尿病T2DM,在肠道菌群的作用下,中医药被分解为具有生物活性的多酚、生物碱、皂苷等成分。这些成分能够维持肠道菌群的生态平衡,调节肠道菌群组成,并改善肠道菌群失调[3]。
黄连解毒汤出自《肘后备急方》,是清热解毒的代表方剂,主要用于治疗胃肠实热证,其组成成分包括黄芩、黄连、黄柏、栀子。研究发现,黄连解毒汤能通过多种途径调节肠道菌群结构,如短链脂肪酸代谢途径、胆汁酸代谢途径、支链氨基酸代谢途径、脂多糖分泌途径以及功能蛋白质分泌途径等,最终减弱胰岛素抵抗,预防并延缓糖尿病的发生与发展。其作用机制可能与增强肠黏膜完整性、减少有害菌群进入血液循环、降低炎症水平及改善糖脂代谢等相关[4-5]。
为了探讨不同剂量黄连解毒汤对肠道菌群调节的差异性,本研究建立T2DM大鼠模型,采用基于细菌基因间重复序列的ERIC-PCR技术分析黄连解毒汤对肠道菌群多样性的影响,为该方剂的进一步开发与利用提供基础依据。
1 材料
1.1 动物SPF级SD大鼠36只,雌雄各半,体质量180~220 g,购自重庆腾鑫华阜实验动物销售有限公司,许可证号:SCXK(京)2019-0008。动物饲养于贵州中医药大学实验动物中心,温度25 ℃,相对湿度50%,昼夜明暗交替12 h/12 h,自由进食和饮水。动物实验经贵州中医药大学动物实验伦理委员会审核批准,伦理审批号:SYXK(黔)2021-0005。
1.2 药物与试剂黄连、黄芩、黄柏、栀子(北京同仁堂贵阳药店,批号:200301、200701、200602、200702);盐酸二甲双胍片(中美上海施贵宝制药有限公司,批号:国药准字H20023370);链脲佐菌素、粪便DNA提取试剂盒(北京索莱宝生物科技有限公司,批号:S8050、20220704);Green Taq Mix(诺唯赞生物,批号:B2242DAA);50× TAE缓冲液、无酶无菌水(北京索莱宝生物科技有限公司,批号:20220415、20211118);G-Red核酸染料(北京百泰克生物技术有限公司,批号:756773AH);BM2000 DNA Marker(博迈德生物,批号:766583AH)。
1.3 仪器TC-96/G/H(b)型基因扩增仪(杭州博日科技有限公司);紫外分析仪(美国SPECTRONICS公司,型号:CM-10A);恒温水浴锅(科忻仪器,型号:XMTD203);电热恒温鼓风干燥箱(上海跃进医疗器械厂,型号:101-2-S);涡旋仪(IKA VORTEX,型号:GENIUS3);低速离心机(SCIKOGEX,型号:S1010E);电子天平(METTLER TOLEDO,型号:EL104);高速冷冻离心机、核酸蛋白分析仪(Thermo Fisher Scientific,型号:LEGEND MICRO 21R、6VDC-18W);电泳仪(北京市六一仪器厂,型号:DYCP-31DN);垂直流洁净工作台(青岛海尔生物医疗股份有限公司,型号:HCB-1300V);血糖仪(三诺生物传感股份有限公司,型号:2J01B210415)。
2 方法
2.1 药物制备黄连解毒汤:取黄连54 g,黄芩 36 g,黄柏36 g,栀子54 g,加10倍量的超纯水浸泡1 h,加热煮沸后,武火煎煮40 min,倒出药液;药渣加4倍量的超纯水,武火煎煮30 min,倒出药液;将两次所得药液合并,分别浓缩至质量浓度为0.63 g·mL-1、0.31 g·mL-1、0.16 g·mL-1的药液,冷却后分装,4 ℃冰箱保存备用。二甲双胍溶液:将二甲双胍片研磨成粉后,用生理盐水配制质量浓度为10 g·L-1的溶液,现配现用。
2.2 分组、造模及给药适应性喂养7 d后,将36只大鼠随机分为对照组6只、造模组30只,对照组给予普通饲料,造模组给予高脂饲料(10.0%猪油、15.0%蔗糖、10.0%蛋黄粉、2.5%胆固醇、0.5%胆酸盐、62.0%基础饲料)。喂养6周后,造模组大鼠腹腔注射1%链脲佐菌素(30 mg·kg-1),24 h后尾尖点刺采血并测血糖,48 h后再次尾尖点刺采血测血糖,若2次血糖浓度均>16.7 mmol·L-1表示糖尿病模型复制成功[6]。将造模成功的大鼠随机分为模型组、黄连解毒汤高剂量组(6.25 g·kg-1)、黄连解毒汤中剂量组(3.13 g·kg-1)、黄连解毒汤低剂量组(1.56 g·kg-1)[7]及二甲双胍组(100 mg·kg-1),每组各6只。各药物组按照相应剂量灌胃给药,对照组和模型组灌胃等体积生理盐水,连续21 d。
2.3 大鼠肠道菌群DNA提取灌胃第7天、第14天、第21天,收集大鼠粪便于1.5 mL EP管中,放入-80 ℃冰箱保存。采用粪便基因组DNA提取试剂盒,按照说明书进行操作,提取大鼠粪便样本细菌总DNA;通过核酸蛋白分析仪检测DNA浓度与纯度,经检测,OD260/OD280比值为1.6~1.9,说明提取的DNA纯度较高;将DNA样本保存在-80 ℃冰箱备用。
2.4 ERIC-PCR检测肠道菌群DNA结构参照文献[8-9]设计引物,委托上海生工生物工程股份有限公司合成,引物序列为:ERIC-1- F 5′-ATGTAAGCTCCTGGGGATTCAC-3′,ERIC-2-R 5′-AAGTAAGTGACTGGGGTGAGCG-3′。根据引物说明书,将其稀释成工作液,分装备用,避免污染。在PCR试剂盒说明书的基础上,建立适用于本实验且PCR电泳后具有较多条带的ERIC-PCR反应体系和反应程序。反应体系:DNA模板2 μL,上下游引物各0.5 μL,Green Taq Mix 12.5 μL,ddH2O 9.5 μL,总体积25 μL。反应程序:95 ℃预变性 5 min;95 ℃变性30 s,55 ℃退火1 min,72 ℃延伸90 s,共35个循环;65 ℃再延伸16 min。
2.5 Sanger测序检测肠道菌群DNA同源性根据电泳图选择相应组分的PCR试剂,采用Sanger法进行测序,由上海生工生物工程股份有限公司完成。具体方法为:首先,采用SK1201-UNIQ-10柱式细菌基因组DNA抽提试剂盒提取细菌基因组;然后,采用毛细血管电泳技术进行电泳,并基于电泳结果切割所需的DNA目的条带进行琼脂糖纯化;最后,采用3730XL型基因分析仪进行DNA测序。将DNA测序结果用Blast软件进行对比分析。
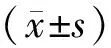
3 结果
3.1 各组大鼠造模后血糖浓度比较药物干预前,与对照组比较,造模组大鼠血糖浓度升高(P<0.05),且>16.7 mmol·L-1[6],提示糖尿病模型复制成功,见表1。

表1 各组大鼠造模后 血糖浓度比较
3.2 各组大鼠不同时间肠道菌群结构比较灌胃第7天,对照组条带亮度适中且较多集中在100~750 bp,表明肠道微生物处于相对平衡的状态;与对照组比较,模型组条带在1 000~2 000 bp的亮度增强(菌群丰度增加),在300~750 bp的亮度减弱(菌群丰度减少);与模型组比较,黄连解毒汤高剂量组、中剂量组、低剂量组及二甲双胍组条带在750 bp的亮度增强(菌群丰度增加),见图1。
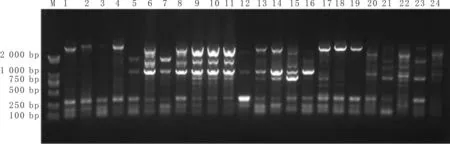
注:M:2 000 DNA Marker;1~4:对照组;5~8:模型组;9~12:二甲双胍组;13~16:黄连解毒汤高剂量组;17~20:黄连解毒汤中剂量组;21~24:黄连解毒汤低剂量组。
灌胃第14天,与模型组比较,黄连解毒汤高剂量组、中剂量组、低剂量组及二甲双胍组条带在1 000 bp 以上的亮度减弱(菌群丰度减少),见图2。
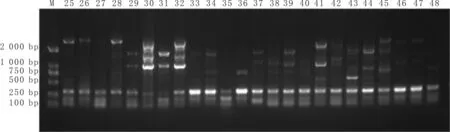
注:M:2 000 DNA Marker;25~28:对照组;29~32:模型组;33~36:二甲双胍组;37~40:黄连解毒汤高剂量组;41~44:黄连解毒汤中剂量组;45~48:黄连解毒汤低剂量组。
灌胃第21天,与模型组比较,二甲双胍组和黄连解毒汤高剂量组、中剂量组、低剂量组条带在300~750 bp的亮度增强(菌群丰度增加);与模型组比较,黄连解毒汤高剂量组、中剂量组条带在 300~500 bp的亮度增加(菌群丰度增加),见图3。

注:M:2 000 DNA Marker;49~52:对照组;53~56:模型组;57~60:二甲双胍组;61~64:黄连解毒汤高剂量组;65~68:黄连解毒汤中剂量组;69~72:黄连解毒汤低剂量组。
3.3 各组大鼠肠道菌群DNA同源性分析灌胃第21天,对照组500 bp条带、模型组400 bp和 1 000 bp 条带的DNA测序结果显示,对照组为拟杆菌门,优势菌群为拟杆菌属(Bacteroidessp.)、杜氏邓氏菌(Duncanielladubosii)和金黄杆菌属(Chryseobacteriumsp.);模型组为厚壁菌门、变形菌门和拟杆菌门,厚壁菌门的优势菌群为梭菌目细菌(ClostridialesbacteriumCCNA10)和普拉梭菌(Faecalibacteriumprausnitzii),变形菌门的优势菌群为铜绿假单胞菌(Pseudomonasaeruginosa),拟杆菌门的优势菌群为杆菌属(Flavonifractorplautii),见表2。

表2 对照组和模型组大鼠灌胃第21天肠道菌群 DNA同源性分析
灌胃第7天,黄连解毒汤高剂量组750 bp条带、中剂量组200 bp条带、低剂量组1 200 bp条带以及二甲双胍组1 000 bp条带的DNA测序结果显示,黄连解毒汤高剂量组为厚壁菌门和拟杆菌门,厚壁菌门的优势菌群为布劳特菌,拟杆菌门的优势菌群为拟杆菌属;黄连解毒汤中剂量组为拟杆菌门,优势菌群为脆弱拟杆菌(Bacteroidesfragilis)和拟杆菌属;黄连解毒汤低剂量组为厚壁菌门,优势菌群为双发酵副梭菌(Paraclostridiumbifermentans);二甲双胍组为变形菌门,优势菌群为大肠埃希杆菌(Escherichiacoil),见表3。

表3 各药物组大鼠灌胃第7天肠道菌群DNA同源性分析
灌胃第14天,黄连解毒汤高剂量组700 bp条带、中剂量组550 bp条带、低剂量组350 bp条带以及二甲双胍组290 bp条带的DNA测序结果显示,黄连解毒汤高剂量组为拟杆菌门和变形菌门,拟杆菌门的优势菌群为拟杆菌目细菌(Bacteroidalesbacterium),变形菌门的优势菌群为假单胞菌(Pseudomonassp.);黄连解毒汤中剂量组为放线菌门,优势菌群为假锁杆菌属(Pseudoclavibactersp.)和链霉菌属(Streptomycessp.);黄连解毒汤低剂量组为拟杆菌门,优势菌群为Muribaculumgordoncarteri、肠杆菌(Muribaculumintestinale)、杜氏邓氏菌和杆菌科细菌(Muribaculaceaebacterium);二甲双胍组为变形菌门,优势菌群为弗格森埃希菌(Escherichiafergusonii)和大肠埃希杆菌,见表4。

表4 各药物组大鼠灌胃第14天肠道菌群DNA同源性分析
灌胃第21天,黄连解毒汤高剂量组1 000 bp条带、中剂量组600 bp条带以及二甲双胍组400 bp条带的DNA测序结果显示,黄连解毒汤高剂量组为拟杆菌门,优势菌群为普雷沃氏菌属;黄连解毒汤中剂量组为拟杆菌门,优势菌群为Muribaculumgordoncarteri、杜氏邓氏菌和拟杆菌属;二甲双胍组为拟杆菌门,优势菌群为Muribaculumgordoncarteri、肠杆菌、普雷沃氏菌、杆菌科细菌和杆菌属,部分菌种无中文名称,故未给出,见表5。

表5 各药物组大鼠灌胃第21天肠道菌群DNA同源性分析
4 讨论
目前,临床治疗T2DM的药物种类较多,且效果良好,但存在诸多不良反应。长期服用二甲双胍可引起维生素B12水平下降[10]。老年患者和肝、肾功能不全者服用磺脲类药物时,若使用不当容易引起低血糖反应,并且磺脲类药物可能导致肥胖[11]。噻唑烷二酮类药物可能导致患者体质量增加和水肿,与胰岛素联合使用时不良反应尤为显著。此外,噻唑烷二酮类药物的使用与骨折、心力衰竭的风险增加有关[12]。服用α-糖苷酶抑制剂的常见不良反应为胃肠道反应[13]。因此,寻找疗效稳定、安全性高、耐受性好及不良反应少的新型降血糖药物成为当前的研究热点。
中药含有多种有效成分和活性成分,在治疗T2DM时具有安全性高、不良反应小等优势,同时中药的多靶点特性能够有效提高其生物利用度[14]。中医药能够为T2DM患者提供个体化的治疗方案,旨在达到最佳治疗效果并减轻药物不良反应[13]。中医学强调“天人合一”的整体观念,认为人的生理、病理与自然环境息息相关,治疗时应从整体出发,调节机体内环境,以达到治疗和预防疾病的目的[15]。肠道菌群平衡对人体健康至关重要,能够分解食物中的多种成分,促进消化和营养物质的吸收,保护肠道黏膜的屏障功能,防止有害物质进入血液循环,同时刺激肠道中的免疫细胞,调节免疫系统,并影响大脑中的神经递质和激素水平,从而调节人的心理状态等[16]。
黄连解毒汤中的黄连含有生物碱,其中小檗碱的含量较高。研究发现,小檗碱能够调节糖尿病大鼠肠道内的菌群平衡,使双歧杆菌丰度增加,同时降低大肠杆菌丰度,从而达到降血糖的效果。双歧杆菌与T2DM呈负相关,并且双歧杆菌能够产生乙酸,调节肠道pH值,预防病原体感染[17]。此外,黄连解毒汤还能通过抑制T2DM的炎症反应,从而降低血糖水平和减轻胰岛素抵抗[16]。临床研究表明,黄连解毒汤加减治疗T2DM,可显著增加患者的乳杆菌、拟杆菌和双歧杆菌等益生菌数量,调节糖脂代谢[19]。黄连解毒汤的活性成分包括小檗碱、黄芩素、黄芩苷、栀子苷等,共同发挥抗炎作用,还能通过调节胰腺β细胞和肠道L细胞增殖从而降低血糖水平[20]。
研究发现,肠道菌群与T2DM的发生存在一定关联。T2DM患者肠道的厚壁菌门、变形菌门(Proteobacteria)和放线菌门(Actinomycetes)丰度增加,拟杆菌门(Bacteroidates)和疣微菌门(Verrucomicrobia)丰度降低[21]。T2DM大鼠肠道的厚壁菌门、变形菌门和拟杆菌门丰度增加,其中机会致病菌铜绿假单胞菌的丰度增加[22],产生短链脂肪酸(short chain fatty acids,SCFAs)的梭菌目细菌增加[23]。黄连解毒汤能够增加普雷沃氏菌属、拟杆菌门、变形菌门和布劳特菌的丰度[24-25]。布劳特菌属于厚壁菌门Lachnospiraceae科,可以发酵碳水化合物,从而为机体提供能量。
本研究发现,黄连解毒汤高剂量灌胃第7天时,SCFAs产生菌和抗炎菌的丰度增加,如布劳特菌和拟杆菌属;灌胃第14天时,拟杆菌目细菌和假单胞菌的丰度增加;灌胃第21天时,普雷沃氏菌属的丰度增加。黄连解毒汤中剂量灌胃第7天时,有益菌脆弱拟杆菌和拟杆菌属的丰度增加。黄连解毒汤低剂量灌胃第21天时,SCFAs产生菌普雷沃氏菌和各种肠杆菌的丰度增加。因此,Muribaculumgordoncarteri和杜氏邓氏菌可能是黄连解毒汤治疗T2DM的重要菌群。
综上所述,黄连解毒汤对T2DM大鼠的肠道菌群结构具有调节作用,菌群调节效果受药物剂量和治疗时间的影响。本研究通过ERIC-PCR和Sanger测序技术观察黄连解毒汤对T2DM大鼠肠道菌群结构的影响,为该方剂的开发与利用提供研究基础。但菌群种类较多,回收时难以得到条带单一、浓度和纯度较高的DNA,导致测序存在一定的困难,且未对菌群进行定量分析,这些内容将在未来的研究中加以完善。
