基于网络药理学与细胞实验探讨加味黄芪桂枝五物汤治疗类风湿关节炎的作用机制*
2024-04-23徐俊张彦红陈姣姣张雨泽庄丽华
徐俊,张彦红,陈姣姣,张雨泽,庄丽华
湖北中医药大学,湖北 武汉 430065
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节滑膜炎症为特征的慢性自身免疫性疾病。据统计,RA的全球发病率约为1%[1],其病情反复发作,缠绵难愈,易导致关节畸形。研究表明,RA确诊后的首个5年致残率达30%,平均寿命缩短5~7年[2],对人类健康造成极大危害。目前,RA的临床治疗主要包括抗风湿药、非甾体类抗炎药、糖皮质激素和生物制剂[3],但这些药物存在不良反应多、价格昂贵等问题[4-6]。因此,寻找新型抗RA药物已成为风湿病学界长期关注的焦点。
中医药从整体出发,通过辨病与辨证相结合,对改善RA患者的临床症状、延缓疾病进展以及提高生活质量具有确切优势。RA属于中医学“痹证”“尪痹”等范畴,常因阳气亏虚,复感外邪,导致气血运行不畅,经络痹阻,从而产生肢体关节疼痛、麻木及活动不利等症状,阳虚血痹是其重要病机。黄芪桂枝五物汤出自《金匮要略》,具有补益气血、温通卫阳、散寒除痹的功效,是治疗痹证的经典方剂。湖北省中医骨伤科学科带头人彭锐教授基于“阳虚血痹”的基本病机,提出治疗本病应以温阳养血为主、活血通络为辅[7],并在黄芪桂枝五物汤基础上加鸡血藤、淫羊藿、全蝎、蜈蚣和甘草,以增强温阳养血逐痹之功,为其临床治疗RA的经验方。本研究拟采用网络药理学技术结合细胞实验,初步探索加味黄芪桂枝五物汤干预RA的作用机制。
1 材料
1.1 动物SPF级SD大鼠20只,雄性,7周龄,体质量(200±20) g,购自辽宁长生生物公司,实验动物使用许可证号:SYXK(鄂)2017-0067。动物饲养于湖北中医药大学动物实验中心,环境温度21~25 ℃,湿度40%~60%,自由进食和饮水。本研究经湖北中医药大学伦理委员会审核批准,伦理编号:HLK-20200330-001。
1.2 细胞人类风湿关节炎滑膜成纤维细胞株MH7A,购自中国Biovector NTCC公司,编号:E0326,按12传代培养。
1.3 药物与试剂加味黄芪桂枝五物汤(组成包括:黄芪、桂枝、白芍、生姜、大枣、鸡血藤、淫羊藿、甘草、全蝎、蜈蚣,购自湖北中医药大学国医堂门诊部,批号:20220106);CCK-8试剂盒(美仑生物科技公司,货号:65162-13-2);Annexin V-FITC/PI细胞凋亡双染试剂盒(美国BD公司,货号:556547);胎牛血清(四季青公司,货号:11011-8611);DMEM高糖培养基、磷酸盐缓冲液(phosphate buffered saline,PBS)、脂多糖(lipopolysaccharide,LPS)(北京索莱宝科技有限公司,货号:12100、P1020、L8880);磷脂酰肌醇-3-激酶(phosphatidylinositol-3-hydroxykinase,PI3K)抗体、磷酸化蛋白激酶B(phosphorylated protein kinase B,p-AKT)抗体(Affinity生物科技公司,货号:AF6243、AF0016);HRP标记羊抗兔二抗、白细胞介素-17(interleukin-17,IL-17)ELISA试剂盒、白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒、肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)ELISA试剂盒(武汉博士德生物工程有限公司,货号:BA1054、EK0431、EK0412、EK0527);BCA蛋白浓度测定试剂盒(武汉碧云天生物科技公司,货号:P0010);蛋白marker(金斯瑞科技生物公司,货号:M00521);GAPDH抗体(杭州贤至生物有限公司,货号:AB-P-R 001)。
1.4 仪器流式细胞分析仪(美国BD公司,批号:G20190053);酶标仪(Thermo公司,型号:mμlISKANMK3);PCR仪(Bio-rad公司,型号:580BR10905);电泳仪、凝胶成像仪(Tanon公司,型号:HE-120、2500);倒置生物显微镜(Olympus公司,型号:CKX53);微量移液器(Eppendorf公司,编号:2015001);HH1型数显恒温水浴锅(常州天瑞仪器有限公司);50A型压力蒸汽灭菌器(上海三申医疗器械有限公司);梯度冻存盒(Biosharp公司,型号:BS-02-CFC)。
2 方法
2.1 网络药理学研究通过中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)(http://tcmspw.com)、BATMAN-TCM数据库检索加味黄芪桂枝五物汤的活性成分和作用靶点,以口服生物利用度(oral bioavailability,OB)≥30%、药物相似性(drug likeness,DL)≥0.18为条件进行筛选。
以“rheumatoid arthritis”为关键词,在GeneCards数据库(https://www.genecards.org/)、OMIM数据库(http://www.omim.org/)检索RA的作用靶点,将加味黄芪桂枝五物汤与RA的作用靶点取交集。通过Bioconductor平台(http://bioconductor.org)和R软件对交集基因进行基因本体(Gene Ontology,GO)功能分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析,其中,GO分析结果以FDR<0.01、最小计数为3且富集因子>1.5为标准进行筛选,KEGG分析结果以P<0.01、最小计数为3且富集因子>1.5为标准进行筛选。
2.2 细胞实验
2.2.1 药物制备加味黄芪桂枝五物汤由黄芪 9 g,桂枝9 g,白芍9 g,生姜18 g,大枣6 g,鸡血藤18 g,淫羊藿18 g,甘草6 g,全蝎3 g,蜈蚣3 g组成。将各药物按照相应比例混合后,加10倍量水浸泡30 min,加热回流煎煮,过滤药液;滤液减压浓缩至质量浓度为1.6 g·mL-1的药液,冷却后4 ℃冰箱保存;正式实验时,使用蒸馏水配置成所需浓度,室温静置后使用。
2.2.2 含药血清制备20只SD大鼠随机分为加味黄芪桂枝五物汤组(10只)、正常组(10只),前者以加味黄芪桂枝五物汤(1.8 g·kg-1)灌胃,后者以等剂量生理盐水灌胃,每日1次,持续7 d。末次给药后1 h,乙醚麻醉大鼠,腹主动脉取血,室温静置 1 h,3 000 r·min-1离心10 min,收集上清。将同组大鼠血清混匀,56 ℃水浴条件下灭活30 min;采用0.22 μm 微孔滤膜过滤除菌,分装入2 mL EP管;将血清与DMEM培养基混合,配制成体积分数为5%、10%、20%的含药血清,-20 ℃保存备用。
2.2.3 CCK-8法检测MH7A细胞增殖情况取对数生长期的MH7A细胞,接种于96孔板,每孔100 μL,分为空白组(只含培养基)、对照组(MH7A+正常组血清)、加味黄芪桂枝五物汤低剂量组(MH7A+5%含药血清)、加味黄芪桂枝五物汤中剂量组(MH7A+10%含药血清)、加味黄芪桂枝五物汤高剂量组(MH7A+20%含药血清)。各药物组加入不同体积分数的含药血清(100 μL),对照组加入等体积培养基,以同体积培养基为空白组,每组设置3个复孔;同时采用PBS缓冲液封闭外周,以缓解液体蒸发。细胞培养12 h后,每孔加入CCK-8溶液(10 μL),继续培养4 h,酶标仪在450 nm波长处检测光密度(optical density,OD)值;细胞培养24 h、48 h 时,按照此方法进行检测。
细胞增殖抑制率=1-(药物组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%
2.2.4 Annexin V-PI双染色法检测MH7A细胞凋亡情况取对数生长期的MH7A细胞,接种于6孔板,每孔细胞数为2×105个,分为对照组(MH7A+正常组血清)、加味黄芪桂枝五物汤低剂量组(MH7A+5%含药血清)、加味黄芪桂枝五物汤中剂量组(MH7A+10%含药血清)、加味黄芪桂枝五物汤高剂量组(MH7A+20%含药血清),培养箱中孵育24 h。收集每孔细胞,室温800 r·min-1离心 3 min,弃上清液,留取细胞沉淀。PBS洗涤细胞2次,室温800 r·min-1离心3 min,弃上清,加入 100 μL binding buffer重悬细胞;加入5 μL Annexin V-FITC,轻轻混匀细胞,再加入5 μL PI染色,室温避光孵育15 min;最后加入400 μL binding buffer,并转移至流式管中,上机检测并采用FlowJo软件分析数据。
2.2.5 Western Blot检测MH7A细胞PI3K、p-AKT蛋白表达水平取对数生长期的MH7A细胞,接种于6孔板,每孔细胞数为2×105个,分为对照组(MH7A+正常组血清)、模型组(MH7A+LPS)、加味黄芪桂枝五物汤低剂量组(MH7A+LPS+5%含药血清)、加味黄芪桂枝五物汤中剂量组(MH7A+LPS+10%含药血清)、加味黄芪桂枝五物汤高剂量组(MH7A+LPS+20%含药血清)。模型组加入LPS(1 μg·L-1,100 μL)诱导2 h;药物组加入不同体积分数的含药血清(100 μL)干预24 h,最后2 h加入LPS进行刺激。收集各组细胞,提取总蛋白,采用BCA法测定蛋白浓度;配置12% SDS-PAGE凝胶,电泳,转膜至PVDF膜,5%脱脂牛奶室温封闭2 h;一抗(PI3K浓度1400,p-AKT浓度 11 000)4 ℃孵育过夜;二抗(11 000)室温孵育1 h;ECL化学发光液显影并扫描。采用Quantity One软件分析蛋白条带的灰度值,以目的蛋白与内参蛋白灰度值的比值作为目的蛋白的相对表达量。
2.2.6 ELISA检测MH7A细胞IL-17、TNF-α、IL-6含量细胞培养与分组方法同“2.2.5”项,收集各组细胞,3 000 r·min-1离心5 min,取上清。按照ELISA试剂盒说明书进行操作,检测细胞培养上清液中IL-17、TNF-α、IL-6含量。
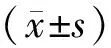
3 结果
3.1 网络药理学结果加味黄芪桂枝五物汤的活性成分141个,作用靶点303个。RA的作用靶点 4 937 个,加味黄芪桂枝五物汤与RA的交集靶点127个。
针对交集靶点进行GO和KEGG分析,GO分析结果中生物过程(biological process,BP)、细胞组成(cell component,CC)、分子功能(molecular function,MF)主要涉及对脂多糖的反应、对细胞增殖的负反馈调节、对细胞因子的反应、细胞活化调节、细胞凋亡过程的正调节等。KEGG通路主要包括PI3K/AKT信号通路、TNF信号通路、钙信号通路等,见图1、图2。

图1 GO分析气泡图

图2 KEGG通路气泡图
3.2 加味黄芪桂枝五物汤对MH7A细胞增殖的影响细胞培养12 h、24 h、48 h时,与对照组比较,加味黄芪桂枝五物汤高剂量组、中剂量组与低剂量组细胞的增殖抑制率升高(P<0.05),见表1。在相同培养时间内,随着含药血清浓度增加,对细胞的增殖抑制作用呈现增强趋势;当含药血清浓度相同时,随着作用时间增加,对细胞的增殖抑制作用呈现增强趋势。由于培养12 h时,加味黄芪桂枝五物汤对MH7A细胞的增殖抑制作用较弱,培养48 h时作用较强,因此,选择细胞培养24 h进行后续实验。
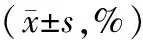
表1 各组细胞增殖抑制率比较
3.3 加味黄芪桂枝五物汤对MH7A细胞凋亡的影响细胞培养24 h时,与对照组比较,加味黄芪桂枝五物汤低剂量组、中剂量组、高剂量组细胞凋亡率增加(P<0.05),见图3、图4。
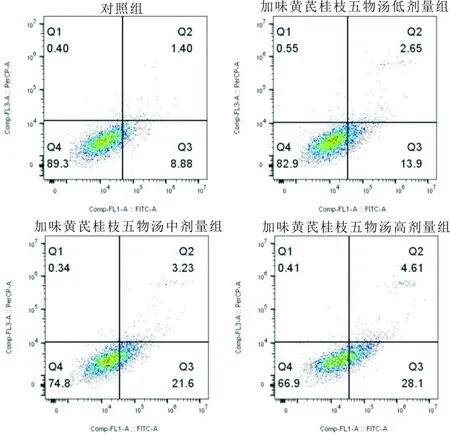
图3 各组细胞凋亡流式图
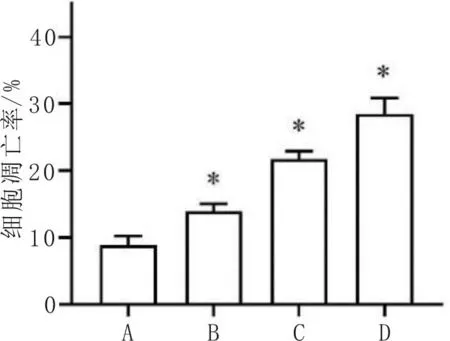
注:A:对照组;B:加味黄芪桂枝五物汤低剂量组;C:加味黄芪桂枝五物汤中剂量组;D:加味黄芪桂枝五物汤高剂量组;与对照组比较,* P<0.05。
3.4 加味黄芪桂枝五物汤对MH7A细胞PI3K、p-AKT蛋白表达水平的影响与对照组比较,模型组细胞PI3K、p-AKT表达水平升高(P<0.05);与模型组比较,加味黄芪桂枝五物汤低剂量组、中剂量组、高剂量组细胞PI3K、p-AKT表达水平降低(P<0.05),见图5。
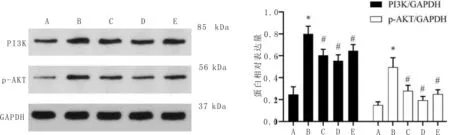
注:A:对照组;B:模型组;C:加味黄芪桂枝五物汤低剂量组;D:加味黄芪桂枝五物汤中剂量组;E:加味黄芪桂枝五物汤高剂量组;与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3.5 加味黄芪桂枝五物汤对MH7A细胞IL-17、TNF-α、IL-6含量的影响与对照组比较,模型组细胞IL-17、TNF-α、IL-6含量升高(P<0.05);与模型组比较,加味黄芪桂枝五物汤低剂量组、中剂量组、高剂量组细胞IL-17、TNF-α、IL-6含量下降(P<0.05),见图6。

注:A:对照组;B:模型组;C:加味黄芪桂枝五物汤低剂量组;D:加味黄芪桂枝五物汤中剂量组;E:加味黄芪桂枝五物汤高剂量组;与对照组比较,*P<0.05;与模型组比较,#P<0.05。
4 讨论
目前,RA的病因和发病机制尚未完全阐明。研究发现,关节外的滑膜组织可分为滑膜内膜衬里层和衬里下层,其中以成纤维细胞样滑膜细胞(fibroblast-like synoviocytes,FLS)为主要组成细胞的滑膜内层直接与关节腔接触。在健康关节中,FLS产生长链多聚透明质酸、糖蛋白润滑素和纤溶酶原活化因子,这些物质能够润滑关节腔并阻止关节内纤维粘连,对维持关节腔的环境稳态起到重要作用[8-9]。RA的FLS数量显著增加,导致滑膜衬里层从薄而易碎的结构转变为浸润性增生性血管翳样结构[10-11]。FLS表达的基质金属蛋白酶(matrix metalloproteinase,MMP)是破坏软骨的重要因素,分泌的细胞因子(如IL-6、TNF-α)和趋化因子加剧滑膜组织炎性反应的持续性[12]。此外,FLS产生的诱导增殖细胞因子和抗凋亡细胞因子影响细胞分裂周期,从而导致细胞异常增殖[13-14]。FLS的异常表达可能诱导肿瘤样改变,从而导致关节腔狭窄甚至关节破坏[15]。因此,滑膜组织FLS的异常增殖是RA的标志性病理特征之一。
网络药理学研究发现,对细胞增殖的负调控是加味黄芪桂枝五物汤干预RA的重要机制之一。实验研究发现,加味黄芪桂枝五物汤干预MH7A细胞12 h、24 h、48 h后,均能有效抑制滑膜成纤维细胞增殖,且在相同干预时间内,含药血清浓度的增加与细胞增殖抑制作用呈正相关。同时,加味黄芪桂枝五物汤含药血清干预MH7A细胞24 h后,细胞凋亡水平明显上升,且与含药血清浓度呈正相关。因此,加味黄芪桂枝五物汤通过抑制细胞增殖和促进细胞凋亡两个方面实现对滑膜成纤维细胞的调控。
PI3K/AKT信号通路是重要的细胞内信号转导途径,与RA的发生发展密切相关。PI3K受上游分子刺激活化后,通过改变AKT的蛋白结构,使其磷酸化激活,进而抑制下游一系列底物,如凋亡相关蛋白B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、FLICE样抑制蛋白(Flice-like inhibitory protein,FLIP)、肌球蛋白调节性轻链(regulatory myosin light chain,Mcl2)等,从而调节细胞增殖、分化、凋亡和迁移等表型[16-17]。研究显示,RA 患者滑膜细胞中PI3K/AKT信号通路处于异常激活状态[18],活化的PI3K/AKT信号通路可通过介导下游多种效应分子,如Bcl-2、半胱氨酸蛋白酶9等,导致滑膜细胞凋亡失衡,这是RA滑膜细胞病理性增生的机制之一[19-20]。细胞实验发现,加味黄芪桂枝五物汤干预MH7A细胞24 h后,PI3K、p-AKT蛋白表达水平降低,IL-17、TNF-α、IL-6含量下调,初步证实PI3K/AKT信号通路可能是加味黄芪桂枝五物汤干预RA的机制之一,且该方可能抑制滑膜组织炎症反应的持续性和滑膜成纤维细胞的异常增殖。
综上所述,加味黄芪桂枝五物汤可能通过调节PI3K/AKT信号通路等相关途径,抑制MH7A细胞增殖、促进细胞凋亡,降低炎症因子水平,从而发挥抗RA的作用。后续研究将继续探讨加味黄芪桂枝五物汤如何通过PI3K/AKT信号通路影响RA的炎症和细胞增殖,并寻找上游靶点,利用生物信息学和基因编辑技术深入挖掘其作用机制。
