三物白散对胃癌细胞自噬相关蛋白Beclin1、LC3、p62表达的影响*
2024-04-22袁宇晴谢超群魏堰翀刘旭东邹君君
袁宇晴,龙 丹,谢超群,魏堰翀,刘旭东,朱 莹,邹君君
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007;3.湖南中医药大学第二附属医院,湖南 长沙 410005)
胃癌(gastric carcinoma,GC)是指原发于胃的上皮源性恶性肿瘤。胃癌是全球第五大恶性肿瘤,也是癌症的主要致死原因之一[1]。据世界卫生组织(World Health Organization,WHO)统计,2020年我国胃癌新发病例超过47.9万例,死亡病例达37.4万例,分别占全球胃癌发病和死亡的44.0%和48.6%[2]。近年来,尽管在全球范围内胃癌的总体发生率有所下降,但我国作为胃癌高发国家,在恶性肿瘤中其发病率和死亡率均高居第2位,防治意义重大[1]。目前,胃癌的发病机制尚未完全明确,可能与幽门螺杆菌感染、高盐饮食、吸烟、饮酒等多种因素相关。胃癌的发生是综合多个步骤和阶段受多重因素相互影响作用的复杂过程,需要众多基因的参与[3-4]。
早期GC可根据肿瘤侵犯深度,接受内镜下治疗或手术治疗,但大多数病例在发现时已属中晚期,失去了手术机会。目前放疗、化疗及靶向治疗在GC治疗方面的进展并不明显,而中医药在治疗GC上有着独特的优势。中药在改善癌症患者的生活质量和延长生存期方面发挥了不可或缺的作用,可通过抑制多药耐药性和减少副作用来提高疗效[5-7]。“温下法”治疗胃癌的临床疗效显著。前期研究表明:经方三物白散治疗胃癌具有较好的临床疗效,但其作用机制仍不明确[8-10]。从“自噬”相关通路探讨中医药治疗胃癌的作用机制是当前研究的热点[11-13]。自噬基因BECN 1(Beclin1)是哺乳动物参与自噬的特异性基因,可正向调节自噬。上调Beclin1表达可以诱导自噬的发生[14]。微管相关蛋白轻链3(LC3)是自噬性细胞死亡的特异性分子标志物。当自噬受到激活时,LC3通过被蛋白酶水解,转化成微管相关蛋白轻链3Ⅰ(LC3-Ⅰ)的胞质蛋白。LC3-Ⅰ再与磷脂酰乙醇胺相互作用,转变成微管相关蛋白轻链3Ⅱ(LC3-Ⅱ)的膜蛋白。因此LC3-Ⅱ与LC3-Ⅰ比值的高低可反映自噬的激活情况[15-16]。自噬降解底物蛋白1(p62)可以作为一种底物蛋白,将广泛蛋白运送至自噬体内并在自噬过程中被消耗。自噬活性越强,p62表达越低[17-18]。本实验基于三物白散对胃癌细胞自噬相关蛋白Beclin1、LC3、p62表达的影响,探究三物白散抗胃癌的作用机制,旨在为该方的临床运用提供实验依据。
1 材料
1.1 动物及细胞 28只SPF级雄性大鼠,8周龄,体质量(200.76±8.24)g,采购于湖南斯莱克景达实验动物有限公司,动物生产许可证号:SYCK(湘)2020-0038。喂养环境室温保持在20~25 ℃,湿度50%~70%,12 h/12 h明暗光照,动物自由进食进水,分笼饲养。本实验经湖南中医药大学第一附属医院伦理委员会审批通过(审批号:ZYFY20220530-04)。胃癌细胞系AGS细胞(Procell CL-0022)购自武汉普诺赛生命科技有限公司。
1.2 药物及试剂 三物白散混悬液由巴豆霜(含10%油)、浙贝母、桔梗(质量比为1:3:3)组成。饮片购自湖南中医药大学第一附属医院中药房,经药学部邓桂明研究员鉴定为正品。兔源一抗p62(批号:00059474)、兔源一抗LC3B(批号00044252)、鼠源一抗Beclin1(批号00063125)、鼠源一抗β-actin(批号:00110322)均购自美国proteintech公司;miRNA逆转录试剂盒(批号:25722)、mRNA逆转录试剂盒(批号:09623)购自中国北京康为世纪有限公司。
1.3 主要仪器 磁力搅拌器(上海仪电科学仪器股份有限公司,型号:JB-13);低速离心机(上海知信实验仪器技术有限公司,型号:SL02);电磁炉(荷兰飞利浦电子公司,型号:HD4925);电泳槽(北京六一生物科技有限公司,型号:DYCZ-24DN);电泳仪(北京六一生物科技有限公司,型号:DYY-2C);电子天平(常熟市双杰测试仪器厂,型号:JJ224BC);化学发光成像系统(上海勤翔科学仪器有限公司,型号:ChemiScope6100);精密PH计(上海仪电科学仪器股份有限公司,型号:PHS-3C);生物样品均质仪(杭州奥盛仪器有限公司,型号:BioPrep-24);水平琼脂糖电泳槽(北京六一生物科技有限公司,型号:DYCP-31DN);台式冷冻离心机(湖南湘仪科学仪器设备有限公司,型号:H1650R);旋涡混合器(其林贝尔仪器制造有限公司,型号:GL-88B);摇床(其林贝尔仪器有限公司,型号:TS-1);荧光PCR板(美国Thermofisher公司,型号:SPL0960);荧光定量RCP仪(美国Thermofisher公司,型号:PIKOREAL96);转膜仪(北京六一生物科技有限公司,型号:DYCZ-40D)。
2 方法
2.1 药物制备 根据本课题组前期研究方法[19-21],将桔梗、浙贝打粉后,参照《伤寒论》原文,并参考《人和动物间按体表面积折算的等效剂量比值表》换算成大鼠给药浓度,取含油量为10%的巴豆霜0.5 g、浙贝母1.5 g、桔梗1.5 g,混匀后加入超纯水700 mL调节成0.005 g/mL的混悬液,封于玻璃瓶内,灭菌后4 ℃保存。
2.2 含药血清制备 28只SPF级雄性大鼠,体质量200~220 g,编号后根据体质量用随机数字法随机分为空白组、三物白散低剂量组、三物白散中剂量组、三物白散高剂量组,每组7只,适应性饲养3 d。灌胃开始前,所有大鼠禁食12 h。三物白散低、中、高剂量组分别按0.031 25、0.062 5、0.125 0 g/(kg·d)剂量灌胃,空白组给予相同体积的生理盐水,1 mL/(kg·d),1次/d,连续灌胃7 d。最后一次灌胃完成45 min后,将所有大鼠以0.3%戊巴比妥(10 mL/kg)麻醉。大鼠取仰卧位,“ V”型剪开大鼠腹部皮肤,用小滤纸片轻轻地将肠管及脂肪推向鼠左侧腹部,使其腹主动脉充分暴露,采血针自下而上进针,待进针完成后,采血针另一侧插入真空采血管中。采血结束后,将采血管室温静置1 h,以3 000 r/min(离心半径为10 cm)离心15 min,然后用移液器吸取上层血清到新的离心管中。离心管置于56 ℃水浴30 min灭活补体,用0.22 μm微孔滤膜无菌过滤后,分装于2 mL离心管,储存于-80 ℃冰箱,用于后续实验。
2.3 细胞培养及分组 AGS细胞用10%的完全培养基(Ham's F 12营养液+10%胎牛血清FBS+1%青霉素-链霉素溶液)置于37 ℃、5%CO2培养箱中培养。细胞分为空白对照组(空白组)、三物白散低剂量含药血清组(低剂量组)、三物白散中剂量含药血清组(中剂量组)、三物白散高剂量含药血清组(高剂量组)。
2.4 CCK-8法检测AGS细胞活性的影响 将生长状况良好的细胞接种于6孔板中,经PBS冲洗、胰酶消化、离心后,添加完全培养基,吹打均匀成单细胞悬液,接种于96孔板,每孔加入细胞悬液100 μL,使得细胞数为2×103个/孔,在96孔板最外一周的孔中加入100 μL PBS防止挥发。待细胞密度长至50%~60%时高、中、低剂量组分别加入5%、10%、15%、20%的含药血清,每组设置3个复孔,继续培养24、48 h,每孔加入10 μL的CCK-8溶液及试剂干预细胞,然后在细胞培养箱中孵育2 h。孵育完成后用酶标仪于450 nm波长处测定OD值。细胞活性=(实验组吸光度值-空白组吸光度值)/(对照组吸光度值-空白组吸光度值)×100%。
2.5 三物白散含药血清对AGS细胞形态变化的影响 将活性、形态均正常的AGS细胞用胰酶消化,分别接种于6孔板中,并于37 ℃,5%CO2培养箱中培养12 h,待细胞贴壁后,分别加入空白血清、低剂量含药血清、中剂量含药血清、高剂量含药血清,干预48 h,每组设3个复孔。分别于0、48 h在倒置显微镜下观察并拍照,比较细胞的形态变化。
2.6 LC3-ⅠmRNA、LC3-ⅡmRNA、p62 mRNA、Beclin1 mRNA表达 采用RT-qPCR法检测LC3-ⅠmRNA、LC3-ⅡmRNA、p62 mRNA、Beclin1 mRNA表达。各组AGS细胞干预24、48 h后,使用Trizol、三氯甲烷、异丙醇提取细胞总RNA,紫光分光光度计测定RNA浓度和纯度。配制反转录反应体系,将RNA反转录为cDNA,PCR进行定量扩增,2-ΔΔCt法计算目的基因相对表达量。引物序列见表1。

表1 引物序列
2.7 LC3-Ⅱ、LC3-Ⅰ、Beclin1、p62蛋白表达 采用Western blotting法检测LC3-Ⅱ、LC3-I、Beclin1、p62蛋白表达。各组AGS细胞干预24、48 h后,提取总蛋白,用BCA法测定蛋白浓度。于蛋白样品中按比例加入上样缓冲液,100 ℃水浴中变性5 min,放入-80 ℃冰箱保存备用。SDS-PAGE电泳,转膜,5%BSA室温封闭1 h后加入一抗(1:1 000),4 ℃孵育过夜,二抗(1:5 000)室温孵育1 h,化学发光法显影,用ImageJ软件进行数据分析。实验重复3次。
2.8 统计学方法 采用SPSS 26.0及GraphPad Prism 9.0统计分析软件进行数据统计分析及绘图。计量资料以“均数±标准差”(±s)表示,计量资料符合正态分布且方差齐,采用One-Way ANOVA进行分析。P<0.05为差异有统计学意义。
3 结果
3.1 三物白散含药血清对AGS细胞活性的影响及最佳浓度的确定 当处理时间相同时,5%、10%、15%、20%高、中、低剂量组AGS细胞活性显著低于空白组(P<0.01);10%、15%、20%高剂量组AGS细胞活性低于5%高剂量组(P<0.05或P<0.01),20%中剂量组AGS细胞活性低于5%中剂量组(P<0.01),15%、20%低剂量组AGS细胞活性低于5%低剂量组(P<0.05);20%高剂量组AGS细胞活性低于10%、15%高剂量组(P<0.01),20%中剂量组AGS细胞活性低于10%中剂量组(P<0.05),20%低剂量组AGS细胞活性低于10%低剂量组(P<0.05)。(见表2~4)
表2 不同浓度三物白散高剂量含药血清对胃癌AGS 细胞活性的影响 (±s,%)
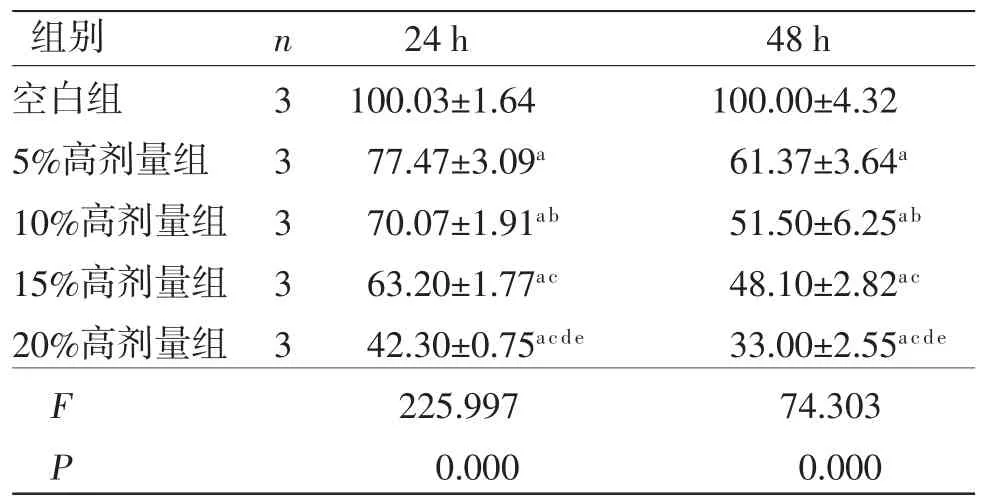
表2 不同浓度三物白散高剂量含药血清对胃癌AGS 细胞活性的影响 (±s,%)
注:与空白组比较,aP<0.01;与5%高剂量组比较,bP<0.05,cP<0.01;与10%高剂量组比较,dP<0.01;与15%高剂量组比较,eP<0.01。
?
表3 不同浓度三物白散中剂量含药血清对胃癌AGS 细胞活性的影响 (±s,%)
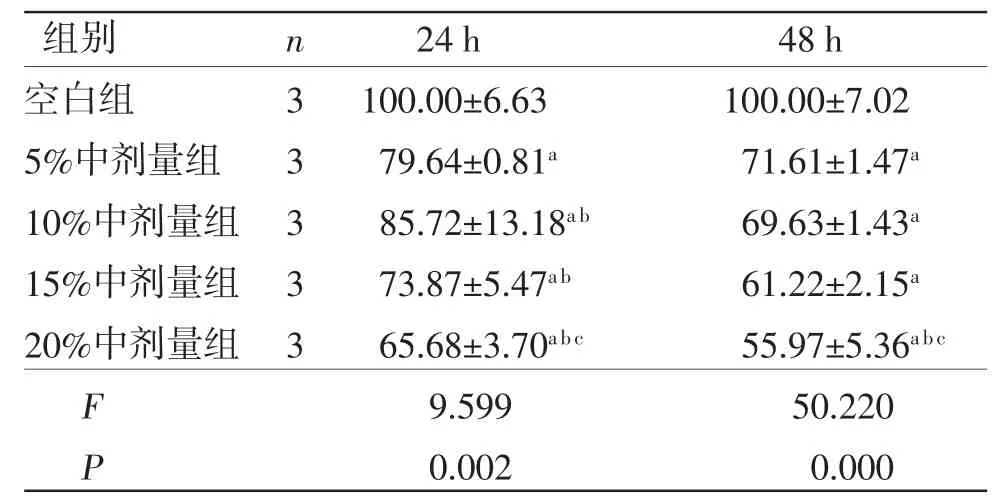
表3 不同浓度三物白散中剂量含药血清对胃癌AGS 细胞活性的影响 (±s,%)
注:与空白组比较,aP<0.01;与5%中剂量组比较,bP<0.01;与10%中剂量组比较,cP<0.05。
?
表4 不同浓度三物白散低剂量含药血清对胃癌AGS 细胞活性的影响 (±s,%)
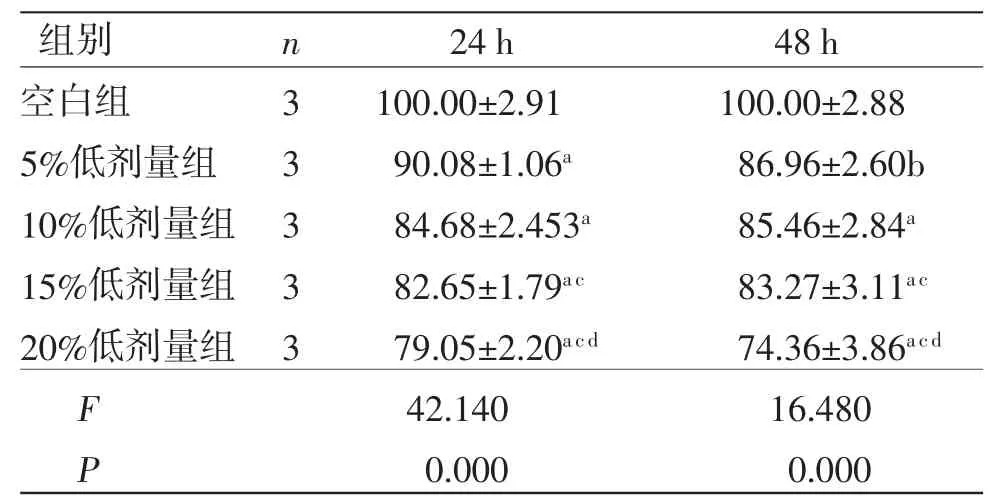
表4 不同浓度三物白散低剂量含药血清对胃癌AGS 细胞活性的影响 (±s,%)
注:与空白组比较,aP<0.01,bP<0.05;与5%低剂量组比较,cP<0.05;与10%低剂量组比较,dP<0.05。
?
处理时间为48 h时,5%、10%、15%、20%高剂量组AGS细胞活性低于处理时间为24 h(P<0.05或P<0.01);5%、15%中剂量组AGS细胞活性低于处理时间为24 h(P<0.05或P<0.01);5%、10%、15%、20%低剂量组AGS细胞活性与处理时间为24 h比较,差异无统计学意义(P>0.05)。(见图1~3)
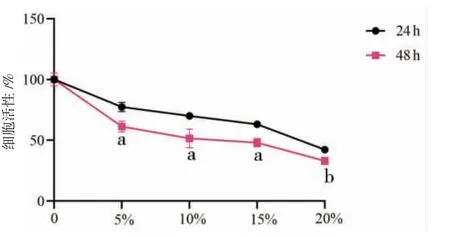
图1 不同浓度三物白散高剂量含药血清对胃癌AGS 细胞活性的影响 (±s,n=3)
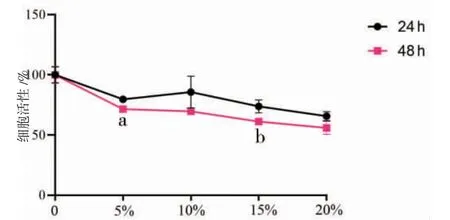
图2 不同浓度三物白散中剂量含药血清对胃癌AGS 细胞活性的影响 (±s,n=3)
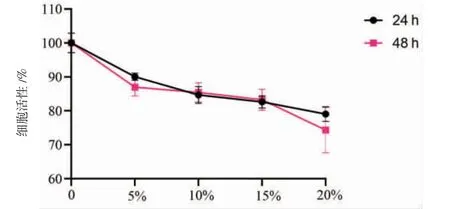
图3 不同浓度三物白散低剂量含药血清对胃癌AGS 细胞活性的影响 (±s,n=3)
综上所述,三物白散含药血清对AGS细胞有明显抑制作用,与空白组比较,5%、10%、15%、20%三物白散高剂量含药血清可呈浓度-时间依赖性抑制AGS细胞活性,故选用抑制细胞活性效果最佳的20%浓度开展后续实验。
3.2 三物白散含药血清对AGS细胞形态的影响 空白组细胞间连接紧密,细胞形态呈较规则的多边形,细胞数量较多。与空白组比较,低、中、高剂量组细胞间连接逐渐疏松,排列逐渐错乱,细胞形态逐渐变细变长,形态欠规则,细胞数量逐渐减少。中、高剂量组部分细胞变成碎片,培养基表面漂浮少量死细胞。(见图4)

图4 三物白散含药血清对AGS 细胞形态的影响 (×10)
3.3 三物白散含药血清对AGS细胞Beclin1 mRNA、LC3-ⅠmRNA、LC3-ⅡmRNA、p62 mRNA表达的影响 高、中剂量组AGS细胞Beclin1 mRNA、LC3-ⅠmRNA、LC3-ⅡmRNA相对表达量高于空白组,p62 mRNA相对表达量低于空白组(P<0.01);低剂量组AGS细胞LC3-ⅠmRNA、LC3-ⅡmRNA相对表达量高于空白组,p62 mRNA相对表达量低于空白组(P<0.01)。(见图5)
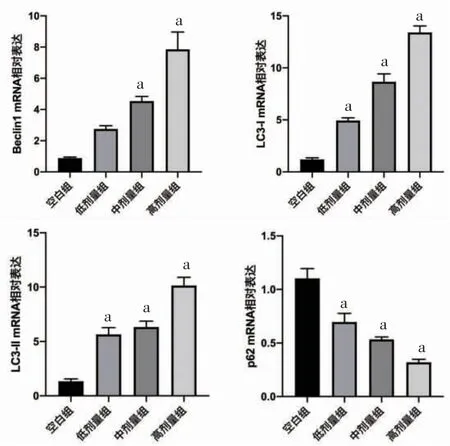
图5 三物白散含药血清对AGS 细胞Beclin1 mRNA、LC3-ⅠmRNA、LC3-ⅡmRNA、p62 mRNA 表达的影响(±s,n=3)注:与空白组比较,aP<0.01。
3.4 三物白散含药血清对AGS细胞Beclin1、p62蛋白表达及LC3-Ⅱ/LC3-Ⅰ的影响 高剂量组AGS细胞Beclin1蛋白相对表达量及LC3-Ⅱ/LC3-Ⅰ高于空白组,p62蛋白相对表达量低于空白组(P<0.01);中剂量组AGS细胞Beclin1蛋白相对表达量及LC3-Ⅱ/LC3-Ⅰ高于空白组(P<0.05或P<0.01),p62蛋白相对表达量低于空白组(P<0.01)。(见图6~7)
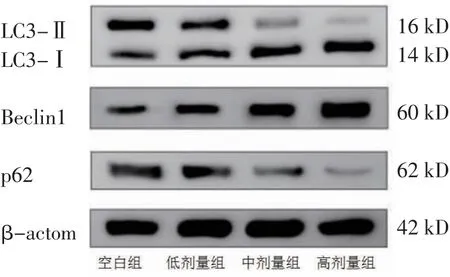
图6 LC3-Ⅱ、LC3-Ⅰ、Beclin1、p62 蛋白表达Western blotting 图

图7 三物白散含药血清对AGS 细胞Beclin1、p62 蛋白表达及LC3-Ⅱ/LC3-Ⅰ的影响 (±s,n=3)
4 讨论
中医学对肿瘤病理的认识基本达到共识,总结为“正”“邪”消长两方面,即“正胜则邪却”和“邪盛则病进”[22]。但治法上却存在两种观点,即“扶正以祛邪”和“祛邪以扶正”。基于中医理论“邪之所凑,其气必虚”,“壮实人无积,虚人则有之”,中晚期肿瘤的治疗主要应用“扶正以祛邪”治则,选方用药偏重补益[23-24]。此外,“祛邪以扶正”亦在中医古籍中早有记载,如“坚者削之”“结者散之”等[25]。“癥瘕”“反胃”“积聚”等疾病包含了现代医学范畴的中晚期肿瘤。张从正从“扶正”的角度来探讨“祛邪”治则,提出“先论其攻邪,邪去而元气自复也”,“医之道,损有余,乃所以补其不足也”,即为“不补之中有真补存焉”。下法能够使“陈痤去而肠胃洁,癥瘕尽而荣卫昌”,突出了“祛邪以扶正”的治疗原则[26]。
三物白散首载于《伤寒论·辨太阳病脉证并治》,即“寒实结胸,无热证者,与三物小白散”[27]。三物白散作为温下逐邪治法的经典名方,由巴豆、贝母、桔梗组成。巴豆味辛、性热,归胃经、大肠经,有利水谷道之效,可破通五脏六腑久积之闭塞[28];桔梗味苦、辛,性平,归肺经、胃经,宣畅气机,宽利胸膈,可破滞气及积块[29];贝母味苦,性寒,归肺经、心经,清热化痰,散结解毒,散心胸久郁痰结[30]。全方药简力专,能温下寒实又不误祛痰结邪气。三物白散以攻伐为重点,但内含桔梗作为“舟车之辑”,又有巴豆可以逐水,实则蕴含了“其高者,因而越之;其下者,引而竭之”这一“因势利导”的治疗法则。这可理解为给邪以出路。现代药理研究表明,桔梗具有调节免疫功能的作用[31]。这可理解为方中所寓之“补”。
GC是指来源于胃黏膜上皮细胞的恶性肿瘤,是消化系统最常见的恶性肿瘤之一。现代医学通常采取外科手术治疗、化学治疗或姑息疗法[32],但由于早期胃癌发现难度较高,且术后胃癌细胞扩散转移率高,外科手术治疗存在较大风险及局限性。近年来,研究自噬对胃癌细胞的干预机制成为GC诊疗的新方向。自噬能够有效抑制GC细胞的增殖、提高人体对化疗靶向药物的反应敏感性[33-34]。自噬全程从启动直到其终止由数种蛋白质分子共同调控。到目前为止,在酵母中发现的与自噬特异性调控有关的蛋白质基因有四十余种,被称为自噬相关蛋白(ATG)。绝大多数ATG在哺乳动物的基因组之间同源性显著。
Beclin1是酵母ATG6的同系物,也是哺乳动物参与自噬的特异性基因。Beclin1是自噬的正向调节基因,上调Beclin1的表达可以诱导自噬的发生。Beclin1既可以与Ⅲ型磷脂酰肌醇3激酶(PI3KC3)相互结合,形成Beclin1-PI3KC3-Vps15复合体,促进自噬发生,又可以与抗凋亡基因B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)相互结合,形成Beclin1-Bcl-2复合体,抑制自噬活性。在特定情况下,c-Jun氨基末端激酶1能够将Bcl-2基因磷酸化,继而与Beclin1基因分离,从而诱导自噬。微管相关蛋白1轻链3(MAPLC3)是酵母ATG8的同系物,可分为2种类型,分别为LC3-Ⅰ和LC3-Ⅱ。LC3-Ⅰ主要存在于细胞质中,而LC3-Ⅱ主要存在于自噬体及自噬溶酶体膜上[35]。当自噬受到激活时,LC3被蛋白酶水解,转化成LC3-Ⅰ的胞质蛋白。LC3-Ⅰ再与磷脂酰乙醇胺相互作用,转变成LC3-Ⅱ的膜蛋白。因此,LC3是自噬性细胞死亡的特异性分子标志物。LC3-Ⅱ与LC3-Ⅰ比值的高低可检测自噬的发生[36]。p62在人体中又称SQSTM1,可与极化调节蛋白非典型蛋白激酶C(atypical protein kinase C,a PKC)形成配体关系,是一种结构域相当丰富的蛋白,参与了众多信号路径的反应[37]。p62可以作为一种底物蛋白,将广泛蛋白运送至自噬体内并在自噬过程中被消耗,与自噬具有双向性的调控作用。它可以激活哺乳动物雷帕霉素靶蛋白1(mammalian target of rapamycin 1,mTORC1)下调自噬活性,而自噬抑制反过来会导致它的聚集,进一步加强自噬被抑制,最终导致p62的大量聚集[17]。
研究表明,加味三物白散方联合化疗能明显提高胃癌患者的临床受益率、远期生存率、生活质量及对化疗的耐受性[38]。三物白散含药血清不仅能有效抑制胃癌SGC-7901细胞的增殖,还能通过Survivin基因沉默转染,对胃癌SGC-7901细胞起到诱导凋亡、抑制迁移的作用[39-40]。此外,徐力等[41]发现,三物白散加味方可以下调胃癌相关基因P53、Bcl-2、rasP21、CD44的表达,这可能是其抗胃癌的作用机制之一;王明艳等[42]发现,三物白散加味方可能通过阻滞胃癌SGC-7901细胞G2/M周期,进而诱导细胞凋亡;王梅等[43]发现,三物白散可逆转Th1/Th2的漂移,从而发挥抗肿瘤的免疫正向调节作用;王莉兰等[44]发现,三物白散可调控TGF-β/Smad通路抑制TGF-β1,诱导胃癌SGC-7901细胞上皮-间质转化的发生。
本实验结果显示,在相同作用时间下,AGS细胞活性随着三物白散含药血清浓度的升高而降低。在三物白散含药血清浓度为20%时,AGS细胞活性最低。在相同处理浓度下,细胞活性随着处理时间的延长而降低,在48 h时细胞活性最低。说明三物白散高剂量含药血清可呈浓度-时间依赖性抑制AGS细胞活性。同时,随着三物白散含药血清浓度升高,细胞形态逐渐不规则,细胞数量逐渐减少。此外,三物白散可上调Beclin1、LC3表达,下调p62的表达,诱导GC细胞自噬。
综上所述,三物白散高剂量含药血清能抑制胃癌AGS细胞增殖,该效应呈浓度-时间依赖性。三物白散可上调Beclin1、LC3表达,下调p62表达,诱导胃癌细胞自噬。这可能是其抗胃癌作用机制之一。
