基于UHPLC-Q-Exactive Orbitrap MS的芪龙壮儿口服液指纹图谱研究*
2024-04-22崔小敏董明芝陈志永鲁文静
崔小敏,董明芝,陈志永,鲁文静,胡 静,李 宁,曲 彤,任 慧
(1.陕西省中医药研究院,陕西 西安 710061;2.西安正大制药有限公司,陕西 西安 710043)
芪龙壮儿口服液是由著名中医儿科专家午雪峤主任医师根据中医理论,针对小儿脾肾两虚所致疳积、五迟五软、血虚之证拟定的中成药。芪龙壮儿口服液为OTC甲类中成药,以黄芪、党参为君药,熟地黄、当归、阿胶、鹿角胶、龟甲胶为臣药,龙骨、牡蛎、白术、山药、鸡内金、山楂和麦芽为佐使之药。全方健脾补肾,益气养血,填精充髓,消食和胃,临床主要用于治疗小儿佝偻病。
目前芪龙壮儿口服液的质量控制方法是采用薄层扫描法测定其中黄芪甲苷的含量[1],难以全面反映和控制芪龙壮儿口服液的制剂质量。中药及复方制剂化学成分复杂,质量控制是其研究的难点,检测其中一种成分并不能代表整体质量。中药指纹图谱具有整体性和模糊性的显著特点,能全面、定量反映中药所包含的化学信息,为中药质量控制最常见的有效手段[2]。课题组前期尝试采用HPLC-UV法建立芪龙壮儿口服液指纹图谱,发现HPLC-UV色谱图化学信息量很少。UHPLC-Q-Exactive Orbitrap MS技术将超高效液相色谱对复杂样品的高分离能力与质谱的高分辨率、高灵敏度及能提供化合物的元素组成及离子碎片信息等特点结合起来,可用于化合物的快速鉴定。该技术已被广泛应用于中药化学成分鉴定和指纹图谱研究[3-4]。本研究利用UHPLC-Q-Exactive Orbitrap MS可以同时检测正、负离子化合物的优势,建立了芪龙壮儿口服液正、负两种离子模式下的指纹图谱,同时对10批样品进行了相似度评价,对其中的共有峰进行了质谱鉴定,从正、负两个维度较为全面地表征了该制剂的化学成分指纹特征,旨在为芪龙壮儿口服液的综合质量评价和药效物质研究提供科学依据。
1 仪器与材料
1.1 仪器 UltiMate 3000系列高效液相色谱仪(美国戴安公司);Thermo Fisher Q Exactive Focus型质谱仪,配有可加热电喷雾离子源(HESI)及Xcalibur4.0数据处理软件;KQ-400DE型超声波清洗机(昆山市超声仪器有限公司);BT25S型十万分之一电子分析天平、BS210S型万分之一电子分析天平(北京赛多利斯科学仪器有限公司)。
1.2 药物与试剂 10批芪龙壮儿口服液[规格:10 mL/支;批号:211135(S1),211136(S2),211237(S3),211238(S4),211239(S5),211240(S6),211241(S7),2111242(S8),211243(S9),211244(S10)]由西安正大制药有限公司提供。腺苷(批号:MUST-21070613)、鸟苷(批号:MUST-22021408)、异毛蕊花糖苷(批号:MUST-22030810)均购自成都曼思特生物科技有限公司;L-色氨酸(批号:wkq22011707)、毛蕊异黄酮苷(批号:wkq20010904)、党参炔苷(批号:wkq17110203)、芒柄花苷(批号:wkq20060507)、毛蕊异黄酮(批号:wkq20010906)、芒柄花素(批号:wkq20062208)均购自四川省维克奇生物科技有限公司;3-羟基-9,10-二甲氧基紫檀烷(批号:HR2182W1)、白术内酯Ⅲ(批号:HS20913B1)、焦谷氨酸(批号:HR22271W2)、尿苷(批号:HS2175B1)均购自宝鸡辰光生物科技有限公司;咖啡酸(批号:17122804)购自成都普菲德生物技术有限公司。以上对照品纯度均≥98%。甲醇和甲酸为色谱纯,均购自美国Fisher试剂公司,水为重蒸水,其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件 色谱柱为Thermo Accucore aQ RP18(2.1 mm×150 mm,2.6 μm);流动相为甲醇(A)-0.1%甲酸水溶液(B)梯度洗脱(0~5 min,0%A;5~45 min,0%A~58%A;45~60 min,58%A~65%A);柱温为25 ℃,流速为0.3 mL/min,进样量为2 μL。
2.2 质谱条件 Thermo UHPLC-Q-Exactive Focus型液质联用仪,采用加热电喷雾离子源(HESI),正、负离子同时检测模式,负离子模式下的喷雾电压设定为2 800 V,正离子模式下的喷雾电压设定为3 500 V;碰撞电压为阶梯能量20、40、60 eV;扫描方式为一级全扫描/数据依赖型二级质谱扫描(full MS/dd-MS2),Full MS分辨率为70 000,dd-MS2分辨率为17 500,扫描范围(m/z)为80~1 200,离子传输毛细管温度为320 ℃,透镜电压为55 kPa,雾化室温度为350 ℃,鞘气和辅助气流速分别为40、10 arb。
2.3 溶液的制备
2.3.1 对照品溶液的制备 分正、负两种检测模式制成两组混合对照品溶液。分别取各对照品适量,加甲醇制备成含腺苷、鸟苷、L-色氨酸、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮、3-羟基-9,10-二甲氧基紫檀烷、芒柄花素、白术内酯Ⅲ质量浓度分别为86、37、15、144、46、55、18、25、19 μg/mL的混合对照品溶液Ⅰ(正离子模式)和含焦谷氨酸、尿苷、咖啡酸、毛蕊异黄酮苷、异毛蕊花糖苷、党参炔苷、芒柄花苷、毛蕊异黄酮、芒柄花素质量浓度分别为65、70、20、144、45、24、46、55、25 μg/mL的混合对照品溶液Ⅱ(负离子模式)。
2.3.2 供试品溶液的制备 精密量取芪龙壮儿口服液2 mL,置于15 mL离心管中,加入8 mL乙腈,于涡旋振荡器中振荡混匀5 min,于4 ℃静置0.5 h后,2 500 r/min条件下离心20 min,取上清液1 mL,吹干溶剂,残渣用30%甲醇-水溶解并定容至1 mL,振摇,0.22 μm微孔滤膜过滤,即得。
2.3.3 各单味药样品制备 根据各单味药在处方中对应的处方量和配比取样,制备单味药材样品溶液。
2.4 指纹图谱方法学考察
2.4.1 精密度试验 取供试品溶液(批号:211135)连续进样6次,正离子模式以18号共有峰毛蕊异黄酮为参照峰,负离子模式以9号共有峰毛蕊异黄酮苷为参照峰,分别计算正离子模式下的24个共有峰和负离子模式下的17个共有峰与所选定参照峰的相对保留时间和相对峰面积的RSD。结果RSD值分别小于0.62%和2.84%,表明该方法精密度良好。
2.4.2 稳定性试验 取芪龙壮儿口服液2 mL(批号:211135),按照“2.3.2”项下方法制备供试品溶液,分别在室温放置0、2、4、8、12、24 h进样分析。分别计算正离子模式下的24个共有峰和负离子模式下的17个共有峰与所选定参照峰的相对保留时间和相对峰面积的RSD。结果RSD值均分别小于0.89%和3.16%,表明样品制备成供试品溶液后在室温放置24 h稳定性良好。
2.4.3 重复性试验 取芪龙壮儿口服液2 mL(批号:211135),按照“2.3.2”项下方法平行制备6份供试品溶液并进样分析。分别计算正离子模式下的24个共有峰和负离子模式下的17个共有峰与所选定参照峰的相对保留时间和相对峰面积的RSD。结果RSD值分别小于0.55%和2.97%,表明该方法重复性良好。
2.5 指纹图谱的建立和相似度评价
2.5.1 10批样品指纹图谱建立和相似度分析 取10批芪龙壮儿口服液(S1~S10),按“2.3.2”项下方法制备供试品溶液,按“2.1”和“2.2”项下色谱条件和质谱条件进样分析。使用Xcalibar 4.0软件将数据文件导出为“ txt”格式,采用2012版中药色谱指纹图谱相似度评价软件进行全谱峰匹配,采用多点校正模式,平均数法(时间窗0.1 min)生成指纹图谱。正离子模式指纹图谱见图1,确定共有峰24个;负离子模式指纹图谱见图2,确定共有峰17个。正离子模式下,S1~S10与对照指纹图谱的相似度分别为0.995、0.995、0.995、0.993、0.997、0.986、0.989、0.993、0.994、0.986。负离子模式下,S1~S10与对照指纹图谱的相似度分别为0.997、0.991、0.997、0.997、0.997、0.994、0.968、0.973、0.988、0.993。结果表明正、负离子两种检测模式下的10批样品相似度均大于0.960,表明不同批次的芪龙壮儿口服液之间具有良好的一致性,其投料药材质量及生产工艺比较稳定。
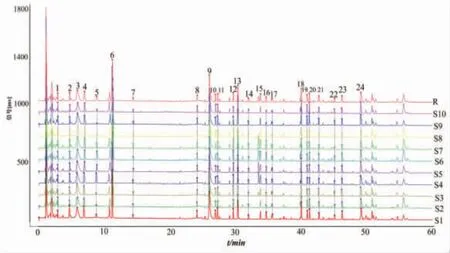
图1 10 批芪龙壮儿口服液正离子模式下的指纹图谱
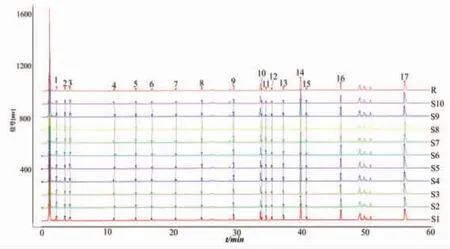
图2 10 批芪龙壮儿口服液负离子模式下的指纹图谱
2.5.2 指纹图谱中共有峰的归属 取供试品溶液、单味药材、空白溶剂,按照“2.1”和“2.2”项下色谱条件和质谱条件进样,记录质谱总离子流基峰图,比对色谱图中各峰,将主要色谱峰进行药材的归属。结果见表1~2。

表1 芪龙壮儿口服液在UHPLC-Q-Exactive Orbitrap MS 正离子模式下指纹图谱共有峰鉴定

表2 芪龙壮儿口服液在UHPLC-Q-Exactive Orbitrap MS 负离子模式下指纹图谱共有峰鉴定
2.5.3 指纹图谱中共有峰的鉴定 根据高分辨质谱一级、二级数据和参考文献,共鉴定了正离子模式下15个共有峰和负离子模式下的12个共有峰,结果见表1~2。其中正离子模式下有9个化合物采用对照品比对鉴定分别为腺苷(4号共有指纹峰)、鸟苷(5号共有指纹峰)、L-色氨酸(7号共有指纹峰)、毛蕊异黄酮苷(12号共有指纹峰)、芒柄花苷(17号共有指纹峰)、毛蕊异黄酮(18号共有指纹峰)、3-羟基-9,10-二甲氧基紫檀烷(21号共有指纹峰)、芒柄花素(23号共有指纹峰)、白术内酯Ⅲ(24号共有指纹峰);负离子模式下有9个化合物采用对照品比对鉴定分别为焦谷氨酸(1号共有指纹峰)、尿苷(2号共有指纹峰)、咖啡酸(7号共有指纹峰)、毛蕊异黄酮苷(9号共有指纹峰)、异毛蕊花糖苷(10号共有指纹峰)、党参炔苷(11号共有指纹峰)、芒柄花苷(12号共有指纹峰)、毛蕊异黄酮(14号共有指纹峰)、芒柄花素(16号共有指纹峰)。(见图3)共有峰的质谱鉴定过程以异毛蕊花糖苷为例进行说明。异毛蕊花糖苷在负离子模式下的准离子峰为(m/z)623.198 1[M-H]-,经Xcalibar 4.0软件拟合其分子式为C29H36O15,二级碎片离子有(m/z)461.167 1[M-H-C9H6O3]-和(m/z)161.024 4[M-H-C20H30O12]-,为咖啡酰键断裂产生,(m/z)461.167 1[M-H-C9H6O3]-进一步失去一分子鼠李糖产生碎片(m/z)315.107 9[M-H-C9H6O3-Rha]-,(m/z)161.024 4[M-H-C20H30O12]-失去一分子CO产生碎片离子(m/z)133.029 5[M-H-C20H30O12-CO]-。根据以上裂解途径,参考相关文献[5]并通过对照品比对确定负离子模式下的化合物10为异毛蕊花糖苷,其可能的质谱裂解途径见图4。
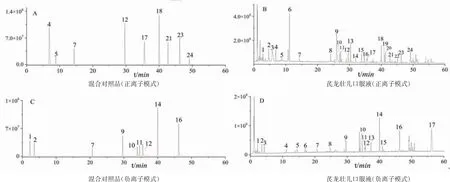
图3 混合对照品和芪龙壮儿口服液对照指纹图谱的总离子流基峰图
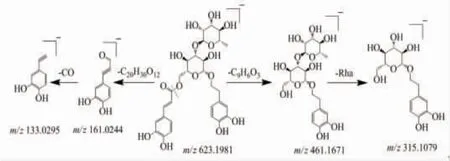
图4 异毛蕊花糖苷的质谱裂解途径
3 讨论
本试验分别考察了不同色谱柱[Thermo Accucore aQ RP18(2.1 mm×150 mm,2.6 μm)和Agilent Poroshell 120 ECC18(4.6 mm×150 mm,2.7 μm)]、不同流动相组合(甲醇、乙腈和水)及添加不同浓度的甲酸(0.1%和0.2%)对结果的影响。结果表明采用Thermo Accucore aQ RP18(2.1 mm×150 mm,2.6μm)色谱柱,以甲醇-0.1%甲酸水溶液作为流动相进行梯度洗脱,质谱响应值较高,色谱峰分离效果最佳、峰形最好。
正、负离子指纹图谱中均有数个峰未进行鉴定,如正离子指纹图谱中50 min以后的色谱峰和负离子指纹图谱中50 min前后的色谱峰。经比对这些色谱峰为辅料甜菊苷或者空白溶剂本来就有的峰,因此未纳入指纹图谱共有峰当中。
芪龙壮儿口服液含有阿胶、鹿角胶、龟甲胶等富含氨基酸的胶类药材。氨基酸类化合物在常规的HPLC-UV条件下直接检测不到色谱峰[17-19],且紫外检测器只能检测到含有紫外发光基团的化合物,具有一定局限性。质谱检测器属于通用型检测器,对氨基酸类等无紫外吸收的化合物均有较好的响应信号[20],因此本研究采用UHPLC-Q-Exactive Orbitrap MS技术建立了芪龙壮儿口服液正、负离子检测模式下的两种指纹图谱,信息量丰富、分离效果好,从正、负两个不同的维度较全面地反映了芪龙壮儿口服液的成分信息,且高分辨质谱可以直接利用其采集到的数据信息对化合物进行鉴定,对于建立科学、合理的芪龙壮儿口服液质量评价方法,提高其质量控制标准具有一定的参考意义。
