麝香酮调节cGAS-STING信号通路对缺血性脑卒中大鼠神经炎症的影响*
2024-04-22张文想
刚 瑛,丁 鹏,李 冰,张文想
(北京中医药大学东直门医院,北京 100700)
缺血性脑卒中(ischemic stroke,IS)是由血栓形成或栓塞引起的脑血流中断,是世界死亡和残疾的主要原因之一,严重影响人类健康[1]。IS的病理生理机制包括离子失衡、氧化应激、神经炎症和免疫细胞异常激活,可导致神经元坏死和凋亡。其中炎症反应是脑缺血组织损伤的基础,大脑中发生炎症后,小胶质细胞或其他免疫细胞活化导致促炎性细胞因子释放,促进白细胞浸润并进入脑组织,导致免疫系统激活,参与IS进展并对疾病产生严重影响[2]。因此,抑制炎症反应对于改善IS预后至关重要。麝香酮是中药麝香的主要成分,具有抗炎、抗氧化、抗凋亡、神经保护等作用。已有研究发现,麝香酮不仅具有促进IS后神经功能恢复的作用,还能减轻脊髓型颈椎病大鼠神经炎症和神经元损伤[3-4]。环鸟苷酸-腺苷酸合成酶(cyclic GMP-AMP synthase,cGAS)作为胞质DNA传感器,在识别单链和双链DNA后合成第二信使2'3'-cGAMP,结合并激活干扰素基因刺激蛋白(stimulator of interferon genes,STING)介导炎症反应和免疫失衡。cGAS可作为各种神经系统疾病的治疗靶点[5]。已有研究发现cGAS-STING通路的激活参与IS后神经炎症,因此抑制cGAS-STING通路可能有效缓解神经炎症相关损伤及相关神经病理学[6]。在IS大鼠体内麝香酮能否通过调节cGAS-STING信号通路改善神经损伤和炎症尚不清楚,因此本研究通过构建IS大鼠模型,对其进行探讨。
1 材料与方法
1.1 实验材料 SPF级SD雄性大鼠60只,购自北京华阜康生物科技股份有限公司,生产许可证号为SCXK(京)2019-0008,实验动物合格证号:SYXK(京)2020-0013。8周龄左右,体质量(250±20)g,适应性喂养1周,饲养环境温度22 ℃左右,湿度55%,12 h光暗循环,不禁水食。本研究通过我院动物伦理委员会批准(批号:2021-00915)。
1.2 药品与试剂 麝香酮(纯度≥98%,批号:541-91-3)购自上海麦克林生化科技有限公司;cGAS抑制剂RU.521(批号:HY-114180)、STING激动剂2′3′-cGAMP(批号:HY-100564)购自美国MedChemExpress公司;白细胞介素(IL)-1β酶联免疫吸附(ELISA)试剂盒(批号:EK-R36877)购自上海酶研生物科技公司;肿瘤坏死因子-α(TNF-α)ELISA试剂盒(批号:ml002953)、IL-6 ELISA试剂盒(批号:ml064292)购自上海酶联生物公司;苏木素伊红(HE)染色试剂盒(批号:60524ES60)购自上海翌圣生物公司;TTC染色液(批号:SBJ-0485)购自南京森贝伽生物科技有限公司;Nissl染色液(批号:R20625)购自上海源叶生物公司;TUNEL试剂盒(批号:E-CK-A320)购自武汉伊莱瑞特生物科技股份有限;一抗p-IRF3(批号:ab76493)、IRF3(批号:ab238521)、二抗辣根酶标记山羊抗兔(批号:ab205719)购自美国Abcam公司;一抗IL-1β(批号:AB2915846)、TNF-α(批号:AB2204371)、cGAS(批号:AB2915749)、STING(批号:AB11153185)和β-actin抗体(批号:AB2792414)购自美国赛默飞世尔公司;RIPA裂解液(批号:SY4680)购自北京伊塔生物科技有限公司;ECL发光试剂盒(批号:abs920)购自上海爱必信生物科技有限公司。
1.3 主要仪器 SpectraMax i3x多功能动酶标仪(上海美谷分子仪器有限公司);CX41-12C02光学显微镜(日本OLYMPUS公司);Phenom电子显微镜(上海复纳科学仪器有限公司);HT165R离心机(湘仪离心机仪器有限公司);HY2508石蜡切片机(金华惠友仪器设备有限公司)。
1.4 IS大鼠模型构建 随机选取50只大鼠,采用大脑中动脉闭塞(MCAO)法构建IS大鼠模型[7],麻醉大鼠并保持每只大鼠直肠温度在(36.5±0.5)℃,暴露大鼠右侧颈总动脉结构至分叉处,用6.0 mm丝线结扎颈外动脉远心端,另一丝线穿过颈外动脉并在颈总动脉分叉处附近打结,使用动脉夹夹闭颈总动脉,将尼龙线插入颈外动脉、颈内动脉并继续进入大脑中动脉,缺血1 h后,去除线栓,缝合颈部伤口。对照组大鼠10只暴露颈总动脉结构至分叉处,后缝合伤口,不进行其他操作。对各组大鼠进行Longa神经功能评分,评分>1分表明MCAO模型构建成功。
1.5 大鼠分组和药物干预 将SD大鼠分为对照组、MCAO组、MCAO+RU.521组、麝香酮组、麝香酮+2′3′-cGAMP组,除去死亡和建模失败的大鼠,每组10只。MCAO后24 h,MCAO+RU.521组大鼠鼻内给药RU.521(450 μg/kg)溶解于1%二甲基亚石风(DMSO)+玉米油[8],麝香酮组大鼠鼻内给药麝香酮(5 mg/kg)溶解于1% DMSO[3],麝香酮+2′3′-cGAMP组大鼠鼻内给药麝香酮(5 mg/kg)和2′3′-cGAMP(500 μg/kg)溶解于1%DMSO中[8],对照组和MCAO组大鼠给予相同剂量生理盐水。1次/d,连续给药7 d。
1.6 观察指标
1.6.1 神经功能缺损评分 给药结束后,对大鼠进行神经功能评分:0分,无神经功能缺损;1分,对侧前肢无法伸展;2分,对侧前肢严重屈曲;3分,走路时向对侧倾斜;4分,没有自主活动,意识障碍。评分范围1~4分,分值越高表明神经缺损越严重。
1.6.2 TTC染色检测脑梗死面积 神经功能缺损评分后麻醉处死大鼠,取5只大鼠脑组织-20 ℃下冷冻,将脑冠状面切片(约2 mm)在2% TTC溶液中染色30 min,翻转数次,PBS冲洗,4%多聚甲醛固定2 h,拍照并计算相对脑梗死面积=梗死面积/总面积×100%。
1.6.3 HE染色和Nissl染色观察 取剩余5只大鼠海马组织,固定于4%多聚甲醛中,石蜡包埋,切片(5 μm)后用HE染色、Nissl染色,在光学显微镜下观察大鼠海马组织的病理变化和神经元损伤。
1.6.4 TUNEL法检测神经元凋亡 取大鼠海马组织石蜡切片,按照TUNEL试剂盒说明书染色,4 ℃孵育过夜,洗涤后与荧光二抗在37 ℃下孵育1 h,并用DAPI进行核染,在显微镜下观察拍照。
1.6.5 ELISA法检测炎症因子水平 取大鼠海马组织,剪切、研磨,离心取上清,按照ELISA试剂盒说明书,检测炎证因子IL-1β、IL-6、TNF-α水平。
1.6.6 Western blotting法检测蛋白表达 取大鼠海马组织,用RIPA裂解,提取总蛋白,定量后按步骤进行SDS-PAGE电泳、转膜,5%脱脂奶粉封闭2 h,在4 ℃下加入一抗IL-1β、TNF-α、cGAS、STING、p-IRF3、IRF3(1:1 000)和内参β-actin过夜孵育,清洗,在4 ℃下加入二抗山羊抗兔IgG(1:2 000),孵育2 h。用ECL发光显影,观察拍照,各条带灰度值用Image J软件处理分析。
1.7 统计学方法 应用GraphPad Prism 8.0软件进行统计分析,数据采用(±s)表示,多组间比较用单因素方差分析,两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损评分比较 与对照组比较,MCAO组大鼠神经功能缺损评分升高(P<0.05);与MCAO组比较,MCAO+RU.521组、麝香酮组大鼠神经功能缺损评分降低(P<0.05);MCAO+RU.521组大鼠神经功能缺损评分与麝香酮组比较,差异无统计学意义(P>0.05);与麝香酮组比较,麝香酮+2′3′-cGAMP组大鼠神经功能缺损评分升高(P<0.05)。(见图1)

图1 各组大鼠神经功能缺损评分比较 (±s,n=10)
2.2 各组大鼠TTC染色脑梗死面积比较 与对照组比较,MCAO组大鼠脑梗死面积显著升高(P<0.05);与MCAO组比较,MCAO+RU.521组、麝香酮组大鼠脑梗死面积显著降低(P<0.05);MCAO+RU.521组大鼠脑梗死面积与麝香酮组比较,差异无统计学意义(P>0.05);与麝香酮组比较,麝香酮+2′3′-cGAMP组大鼠脑梗死面积显著升高(P<0.05)。(见图2~3)
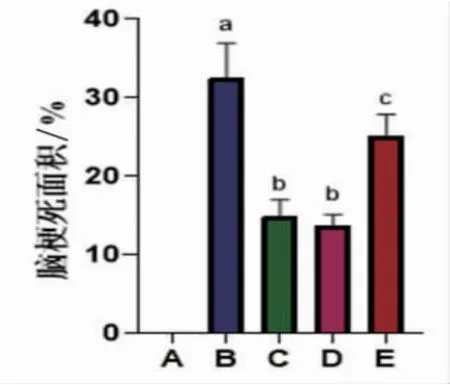
图2 大鼠TTC 染色脑梗死面积比较 (±s,n=5)

图3 各组大鼠脑组织TTC 染色结果
2.3 各组大鼠HE染色和Nissl染色结果比较 HE染色显示,对照组大鼠海马组织神经元形态结构正常,细胞排列紧密,细胞核仁清晰且胞质丰富;MCAO组大鼠海马组织神经元细胞皱缩,细胞排列松散且肿胀;与MCAO组比较,MCAO+RU.521组、麝香酮组大鼠海马组织神经元病理损伤减轻,形态有所恢复,细胞变异程度减轻;与麝香酮组比较,麝香酮+2′3′-cGAMP组大鼠海马组织神经元病理损伤加重。Nissl染色显示,对照组大鼠海马神经细胞形态结构正常,Nissl体丰富;MCAO组大鼠海马神经元细胞萎缩,核质固缩,Nissl体显著减少;MCAO+RU.521组、麝香酮组大鼠海马组织神经元细胞形态有所恢复,Nissl体增加;麝香酮+2′3′-cGAMP组大鼠海马组织神经元细胞损伤程度较麝香酮组加重。(见图4)

图4 大鼠海马组织HE 染色和Nissl 染色结果 (×400)
2.4 各组大鼠神经元细胞凋亡情况比较 与对照组比较,MCAO组海马组织神经元凋亡数目增加,凋亡率显著升高(P<0.05);与MCAO组比较,MCAO+RU.521组、麝香酮组神经元凋亡数目减少,凋亡率显著降低(P<0.05);MCAO+RU.521组神经元凋亡数目和凋亡率与麝香酮组比较,差异无统计学意义(P>0.05);与麝香酮组比较,麝香酮+2′3′-cGAMP组神经元凋亡数目增加,凋亡率显著升高(P<0.05)。(见图5~6)
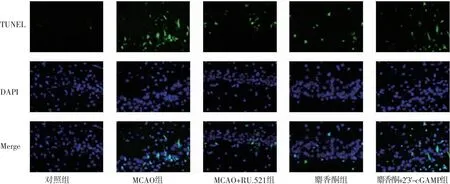
图5 大鼠海马组织TUNEL 染色结果 (×400)
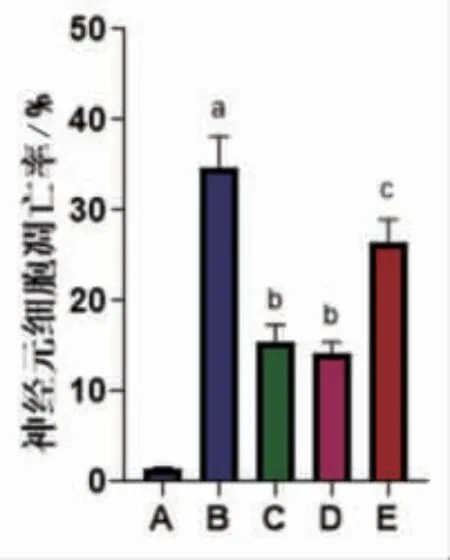
图6 各组大鼠神经元凋亡率比较 (±s,n=10)
2.5 各组大鼠炎症因子水平比较 与对照组比较,MCAO组大鼠海马组织IL-6、IL-1β、TNF-α水平显著升高(P<0.05);与MCAO组比较,MCAO+RU.521组、麝香酮组大鼠IL-6、IL-1β、TNF-α水平显著降低(P<0.05);MCAO+RU.521组大鼠IL-6、IL-1β、TNF-α水平与麝香酮组比较,差异无统计学意义(P>0.05);与麝香酮组比较,麝香酮+2′3′-cGAMP组大鼠IL-6、IL-1β、TNF-α水平显著升高(P<0.05)。(见图7)
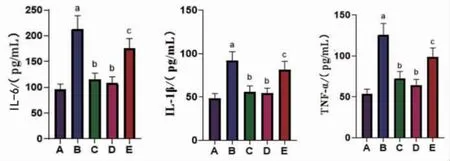
图7 各组大鼠炎症因子水平比较 (±s,n=10)
2.6 各组大鼠海马组织蛋白表达比较 与对照组比较,MCAO组大鼠海马组织IL-1β、TNF-α、cGAS、STING、p-IRF3蛋白相对表达量显著升高(P<0.05);与MCAO组比较,MCAO+RU.521组、麝香酮组大鼠IL-1β、TNF-α、cGAS、STING、p-IRF3蛋白相对表达量显著降低(P<0.05);MCAO+RU.521组大鼠各蛋白相对表达量与麝香酮组比较,差异无统计学意义(P>0.05);与麝香酮组比较,麝香酮+2′3′-cGAMP组大鼠IL-1β、TNF-α、cGAS、STING、p-IRF3蛋白相对表达量显著升高(P<0.05)。(见图8~9)

图8 大鼠海马组织蛋白表达Western blotting 图

图9 各组大鼠海马组织蛋白相对表达量比较 (±s,n=5)
3 讨论
IS是一种常见的脑血管疾病,主要是由大脑血管突然阻塞,从而限制相关区域的血液流动或供应引起的,其中中风会增加认知缺陷、长期残疾、抑郁和痴呆的风险,严重影响人类健康状况和生活质量[9]。目前IS的主要临床治疗措施是溶栓、血栓切除术、抗血小板聚集和神经营养等,以尽快恢复缺血区的脑血流和神经功能,但这些疗法的使用受时间窗口和出血风险的限制。神经炎症是IS的主要病理过程。IS导致神经元细胞死亡,使小胶质细胞和星形胶质细胞过度活化,释放出高水平的炎症因子如IL-6、IL-1β和TNF-α,并促进白细胞进入脑组织,产生炎症级联反应,促进更多神经元死亡并加重脑损伤[10]。HAN B等[11]发现小胶质细胞PGC-1α通过抑制神经炎症来防止IS后脑损伤;ZHANG Y等[12]也发现SerpinA3N通过减少细胞凋亡和神经炎症可减轻IS后脑损伤。因此,在IS后抑制炎症反应可缓解脑损伤。
本研究通过使用MCAO法构建IS大鼠模型发现,MCAO组大鼠神经功能缺损评分和脑梗死面积显著升高,海马组织神经元细胞皱缩损伤,Nissl体减少,且神经元凋亡数目增加,表明MCAO组大鼠出现严重神经功能损伤。且海马组织IL-6、IL-1β、TNF-α含量显著升高,表明MCAO组大鼠出现神经炎症。麝香酮在脑血管疾病中具有神经保护作用,包括抗氧化应激、抗缺血性损伤、抗凋亡、抗炎和触发神经保护等。其中麝香酮通过作为神经保护和促血管生成剂起到对急性脑缺血再灌注损伤的保护作用[13];麝香酮还能通过减少神经元坏死,保护血脑屏障,改善脑缺血引起的神经损伤[14]。本研究通过选用麝香酮鼻内给药的方式对MCAO组大鼠进行治疗。鼻内给药使麝香酮能直接通过鼻黏膜或肺部的毛细血管吸收,通过鼻黏膜-脑脊液途径直接进入脑脊液,绕过血脑屏障直接递送到脑。麝香酮鼻腔给药具有生物利用度高、见效快、安全、有效等特点[15]。本研究发现,MCAO组大鼠经麝香酮治疗后,神经功能缺损评分和脑梗死面积降低,海马组织神经元损伤得到改善,Nissl体增加,且神经元凋亡数目和IL-6、IL-1β、TNF-α含量减少,表明麝香酮对MCAO组大鼠神经元功能障碍和神经炎症具有改善作用。
胞质dsDNA已被证明可激活炎症和免疫反应。cGAS是一种关键的胞质DNA传感器,可通过合成cGAMP激活STING,触发由STING级联介导的下游促炎信号,同时炎症因子可激活IRF3、NF-κB等途径,因此cGAS-STING通路的激活被认为与神经病理生理学密切相关[16]。已有研究发现cGAS-STING参与创伤性脑损伤[17]、肌萎缩侧索硬化症[18]、阿尔茨海默病[19]等多种动物模型中的神经炎症。cGAS-STING也与IS后的脑损伤和神经炎症密切相关。抑制cGAS或cGAS缺失均会减弱IS后的神经炎症,改善脑损伤[20-21]。本研究发现,MCAO组大鼠海马组织cGAS、STING、p-IRF3蛋白表达显著升高,表明IS可能激活cGAS-STING信号通路,参与其脑损伤和神经炎症;而麝香酮治疗后cGAS、STING、p-IRF3蛋白表达降低,麝香酮可能通过抑制cGAS-STING信号通路的激活,改善MCAO组大鼠脑损伤和神经炎症。为进一步验证麝香酮对cGAS-STING信号通路的干预作用,本研究在MCAO的基础上加上cGAS抑制剂RU.521,其作用与麝香酮对神经损伤的改善作用一致,表明麝香酮可能发挥cGAS抑制剂的作用;此外,本研究在麝香酮基础上加上STING激动剂2′3′-cGAMP,麝香酮对神经损伤的改善作用受到抑制,因此麝香酮可能抑制cGAS-STING信号通路激活发挥作用。
综上所述,麝香酮可能通过抑制cGAS-STING信号通路激活,减少神经元损伤,改善IS大鼠神经炎症。本研究为改善IS大鼠神经损伤和神经炎症提供了新思路,但麝香酮对IS大鼠的其他分子机制仍有待阐明。
