枳术颗粒对功能性消化不良大鼠胃动力的改善作用
2024-04-22高仁浩赵开军王海丽
高仁浩,陈 欢,赵开军,王海丽,成 俊,黄 芳*
枳术颗粒对功能性消化不良大鼠胃动力的改善作用
高仁浩1,陈 欢1,赵开军2, 3,王海丽2, 3,成 俊2,黄 芳1*
1. 中国药科大学中药学院,江苏 南京 211198 2. 南京中山制药有限公司 江苏省中药经典名方工程技术研究中心,江苏 南京 210046 3. 江苏弘典中药产业研究院有限公司 南京市临床经验方现代化工程研究中心,江苏 南京 210023
研究枳术颗粒对功能性消化不良(functional dyspepsia,FD)大鼠的药效及作用机制。复合因素造模法诱导大鼠FD模型,造模成功后给予枳术颗粒治疗2周,观察枳术颗粒对FD大鼠胃残留率、小肠推进率、血清中胃泌素(gastrin,GAS)、胃饥饿素(growth hormone releasing peptide,Ghrelin)、降钙素基因相关肽(calcitonin gene related peptide,CGRP)及生长抑素(somatostatin,SS)含量的影响;苏木素-伊红(hematoxylin-eosin,HE)染色法观察胃窦组织、十二指肠组织病理变化;利用qRT-PCR检测下丘脑及胃组织中、、、mRNA表达和胃及十二指肠组织中肾上腺素能受体β1(β1-adrenergic receptor,)、生长抑素受体(somatostatin receptor,)、胃饥饿素--乙酰转移酶(ghrelin--acyltransferase,)、胃饥饿素受体(growth hormone secreting hormone receptor,)、酪氨酸激酶受体(c-kit protooncogene protein,)、干细胞因子(stem cell factor,)、钙激活氯离子通道蛋白Anoctamin-1()、肌球蛋白轻链激酶(myosin light chain kinase,)mRNA表达;利用Western blotting检测胃及十二指肠组织中C-kit、SCF蛋白表达。枳术颗粒可以显著降低FD大鼠胃残留率(<0.05),提高小肠推进率(<0.01);升高血清中Ghrelin、GAS含量(<0.01),降低CGRP、SS含量(<0.05、0.01);升高下丘脑及胃窦组织中、mRNA表达水平(<0.05、0.01),降低下丘脑及胃窦组织中、mRNA表达水平(<0.01);显著升高胃及十二指肠组织SCF、C-kit蛋白表达水平(<0.05、0.01),升高胃及十二指肠组织、、、、、、mRNA表达水平(<0.05、0.01),降低mRNA表达水平(<0.05、0.01)。枳术颗粒可以改善FD大鼠的胃动力异常,其作用机制可能与调节脑肠肽水平、激活SCF/C-kit通路有关。
枳术颗粒;功能性消化不良;脑肠肽;Cajal间质细胞;胃饥饿素
功能性消化不良(functional dyspepsia,FD)是最常见的功能性胃肠道疾病之一,发病部位主要在胃十二指肠区域,症状包括上腹部疼痛或灼烧感,餐后饱胀感、早饱等,且通常无器质性病变[1]。FD的发病机制尚未完全阐明,一般认为FD的发生是由于肠道和大脑之间的交流障碍而导致的胃肠道运动障碍,并多伴随内脏高敏反应,胃肠道微生物群、免疫功能以及中枢神经系统功能的失调[2]。目前西医在药物治疗上常根据个体症状选用促胃动力药、抑酸剂和中枢调节剂等[3],但在临床上反应出药物疗效不显著,且患者症状易复发的现象。
中医将FD归属于“胃痞”“胃脘痛”范畴,认为FD病位在胃腑,与肝、脾密切相关,肝气郁结,侮脾犯胃促使机体中焦气机升降失调,进而导致FD发病与复发[4]。大量临床试验研究表明,中医对FD的治疗有着疗效显著且预后良好的优势[5-7]。枳术颗粒由枳术丸原方基础上改良剂型制成,有健脾消食、行气化湿、消积散癖之功效,多适用于脾胃虚弱、食少不化、脘腹胀满等病症,临床上枳术颗粒对FD、消化性溃疡和慢性萎缩性胃炎具有良好的治疗效果[8],但其潜在的作用机制还有待进一步的探讨。近年来的研究表明,中医药可通过改善Cajal间质细胞(interstitial cell of Cajal,ICC)数量缺失及结构紊乱,调节脑肠肽的含量及表达发挥促胃肠运动的作用[9]。因此,本研究通过碘乙酰胺ig法、改良郭氏夹尾刺激联合不规则饮食法构建FD大鼠模型,从脑肠肽和ICC 2个角度研究枳术颗粒对FD大鼠的治疗作用机制。
1 材料
1.1 动物
SPF级6日龄SD乳鼠50只,体质量8~12 g,母鼠5只,用于提供母乳喂养乳鼠,购自济南朋悦实验动物繁育有限公司,许可证号SCXK(鲁)2022 0006。动物饲养于中国药科大学药学动物实验中心,温度18~22 ℃,相对湿度55%~65%,自由进食饮水。动物实验经中国药科大学伦理委员会批准(批准号2022-09-029)。
1.2 药品与试剂
枳术颗粒(批号220201)由南京中山制药有限公司提供;多潘立酮(批号MCJ7073)购自西安杨森制药有限公司;碘乙酰胺(批号H2114239)购自上海阿拉丁生化科技股份有限公司;大鼠胃饥饿素(growth hormone releasing peptide,Ghrelin)ELISA试剂盒(批号F21284-A)、大鼠胃泌素(gastrin,GAS)ELISA试剂盒(批号F8501-A)、大鼠生长抑素(somatostatin,SS)ELISA试剂盒(批号F3369-A)、大鼠降钙素基因相关肽(calcitonin gene related peptide,CGRP)ELISA试剂盒(批号F3366-A)均购自上海泛柯检测技术有限公司;HiScript II QRT SuperMix for qPCR(批号R223-01)、Taq Pro Universal SYBR qPCR Master Mix(批号Q712-02)、VeZol Reagent(批号R411-01)均购自南京诺唯赞生物科技股份有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号60004-1-Ig)、酪氨酸激酶受体(c-kit protooncogene protein,C-kit)抗体(批号18696-1-AP)、干细胞因子(stem cell factor,SCF)抗体(批号26582-1-AP)均购自武汉三鹰生物技术有限公司。
1.3 仪器
5415R型高速冷冻离心机(德国Eppendorf公司);PB303-N型电子天平(德国Mettler Toledo公司);MULTSKAN Sky全波长酶标仪、可调式移液器(美国Thermo Fisher Scientific公司);电泳仪、转膜仪、CFX96型逆转录仪、实时荧光定量PCR仪(美国Bio-Rad公司);显影仪(上海天能科技有限公司);Direct-Q3实验室纯水/超纯水一体化系统(美国Millipore公司)。
2 方法
2.1 分组、造模与给药
动物适应性喂养后,将10日龄SD乳鼠随机分为对照组(10只)和造模组(40只),对照组ig 2%蔗糖溶液(0.2 mL/只),模型组ig 0.1%碘乙酰胺蔗糖溶液(0.2 mL/只),1次/d,连续6 d,造模期间交由母鼠正常哺乳喂养。正常饲养至大鼠3周龄断奶,分笼。至大鼠7周龄,对造模组大鼠进行改良郭氏夹尾法和不规则喂养造模。夹尾应激法每日实施2次,时间分别为每日9: 00、15: 00时,每次持续30 min,夹尾前使用自制棉布包裹塑料夹,在靠近大鼠尾端的三等分点处放置塑料夹进行夹尾刺激,激怒大鼠与笼内其他大鼠打斗。若打斗过程中出现伤口,则用0.5%碘伏进行处理,造模时间为14 d,期间对造模组大鼠实施单日禁食不禁水,双日给予足量食物及饮水的不规则饮食刺激。对照组大鼠则按照常规方式饲养,每日予以足量饮食饮水。
造模后将大鼠随机分为模型组及枳术颗粒低、高剂量(1.75、7.00 g/kg)组和多潘立酮(3 mg/kg)组,每组10只。各给药组ig相应药物(10 mL/kg),对照组及模型组ig等体积的单蒸水,1次/d,连续给药2周。
2.2 大鼠体质量及一般状态观察
改良郭氏夹尾法和不规则喂养造模及给药期间每隔1天测定并记录大鼠体质量,观察记录大鼠的一般状态。
2.3 样本采集
末次给药后,大鼠更换垫料,禁食不禁水16 h。取10 g羧甲基纤维素钠溶于250 mL蒸馏水中,分别加入16 g奶粉、8 g糖、8 g淀粉和2 g活性炭粉,搅拌均匀制成炭墨营养半固体糊[10]。每只大鼠ig半固体糊3 mL,30 min后用巴比妥钠麻醉大鼠,腹主动脉取血处死大鼠。全血室温静置30 min后,3 000 r/min离心15 min,取上清,储存于−80 ℃冰箱。取大鼠下丘脑放入液氮快速冷冻后−80 ℃冰箱保存。结扎贲门和幽门,分离全胃,用滤纸拭干后称定胃全质量。之后沿胃大弯剪开胃体,用生理盐水洗去内容物后拭干称定胃净质量。收集小肠,测定半固体糊状物的推进距离和小肠全长。量取后每组剪取大鼠少部分胃窦组织及近幽门十二指肠置于4%多聚甲醛中固定,其余胃窦及十二指肠放入液氮快速冷冻后−80 ℃冰箱保存。
2.4 胃残留率与小肠推进率的检测
根据公式计算胃残留率及小肠推进率。
胃残留率=(胃全质量-胃净质量)/灌胃量
小肠推进率=固体糊推进距离/小肠全长
2.5 ELISA法检测大鼠血清脑肠肽含量
按照试剂盒说明书分别检测大鼠血清中GAS、Ghrelin、CGRP、SS的含量。
2.6 苏木素-伊红(hematoxylin-eosin,HE)染色观察胃窦及十二指肠组织病理变化
将固定在4%多聚甲醛溶液中的胃窦及十二指肠组织按照常规HE染色法进行脱水、包埋、切片、染色,中性树胶封片后置于倒置显微镜下观察组织病理变化并拍照。
2.7 qRT-PCR检测胃窦及下丘脑组织中GAS、Ghrelin、CGRP、SS、肾上腺素能受体β1(β1-adrenergic receptor,ADRB1)、生长抑素受体(somatostatin receptor,SSTR)、胃饥饿素-O-乙酰转移酶(ghrelin-O-acyltransferase,GOAT)、胃饥饿素受体(growth hormone secreting hormone receptor,GHSR)、C-kit、SCF、钙激活氯离子通道蛋白Anoctamin-1(ANO1)和肌球蛋白轻链激酶(myosin light chain kinase,MLCK)mRNA表达
取出−80 ℃保存的胃窦及下丘脑组织,按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析。引物由南京擎科生物科技有限公司合成,引物序列见表1。
2.8 Western blotting检测胃窦及十二指肠组织C-kit、SCF蛋白表达
分别称取适量胃窦及十二指肠组织,剪碎并按照1∶10的比例加入RIPA强裂解液(含0.01%蛋白酶抑制剂),匀浆后静置30 min,待充分裂解后于4 ℃、12 000 r/min离心15 min,收集上清液。BCA法测定蛋白浓度,随后加入Loading Buffer,沸水浴15 min使蛋白变性。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶,室温封闭2 h,分别加入一抗,4 ℃孵育过夜;次日TBST漂洗,加入二抗孵育,ECL显影,采用Image J软件分析目的蛋白条带灰度值。

表1 引物序列
2.9 统计学分析

3 结果
3.1 枳术颗粒对FD大鼠一般状况的影响
与对照组比较,模型组大鼠活动减少,反应迟钝,毛发枯燥,粪便稀软;与模型组比较,各给药组大鼠活动量增加,反应相对较快,毛发润泽度有所改善,粪便正常。如图1所示,对照组大鼠体质量正常升高,而造模大鼠体质量增长速度明显低于对照组(<0.01);与模型组比较,枳术颗粒治疗后大鼠体质量略有升高,但无显著性差异。

与对照组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01,图2同。
3.2 枳术颗粒对FD大鼠胃残留率和小肠推进率的影响
如图2所示,与对照组比较,模型组大鼠胃残留率显著升高(<0.01),小肠推进率显著降低(<0.01);与模型组比较,各给药组大鼠胃残留率显著降低(<0.05、0.01),小肠推进率显著升高(<0.01)。表明枳术颗粒可以有效促进胃排空及小肠蠕动,改善FD大鼠的胃肠动力。

图2 枳术颗粒对FD大鼠胃动力的影响(, n = 8~10)
3.3 枳术颗粒对FD大鼠血清中脑肠肽含量的影响
如表2所示,与对照组比较,模型组大鼠血清中Ghrelin和GAS含量均显著降低(<0.01),CGRP和SS含量均显著升高(<0.05、0.01);与模型组比较,各给药组Ghrelin和GAS含量显著升高(<0.01),CGRP和SS含量显著降低(<0.05、0.01)。表明枳术颗粒可以调节大鼠血清中脑肠肽的含量,从而调节大鼠脑肠之间的交流。

表2 枳术颗粒对FD大鼠血清中Ghrelin、GAS、CGRP和SS水平的影响(, n = 8)
与对照组比较:P<0.05P<0.01;与模型组比较:P<0.05P<0.01,下表同。
< 0.05P< 0.01control group;P< 0.05P< 0.01model group, same as below tables.
3.4 枳术颗粒对FD大鼠胃窦及十二指肠组织病理变化的影响
如图3所示,对照组和各给药组大鼠胃窦组织结构和形态均完整,黏膜层、黏膜下层、肌层及浆膜层4层层次清楚;模型组黏膜层排列疏松,可见极少量炎症细胞散在。对照组大鼠十二指肠组织绒毛及腺体结构完整正常;各给药组大鼠十二指肠组织少部分绒毛表面黏膜上皮脱落,腺体结构完整正常;模型组大鼠十二指肠部分区域绒毛长度缩短,黏膜上皮扭曲呈锯齿状。结果显示,各组大鼠胃窦和十二指肠组织结构无器质性病变,符合FD造模标准。
3.5 枳术颗粒对FD大鼠下丘脑及胃窦组织中Ghrelin、GAS、CGRP和SS mRNA表达的影响
如表3所示,与对照组比较,模型组大鼠下丘脑组织中、mRNA表达水平显著降低(<0.01),、mRNA表达水平显著升高(<0.01);与模型组比较,枳术颗粒各剂量组和mRNA表达水平显著升高(<0.05、0.01),mRNA表达水平显著降低(<0.01);枳术颗粒高剂量组mRNA表达水平显著降低(<0.01);多潘立酮组mRNA表达水平显著升高(<0.01),、mRNA表达水平显著降低(<0.01)。
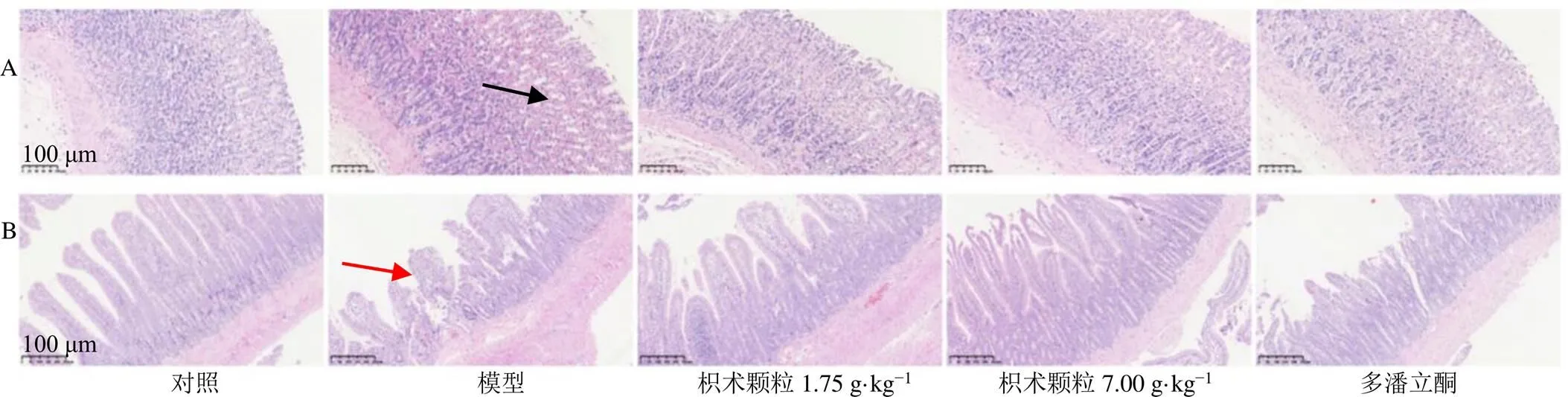
黑色箭头表示黏膜层排列疏松,红色箭头表示绒毛缩短。

表3 枳术颗粒对FD大鼠下丘脑组织中Ghrelin、GAS、CGRP和SS mRNA表达的影响(, n = 6)
如表4所示,与对照组比较,模型组大鼠胃窦组织、mRNA表达水平显著降低(<0.01),、mRNA表达水平显著升高(<0.01);与模型组比较,各给药组mRNA表达水平显著升高(<0.05、0.01),mRNA表达水平显著降低(<0.05、0.01);枳术颗粒高剂量组和多潘立酮组mRNA表达水平显著降低(<0.01),mRNA表达水平显著降低(<0.01)。表明枳术颗粒可以调节FD大鼠下丘脑及胃窦组织中脑肠肽基因的表达,提示枳术颗粒可能通过改善脑肠之间的交流障碍以增强大鼠胃肠道动力。
3.6 枳术颗粒对FD大鼠胃窦及十二指肠组织中ADRB1、SSTR、GOAT和GHSR mRNA表达的影响
如表5所示,与对照组比较,模型组大鼠胃窦组织中、、mRNA表达水平显著降低(<0.01),mRNA表达水平显著升高(<0.01);与模型组比较,枳术颗粒低剂量组mRNA表达水平显著升高(<0.05);枳术颗粒各剂量组、mRNA表达水平显著升高(<0.05、0.01),mRNA表达水平显著降低(<0.05、0.01);多潘立酮组mRNA表达水平显著升高(<0.05)。
如表6所示,与对照组比较,模型组大鼠十二指肠中、、mRNA表达水平显著降低(<0.01),mRNA表达水平显著升高(<0.01);与模型组比较,各给药组、mRNA表达水平显著升高(<0.05、0.01),mRNA表达水平显著降低(<0.05、0.01);枳术颗粒低剂量组mRNA表达水平显著升高(<0.01)。表明枳术颗粒可以促进胃及十二指肠中Ghrelin的产生和作用,进而刺激ICC产生慢波,以增强大鼠胃肠动力。

表4 枳术颗粒对FD大鼠胃窦组织中Ghrelin、GAS、CGRP和SS mRNA表达的影响(, n = 6)

表5 枳术颗粒对FD大鼠胃窦组织中ADRB1、SSTR、GOAT和GHSR mRNA表达的影响(, n = 6)

表6 枳术颗粒对FD大鼠十二指肠组织中ADRB1、SSTR、GOAT和GHSR mRNA表达的影响(, n = 6)
3.7 枳术颗粒对FD大鼠胃窦和十二指肠组织中C-kit及SCF蛋白表达的影响
如图4和表7所示,模型组大鼠胃窦和十二指肠组织中SCF、C-kit蛋白表达水平均显著降低(<0.01);与模型组比较,各给药组胃窦组织中SCF、C-kit蛋白表达水平均显著升高(<0.05、0.01);枳术颗粒各剂量组十二指肠组织中C-kit蛋白表达水平均显著升高(<0.05),枳术颗粒高剂量组和多潘立酮组十二指肠组织中SCF蛋白表达水平均显著升高(<0.01)。表明枳术颗粒可以促进FD大鼠胃及十二指肠中ICC的增殖分化以增强大鼠胃肠动力。
3.8 枳术颗粒对FD大鼠胃窦及十二指肠组织中C-kit、SCF、ANO1和MLCK mRNA表达的影响
如表8所示,与对照组比较,模型组大鼠胃窦组织中、、、mRNA表达水平显著降低(<0.05、0.01);与模型组比较,枳术颗粒各剂量组、、、mRNA表达水平均显著升高(<0.05、0.01),多潘立酮组、、mRNA表达水平显著升高(<0.05)。
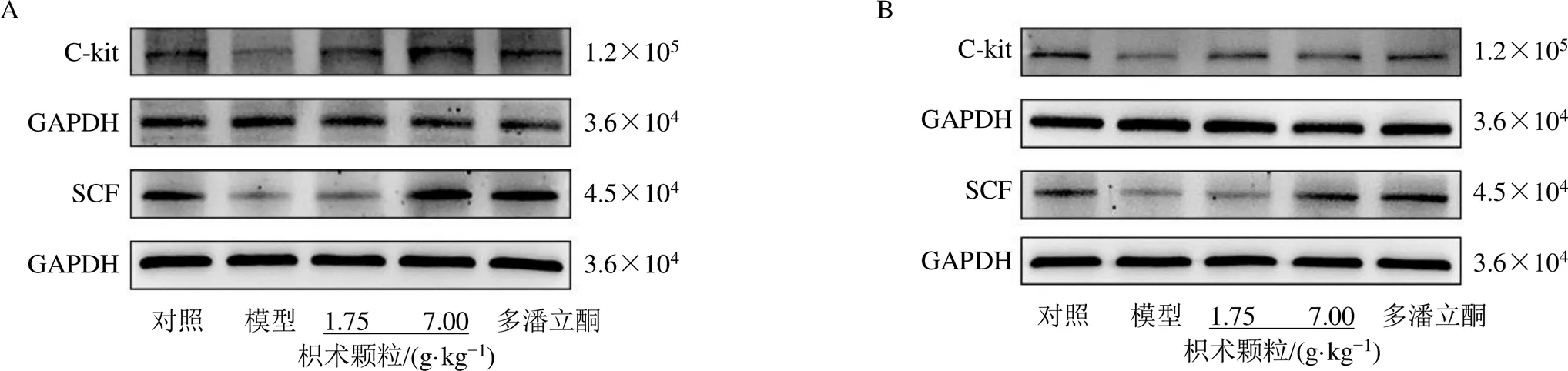
图4 枳术颗粒对FD大鼠胃窦(A) 和十二指肠组织(B) 中SCF、C-kit蛋白表达的影响

表7 枳术颗粒对FD大鼠胃窦和十二指肠组织中SCF、C-kit蛋白表达的影响(, n = 3)

表8 枳术颗粒对FD大鼠胃窦组织中C-kit、SCF、ANO1和MLCK mRNA表达的影响(, n =6)
如表9所示,与对照组比较,模型组大鼠十二指肠中、、、mRNA表达水平显著降低(<0.01);与模型组比较,枳术颗粒各组、、mRNA表达水平显著升高(<0.05、0.01),枳术颗粒高剂量组mRNA表达水平显著升高(<0.05),多潘立酮组mRNA表达水平显著升高(<0.05)。表明枳术颗粒可能通过改善ICC的功能受损以治疗FD大鼠胃肠运动延迟。

表9 枳术颗粒对FD大鼠十二指肠组织中C-kit、SCF、ANO1和MLCK mRNA表达的影响(, n =6)
4 讨论
FD的发病机制复杂,目前普遍认为胃肠动力障碍及内脏高敏感性是FD发生的主要病理机制。近年来,有关FD动物模型的造模方法也逐渐成熟,临床上FD多见肝郁脾虚证型,该证型的动物模型构建方法各异,但普遍认为多因素叠加刺激的造模方法能更好地模拟FD复杂的发病过程[11]。研究发现,碘乙酰胺ig法可轻度刺激新生儿时期大鼠的胃肠道,导致大鼠成年期的慢性胃过敏和运动紊乱[12],该方法联合夹尾刺激法能模拟FD大鼠内脏高敏感、胃顺应性降低、胃排空延迟症状[13]。夹尾刺激法和不规则喂食法双因素刺激可导致大鼠出现饮食不佳、大便糖稀、暴躁易怒等症状,常用于构建中医学中的肝郁脾虚证模型[14]。因此,本研究采用碘乙酰胺ig乳鼠,正常饲喂到大鼠成年再采用改良夹尾刺激法和饮食不节法继续造模,以复制大鼠FD模型。结果显示,与对照组比较,造模后大鼠精神萎靡,倦怠,毛发干枯呈暗黄色,大便稀溏呈黄绿色,活动减少,反应迟钝且烦躁易怒。通过观察大鼠胃残留率、小肠推进率及胃肠组织结构,发现造模后大鼠胃肠动力显著降低,组织结构均无明显病变,证明FD大鼠造模成功。经过枳术颗粒治疗后,大鼠胃残留率显著降低、小肠推进率显著升高,提示大鼠胃肠道动力得到了明显改善。
罗马IV研究共识中强调,脑-肠轴(brain-gut axis,BGA)功能障碍为功能性胃肠病(functional gastrointestinal disorders,FGID)的生物学基础[15]。BGA包括中枢神经内分泌系统(central nervous system,CNS)、自主神经系统(autonomic nervous system,ANS)、肠神经系统(enteric nervous system,ENS)、下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA)等结构。BGA的调节功能主要表现在ANS将肠道内的信息(如化学、机械和疼痛等)通过ENS、脊髓神经和迷走神经传递到CNS;同时,CNS也通过ANS调控胃肠道的运动、感觉和分泌功能[16]。BGA正常的调控作用有赖于兼有神经递质和激素双重作用的脑肠肽。脑肠肽作为脑和胃肠道中双重分布的小分子多肽类物质,调节着胃肠运动、分泌、吸收等功能[17]。GAS是由胃和十二指肠中胃泌素细胞分泌的脑肠肽,可刺激胃壁细胞促进胃酸分泌,增强胃肠动力[18]。Ghrelin主要由胃底X/A细胞产生,可与GHSR结合刺激机体对食物的摄入,促进胃酸分泌及胃肠蠕动,加快胃排空及小肠转运速度[19]。CGRP参与胃肠生理功能的调节及疼痛的传递,被推测可能与FD患者的腹痛和嗳气症状相关[20]。SS可以抑制胃肠道激素的释放,抑制胃肠道蠕动,并减少平滑肌收缩[21]。本研究结果显示,模型组大鼠血清中Ghrelin、GAS含量下降,CGRP、SS含量升高,下丘脑及胃窦组织中、基因表达水平下降,、基因表达水平升高,提示模型大鼠胃肠道运动障碍可能与胃肠道和大脑之间的交流障碍有关。给予枳术颗粒治疗后,FD大鼠血清中Ghrelin、GAS含量及组织中、基因表达水平均显著升高,CGRP、SS的含量及基因表达水平则出现显著降低。结果表明枳术颗粒可以通过调节FD大鼠的脑肠肽水平,改善BGA紊乱而达到增强FD大鼠胃肠动力的治疗作用。
ICC位于胃肠道的神经末梢和平滑肌细胞之间,作为胃肠道运动的起搏细胞发挥关键作用。ICC可以产生电慢波,慢波去极化传导到平滑肌细胞,从而使胃肠正常蠕动收缩,而FD是ICC功能障碍相关的代表性疾病之一[22]。ICC通过神经递质和激素的多种受体刺激而发挥作用,如毒蕈碱乙酰胆碱M3受体、血清素5-HT3受体以及G蛋白偶联受体[23-24]。肾上腺素和生长抑素已被证实能够影响生长素释放肽的产生和分泌,其中ADRB1的激活能够促进Ghrelin的释放,而激活SSTR能抑制Ghrelin的释放[25]。释放出的Ghrelin可经GOAT催化,转化为活性形式与ICC上的GHSR结合[26]。GHSR是一种G蛋白偶联受体,可激活细胞膜上的磷脂酶C,诱导产生肌醇三磷酸(inositol 1,4,5-triphosphate,IP3),IP3刺激内质网释放Ca2+[27],进而激活ICC衍生电慢波。本研究结果显示,模型组大鼠胃窦及十二指肠组织中、和基因表达显著下降,基因表达显著升高,而枳术颗粒可以显著改善这一现象,提示枳术颗粒可能促进了脑肠肽Ghrelin的分泌和乙酰化,使其作用于ICC上的GHSR,进而刺激了ICC产生电慢波而达到增强胃肠动力的作用。
C-kit是一种酪氨酸激酶受体,常用作ICC的生物标记物,通过与其配体SCF结合,促进ICC的发育和表型分化[28]。邓静等[29]研究发现,经过枳实的治疗后FD大鼠胃窦组织中ICC数量增多,SCF和C-kit表达上调,提示枳实促胃动力可能与激活SCF/C-kit信号通路、促进ICC的增殖有关。结果显示,模型组大鼠胃窦、十二指肠组织中的SCF、C-kit蛋白及基因表达水平显著下降,在高剂量枳术颗粒治疗下,组织中蛋白及基因表达水平均得到显著改善,提示枳术颗粒可能是通过激活SCF/C-kit通路,促进ICC细胞的增殖分化进而增强大鼠的胃肠道动力。ANO1是一种钙离子激活氯离子通道,细胞内局部钙离子浓度升高可激活该氯离子通道,驱动胞内氯离子外流,从而产生大量内向电流,在ICC的起搏活动中发挥关键作用[30]。MLCK广泛分布于肌肉组织中,通过催化肌球蛋白轻链的磷酸化,促使肌动蛋白沿着肌动蛋白丝滑动,从而使肠道平滑肌收缩[31]。结果显示,模型组大鼠胃窦及十二指肠组织中的、基因表达水平显著下降,而枳术颗粒可以明显改善这一现象,提示枳术颗粒促进了ICC的起搏活动和平滑肌的收缩(图5)。
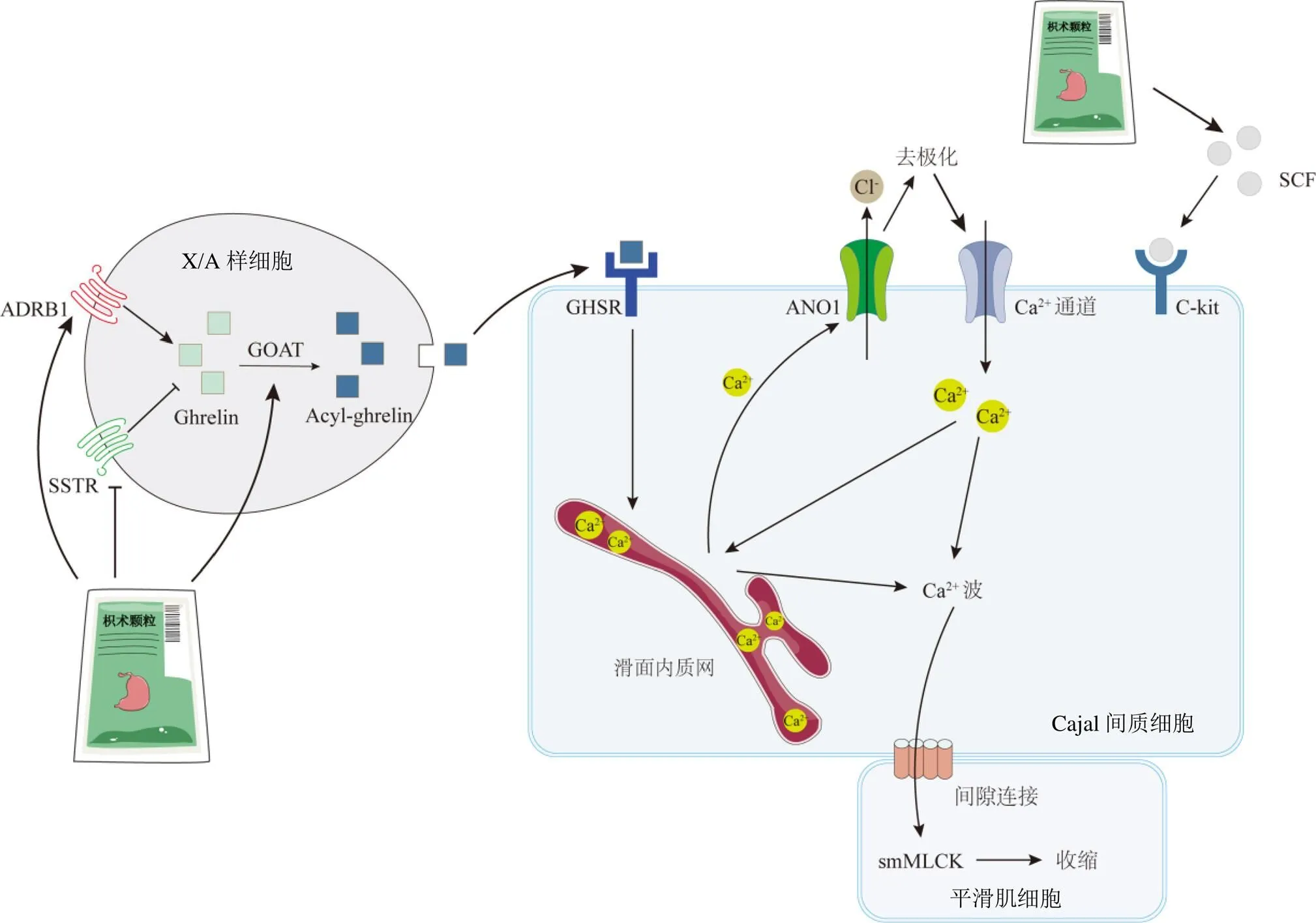
图5 枳术颗粒改善胃肠道功能异常机制图
综上,枳术颗粒可以调节FD大鼠的脑肠肽水平,增强FD大鼠的胃肠动力。枳术颗粒的治疗作用可能是通过增强Ghrelin对ICC的刺激作用、激活SCF/C-kit通路促进ICC增殖分化2方面实现的。本研究为枳术颗粒在改善胃肠道动力障碍方面提供了实验依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Talley N J, Ford A C. Functional dyspepsia [J]., 2015, 373(19): 1853-1863.
[2] Ford A C, Mahadeva S, Carbone M F. Functional gastrointestinal disorders 3: Functional dyspepsia [J], 2020, 396(10263):1689-1702.
[3] Sayuk G S, Gyawali C P. Functional dyspepsia: Diagnostic and therapeutic approaches [J]., 2020, 80(13): 1319-1336.
[4] 张声生, 赵鲁卿. 功能性消化不良中医诊疗专家共识意见 (2017) [J]. 中华中医药杂志, 2017, 32(6): 2595-2598.
[5] 王佳, 吕冠华. 中医药治疗功能性消化不良临床研究概况 [J]实用中医内科杂志, 2022, 36(4): 69-72.
[6] Liu B, Kou Z X, Chen B G. Effects and mechanisms of traditional Chinese medicines on functional dyspepsia: A review [J]., 2023, 15(4): 516-525.
[7] 林绿萍, 陈思月, 高旭, 等. 健胃消食口服液联合多潘立酮治疗儿童功能性消化不良的系统评价[J]. 药物评价研究, 2022, 45(7): 1399-1406.
[8] 赵凡, 唐德才, 张硕, 等. 枳术颗粒对慢性萎缩性胃炎大鼠胃粘膜的保护作用及机制研究 [J]. 中药药理与临床, 2016, 32(6): 183-186.
[9] 王煜姣, 王香香, 蒋凯林, 等. 中医药治疗功能性消化不良研究进展 [J]中国中医药信息杂志, 2023, 30(9): 187-191.
[10] Zhang J Q, Wang X, Wang F Y,. Xiangsha Liujunzi Decoction improves gastrointestinal motility in functional dyspepsia with spleen deficiency syndrome by restoring mitochondrial quality control homeostasis [J]., 2022, 105: 154374.
[11] 邓娴, 谭瑾轩, 陈映西, 等. 功能性消化不良病证结合动物模型研究进展 [J/OL]海南医学院学报, 2023, 1-11 (2023-08-29) [2023-12-14]. https://doi.org/10.13210/ j.cnki.jhmu.20230828.002.
[12] 李建锋, 谢胜, 陈广文, 等. 碘乙酰胺在消化系统疾病动物模型研究中的应用概况 [J]. 中国实验动物学报, 2018, 26(4): 533-539.
[13] 吴震宇, 张声生, 李培彩, 等. 碘乙酰胺灌胃联合夹尾应激诱导大鼠FD模型的建立及评价 [J]. 中国中西医结合消化杂志, 2015, 23(7): 462-466.
[14] 范明明, 张嘉裕, 张湘龙, 等. 功能性消化不良造模方法的述评 [J]. 世界中医药, 2020, 15(7): 1080-1083.
[15] Drossman D A. Functional gastrointestinal disorders: History, pathophysiology, clinical features and Rome IV [J]., 2016, doi: 10.1053/j.gastro.2016. 02.032.
[16] Gaman A, Kuo B. Neuromodulatory processes of the brain-gut axis [J]., 2008, 11(4): 249-259.
[17] 范明明, 张湘龙, 刘佳鑫, 等. 基于脑-肠轴理论探讨功能性消化不良的中医研究进展 [J]. 中南大学学报: 医学版, 2019, 44(11): 1300-1305.
[18] Liu C, Chen K, Wang H X,. Gastrin attenuates renal ischemia/reperfusion injury by a PI3K/Akt/Bad-mediated anti-apoptosis signaling [J]., 2020, 11: 540479.
[19] Koutouratsas T, Kalli T, Karamanolis G,. Contribution of ghrelin to functional gastrointestinal disorders’ pathogenesis [J]., 2019, 25(5): 539-551.
[20] 王东伟, 叶晓琳, 吴捷. 儿童功能性消化不良与血清脑-肠肽水平的关系 [J]中国当代儿科杂志, 2022, 24(4): 387-391.
[21] Gonkowski S, Rytel L. Somatostatin as an active substance in the mammalian enteric nervous system [J]., 2019, 20(18): 4461.
[22] Zhang L M, Zeng L J, Deng J,. Investigation of autophagy and differentiation of myenteric interstitial cells of Cajal in the pathogenesis of gastric motility disorders in rats with functional dyspepsia [J]., 2018, 65(4): 533-539.
[23] Kim H, Kim H J, Yang D,. Depolarizing effects of Daikenchuto on interstitial cells of Cajal from mouse small intestine [J]., 2017, 13(49): 141-147.
[24] Kim J N, Nam J H, Lee J R,. Rikkunshito depolarizes pacemaker potentials of cultured interstitial cells of Cajal through ghrelin receptors in murine small intestine [J]., 2020, 101(3): 227-238.
[25] Engelstoft M S, Park W M, Sakata I,. Seven transmembrane G protein-coupled receptor repertoire of gastric ghrelin cells [J]., 2013, 2(4): 376-392.
[26] Hwang S J, Wang J H, Lee J S,. Yeokwisan, a standardized herbal formula, enhances gastric emptying via modulation of the ghrelin pathway in a loperamide-induced functional dyspepsia mouse model [J]., 2021, 12: 753153.
[27] Yanagi S, Sato T, Kangawa K,. The homeostatic force of Ghrelin [J]., 2018, 27(4): 786-804.
[28] Feng J L, Gao J, Zhou S,. Role of stem cell factor in the regulation of ICC proliferation and detrusor contraction in rats with an underactive bladder [J]., 2017, 16(2): 1516-1522.
[29] 邓静, 凌江红, 上官鑫超, 等. 枳实对功能性消化不良大鼠胃Cajal间质细胞及其SCF/c-Kit信号通路的影响 [J]中华中医药杂志, 2018, 33(6): 2304-2309.
[30] 陈健海, 仲婕, 王凡, 等. 胃肠道Cajal间质细胞起搏功能的研究进展 [J]. 中国病理生理杂志, 2017, 33(1): 184-188.
[31] Alvarez-Santos M D, Alvarez-González M, Estrada-Soto S,. Regulation of myosin light-chain phosphatase activity to generate airway smooth muscle hypercontractility [J], 2020, 11: 753153.
Effect of Zhizhu Granules on improving gastric motility in rats with functional dyspepsia
GAO Renhao1, CHEN Huan1, ZHAO Kaijun2, 3, WANG Haili2, 3, CHENG Jun2, HUANG Fang1
1. School of Traditional Chinese Pharmacy, China Pharmaceutical University, Nanjing 211198, China 2. Jiangsu Classical Prescriptions of Traditional Chinese Medicine Engineering Technology Research Center, Nanjing Zhongshan Pharmaceutical Co., Ltd., Nanjing 210046, China 3. Nanjing Clinical Experience Prescription Modernization Engineering Research Center, Jiangsu Hongdian Research Institute of Traditional Chinese Medicine Industry Co., Ltd., Nanjing 210023, China
To study the efficacy and mechanism of Zhizhu Granules (枳术颗粒) on functional dyspepsia (FD) rats.A composite factor modeling method was used to induce FD model in rats. After successful modeling, rats were treated with Zhizhu Granules for two weeks. The effects of Zhizhu Granules on gastric residual rate, small intestinal propulsion rate, serum gastrin (GAS), growth hormone releasing peptide (Ghrelin), calcitonin gene related peptide (CGRP) and somatostatin (SS) contents in FD rats were observed; Hematoxylin-eosin (HE) staining was used to observe the pathological changes of gastric antrum tissues and duodenal tissues. The mRNA expressions of,,andin hypothalamus and gastric tissues, mRNA expressions of β1-adrenergic receptor (), somatostatin receptor (), ghrelin--acetyltransferase (), growth hormone secreting hormone receptor (), c-kit protooncogene protein (), stem cell factor (), anoctamin-1 (), myosin light chain kinase () in gastric tissues and duodenal tissues were detected by qRT-PCR; Western blotting was used to detect the protein expressions of C-kit and SCF in gastric tissues and duodenal tissues.Zhizhu Granules could significantly reduce the gastric residual rate (< 0.05), increase the small intestine propulsion rate (< 0.01), increase the contents of Ghrelin and GAS in serum (< 0.01), reduce the contents of CGRP and SS (< 0.05, 0.01), increase the expression levels ofandmRNA in hypothalamus and gastric antrum tissues (< 0.05, 0.01), decrease the expression levels ofandmRNA in hypothalamus and gastric antrum tissues (< 0.01), significantly increase the expression levels of SCF and C-kit proteins in gastric tissues and duodenal tissues (< 0.05, 0.01), increase the expression levels of,,,,,andmRNA in gastric tissues and duodenal tissues (< 0.05, 0.01), and reducemRNA expression level (< 0.05, 0.01).Zhizhu Granules can improve gastric motility abnormalities in FD rats, and its mechanism may be related to regulating brain gut peptide level and activating SCF/C-kit pathway.
Zhizhu Granules; functional dyspepsia; brain gut peptide; interstitial cell of Cajal; Ghrelin
R285.5
A
0253 - 2670(2024)08 - 2620 - 10
10.7501/j.issn.0253-2670.2024.08.013
2023-12-14
企业知识产权战略推进计划项目(ZT20210180-33)
高仁浩(1998—),男,硕士研究生,研究方向为中药药理学。E-mail: 812240613@qq.com
通信作者:黄 芳(1971—),女,博士,教授,博士生导师。E-mail: chengtianle007@163.com
[责任编辑 李亚楠]
