不同标本类型在非小细胞肺癌基因检测中的应用及意义*
2024-04-21朱启淦孟加榕魁国菊张小红黄江宾禹乐
朱启淦 孟加榕 魁国菊 张小红 黄江宾 禹乐
(联勤保障部队第九〇九医院·厦门大学附属东南医院病理科,福建 漳州 363000 )
肺癌是最常见的恶性肿瘤之一,全世界每年因肺癌死亡人数约160万人[1-2]。非小细胞肺癌(Non-small cell lung cancer,NSCLC)占肺癌的75%~85%,初诊并发现转移的患者5年生存期约为5%,生存率较低[3-4]。随着基因检测技术及分子病理学的发展,NSCLC驱动基因异常被相继发现,肺癌的诊断从组织学分型转向分子分型,促使肺癌的诊疗进入到个体化分子靶向药物治疗时代[5]。明确驱动基因状态是分子靶向药物治疗的基础,中国NSCLC诊疗指南[6]推荐,在NSCLC患者治疗前需检测表皮生长因子受体(Epidermal growth factor receptor,EGFR)基因,条件允许时可同时进行EGFR、间变性淋巴瘤激酶(Anaplastic lymphoma kinase,ALK)、C-ros原癌基因1-受体酪氨酸激酶(C-ros oncogene 1-receptor tyrosine kinase,ROS1)等多基因联合检测,以协助临床诊疗。因我国肺癌一经发现大多处于晚期或伴有转移而无法手术切除,且标本的来源及质量常影响到基因检测结果。本研究采用扩增阻滞突变系统(Amplification refractory mutation system,ARMS)法对180例不同标本类型NSCLC患者行驱动基因联合检测,分析不同标本类型基因突变的检出率及驱动基因状态与临床病理参数的关系,分析驱动基因联合检测的意义,进而为NSCLC患者个体化靶向药物治疗提供取样途径参考及分子病理学依据。
1 材料与方法
1.1 标本来源 收集2021年1月—2021年12月联勤保障部队第九〇九医院病理科明确诊断为NSCLC患者,并有足够的肿瘤细胞进行后续驱动基因联合检测的样本180例。其中女性56例,男性124例;年龄33~87岁,中位年龄(57±5)岁;腺癌154例,非腺癌26例(包括鳞癌、腺鳞癌及未分化癌);手术切除标本25例,肺活检标本80例(包括肺细针穿刺和支气管镜活检),胸腔积液细胞蜡块标本29例,转移病灶标本46例(包括骨、淋巴结、肝、脑等转移)。本研究通过医院伦理委员会审核通过。
1.2 试剂与仪器 德国LEICA RM2245切片机,厦门恺硕HF24全自动核酸纯化仪,石蜡包埋组织切片组织样品基因组DNA/RNA一步式提取试剂盒均购于厦门凯硕生物科技有限公司,人类5种突变基因检测试剂盒购于厦门艾德生物医药科技股份有限公司,UPT-100超微量核酸蛋白测定仪,美国ABI7500实时荧光定量PCR仪。
1.3 FFPE DNA和RNA的提取 石蜡包埋组织按5~10 μm的厚度进行切片,取5~10片于1.5 mL离心管中(视标本组织量增减切片数量),每个组织样本取2管,分别用于DNA和RNA提取。样本DNA和RNA提取操作方法及步骤严格按FFPE组织样品基因组DNA和RNA一步式提取试剂盒说明书进行。所提DNA和RNA需立即检测,或-20 ℃保存。
1.4 FFPE DNA和RNA浓度测定 使用微型紫外分光光度计测定样本RNA和DNA浓度,所提RNA浓度应介于10~500 ng/μL,DNA浓度应大于2 ng/μL,DNA和RNA的OD260/280应在1.8~2.1之间。样本DNA上机浓度稀释至1.5~3 ng/μL。
1.5 ARMS PCR检测驱动基因突变 向体积均为45 μL的待检样品RNA、LMG阳性质控品、纯化水中各加入5 μL LMG混合酶A;向体积均为42.3 μL的待检样品DNA、LMG阳性质控品、纯化水中各加入2.7 μL LMG混合酶B;混匀后短暂离心,将混好的RNA样品依次取10 μL加入LMG 12联PCR反应条的①-④号管中,将混好的同一份DNA样品依次取5 μL加入LMG 12联PCR反应条的⑤-号管中,盖上LMG 12联PCR反应条管盖,短暂离心,放入ABI7500实时PCR仪中。反应程序严格按照试剂盒说明书进行设置。
1.6 结果判断 5种突变基因检测试剂盒常见基因异常包括ALK基因融合、ROS1基因融合、BRAF 15号外显子基因突变、KRAS 2号外显子基因突变及EGFR 18、19、20及21号外显子基因突变。基因突变结果的判读严格按照试剂盒说明书阳性判断值及检验结果的解释进行。
1.7 统计学分析 采用SPSS 22.0统计软件分析,基因突变率以(%)表示,临床病理参数组间比较用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 5种驱动基因突变在NSCLC中的分布 5种驱动基因的总突变率为53.33 %(96/180),未发现不同驱动基因之间的共存突变。EGFR基因突变率40.56%(73/180),包括19Del突变29例、L858R突变36例、L861Q突变2例、20-Ins突变1例、19Del和T790M双突变2例、L858R和T790M双突变2例、G719X和L861Q双突变1例,在5种驱动基因中突变频率最高。KRAS基因突变率6.11%(11/180),ALK融合基因突变率4.44%(8/180),ROS1融合基因突变率1.11%(2/180),BRAF基因突变率1.11%(2/180),见图1、表1。
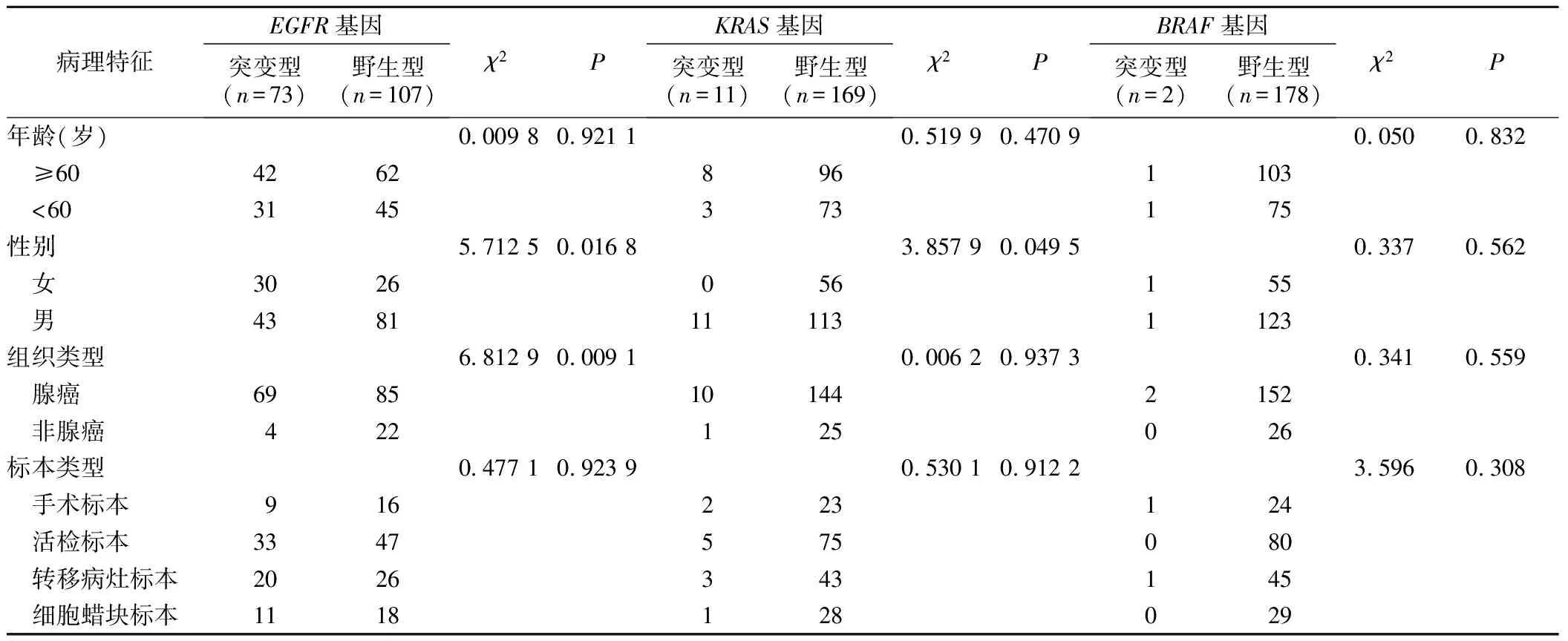
表1 EGFR、KRAS、BRAF基因突变与临床病理特征的关系
图1 NSCLC 标本驱动基因扩增曲线
2.2 NSCLC中EGFR、KRAS和BRAF基因突变与临床病理特征关系 EGFR基因突变率在女性患者53.57%(30/56)及腺癌患者44.81%(69/154)中较高,性别及组织类型差异有统计学意义(P<0.05);与年龄差异无统计学意义(P>0.05)。KRAS基因突变更容易发生于男性患者8.87%(11/124),性别差异有统计学意义(P<0.05);与年龄、组织类型差异无统计学意义(P>0.05)。BRAF基因突变率1.11%(2/180),与临床病理特征无明显相关(P>0.05)。见表1。
2.3 NSCLC中ALK和ROS1融合基因与临床病理特征关系 融合基因阳性率为5.56%(10/180),其中ALK阳性率在年龄小于60岁患者6.58%(5/76),男性患者4.84%(6/124),腺癌患者5.19%(8/154)中较高,但与年龄、性别、组织类型差异均无统计学意义(P>0.05)。ROS1融合基因突变率1.11%(2/180),与临床病理特征无明显相关。见表2。

表2 ALK、ROS1基因突变与临床病理特征的关系
2.4 5种驱动基因在不同标本类型中的检测情况EGFR基因在手术标本突变率为36.00%(9/25),活检标本突变率为41.25%(33/80),转移病灶标本突变率为43.48%(20/46),细胞块标本突变率为37.93%(11/29),转移病灶标本突变率较高,但不同标本类型突变率比较差异无统计学意义(P>0.05)。KRAS基因在手术标本突变率为8.00%(2/25),活检标本突变率为6.25%(5/80),转移病灶标本突变率为6.52%(3/46),细胞块标本突变率为3.45%(1/29),不同标本类型突变率比较差异无统计学意义(P>0.05)。ALK基因在手术标本突变率为8.00%(2/25),活检标本突变率为5.00%(4/80),转移病灶标本突变率为4.35%(2/46),细胞块标本突变率为0.00%(0/29),不同标本类型突变率比较差异无统计学意义(P>0.05)。BRAF基因突变手术标本及转移病灶标本各1例。ROS1基因活检标本及转移病灶标本各1例。见表1、2。
3 讨论
根据国家癌症中心2019年公布的癌症统计数据显示,我国肺癌的发病率和死亡率居所有恶性肿瘤之首[7]。近年来,随着新的检测技术和针对NSCLC不同驱动基因的发现,以及靶向治疗药物的不断研发上市,靶向药物治疗在肿瘤治疗中愈发重要,更加促进了NSCLC驱动基因的检测。标本来源及肿瘤细胞DNA的质量是检测的前提,DNA质量及低肿瘤细胞比例会影响驱动基因的检出率,李玉勤[8]报道标本质量不佳会引起假阴性。本研究采用的ARMS法是针对驱动基因突变设计特异的突变引物,确保了高度特异性,是一种高灵敏度的检测方法,灵敏度可低至1%,适合于活检及细胞蜡块等各种不同样本类型的检测。该检测方法还有操作简易,结果易于判读,报告周期短等优势,目前在各级医院驱动基因检测中广泛使用。
EGFR基因其酪氨酸激酶区域的激活即磷酸化对肿瘤细胞生长、肿瘤侵袭及细胞凋亡等相关信号传递具有重要意义[9-11],突变患者可从酪氨酸激酶抑制剂靶向治疗中获益。既往研究表明亚洲NSCLC人群EGFR突变率为30%~50%[12],主要以19DEL和L858R突变为主,约占EGFR突变的90%[13]。本实验中EGFR突变率为40.56%,其中19Del突变及L858R突变占89.04%,稀有突变占10.96%,与上述文献报道相近。本研究发现女性、腺癌患者的EGFR突变率明显高于男性、非腺癌患者,两者比较差异有统计学意义(P<0.05),而与患者年龄和标本类型无关(P>0.05),与既往报道一致[9,14]。KRAS基因是EGFR信号通路的下游调控基因,在EGFR信号传导通路中起着分子开关作用,KRAS基因突变是EGFR-TKIs耐药的重要原因之一[15]。本研究中KRAS基因突变率为6.11%,以2号外显子的12密码子为主;男性患者KRAS突变率高于女性,差异有统计学意义(P<0.05),研究发现老年、肺腺癌患者阳性率较高,但突变与患者年龄、组织类型无关,与李洁等[16]报道基本一致。BRAF基因突变导致信号通路的改变和激酶活性的增加,从而促使肿瘤的产生及转移[17],BRAF基因突变患者可在RAF抑制剂威罗菲尼和达拉菲尼治疗中获益。有研究表明BRAF在NSCLC患者中突变率为1%~8%,与患者性别、年龄及组织学类型等无关[18]。本研究中BRAF基因突变率1.11%,与上述文献报道相近。
ALK基因常与棘皮动物微管蛋白4(Echinoderm microtubuleassociated protein like 4,EML4)形成EML4-ALK融合基因,从而激活ALK酪氨酸激酶区、下游PIK3/AKT及MAPK等信号通路导致肿瘤的发生[19]。ROS1基因与ALK在氨基酸序列上有49%的相似,在酪氨酸激酶催化区的ATP结合位点同源性也高达77%[20]。ALK及ROS1基因融合患者在ALK/ROS抑制剂中明显受益。有研究表明EML4-ALK融合基因在NSCLC患者中的阳性率为3%~7%[21],ROS1融合基因在NSCLC患者中的阳性率为1.0%~3.4%[22]。本研究中ALK融合基因突变率4.44%,ROS1融合基因突变率1.11%,与上述文献报道相近。研究发现ALK基因融合更好发于年龄小于60,男性,腺癌患者,但与年龄、性别、组织类型及标本类型突变率差均异无统计学意义(P>0.05)。ROS1融合基因突变患者因例数过少无法进行统计分析,后续将继续积累数据进行探讨。
本研究组前期报道活检小标本、转移病灶标本及细胞蜡块等不同标本类型可用于EGFR基因检测[9,23],结果发现其他驱动基因突变也可在此类不同标本类型中检出,且突变率与标本类型之间差异无统计学意义,从而为临床根据患者实际情况选择合适的标本类型提供了依据,增加了基因检测的取材途径。本研究4种不同标本类型,虽均可检出驱动基因突变,但实验发现血性胸水细胞蜡块标本因含大量红细胞及炎细胞,肿瘤细胞比例往往较低,在制作细胞蜡块前可用免疫磁珠阴性富集法富集肿瘤细胞能有效提高肿瘤细胞比例[24];对于活检标本因肿瘤大小、活检部位及肿瘤异质性存在取样误差,导致肿瘤细胞数量往往有限,故对基因检测切片前及切片后的HE切片进行细胞分析,可大致评估出样本中的肿瘤细胞数和比例,对于肿瘤细胞数及比例过低的样本,可采取显微切割的方法对切片中的肿瘤细胞进行富集,以提高肿瘤细胞的比例,从而达到ARMS法检测阈值[25];转移病灶标本,特别是骨转移标本切片时常因骨组织而难以切片,取材前需置于酸性条件下进行脱钙处理,引起DNA的降解及片段化,从而导致PCR的扩增效率下降,对于骨转移组织样本可采用表面脱钙法,脱钙后流水冲洗,可有效降低浸泡法对细胞DNA的降解,并在上机时适当增加上样浓度,可增加此类样本实验的检出率。综上可知,手术标本为首选样本,在患者无法手术的情况下活检标本、转移病灶标本及细胞蜡块标本也可作为有效检测样本,对于少数无法获得组织学或细胞学标本的晚期患者,可用血液替代检测[6]。
早期研究认为NSCLC的基因突变是相互独立、相互排斥的,近年来有文献报道双驱动基因共突变在NSCLC中可以共存[26]。本研究未发现不同驱动基因之间的共存突变,可能与肿瘤异质性、样本量不够大有关,在后续的检测中继续积累数据探讨。本实验EGFR基因手术标本突变率低于其他标本类型,可能与手术标本量较少有关,也证实我国NSCLC患者一经发现大多失去最佳的手术机会,后续的检测中将继续积累数据探讨;转移病灶样本EGFR突变率最高,可能与突变导致肿瘤高负荷,更易导致肿瘤生长、侵袭及转移有关[27]。实验中活检标本及细胞蜡块标本经过HE及免疫组化的连续切片,导致样本的损耗,以往单基因多次检测造成样本的不足,且提供的基因信息有限,多基因联合检测相比单基因检测能一次测出多种基因状态,为临床治疗提供更多指导信息,同时解决样本量不足的问题,也可缩短报告周期。
4 结论
不同类型标本均可用于驱动基因检测,增加了患者基因检测取样途径,并分析与临床病理特征的关系,从而筛选出适合基因检测的NSCLC患者,为患者靶向药物治疗提供更多基因信息参考和依据。
