增加革兰阴性菌外膜囊泡产量的研究进展
2024-04-17刘灿闫晓阳曾焱欧祥龙廖永洪
刘灿 闫晓阳 曾焱 欧祥龙 廖永洪,2
(1.西南大学动物医学院,重庆 402460;2.国家生猪技术创新中心,重庆 402460)
细菌外膜囊泡(outer membrane vesicles, OMVs)是大多数革兰阴性菌在正常生理活动下分泌的一种纳米级双层膜囊泡状结构,其直径约为20-250 nm[1],主要由细胞外膜的成分组成,包括丰富的外膜蛋白、脂多糖、肽聚糖以及一系列与宿主组织黏附和侵袭有关的毒力因子,同时也含有一些细胞内成分,例如DNA、RNA 和酶等,其组成成分决定它会影响细菌多种生物过程,包括生物膜的形成、DNA 转移、营养摄取、抗菌防御和细胞物质与毒力因子的运输等[2-3]。
OMVs 由于其结构稳定、含有大量免疫原性良好的物质以及不具有复制能力等特点,使OMVs 成为疫苗研发环节中优质的候选抗原[3]。目前,已有以OMVs 作为主要抗原成分的疫苗上市,其中最著名的是针对B 群脑膜炎奈瑟球菌开发的外膜囊泡疫苗[4-5]。此外,OMVs 还可以作为疫苗佐剂和载体平台用于递送抗原或药物[6]。
OMVs 具有广阔应用前景,但天然OMVs 产量低,因此增加其产量是产业化过程中必须解决的关键技术问题。本文主要从细菌基因改造、生长培养条件优化和生产纯化工艺优化3 个方面对增加OMVs 产量研究的进展进行综述,以期为OMVs 疫苗的相关研究提供参考。
1 外膜囊泡的生物发生机制
目前关于OMVs 的生物发生机制研究主要集中于3 个学说(图1)[7]。
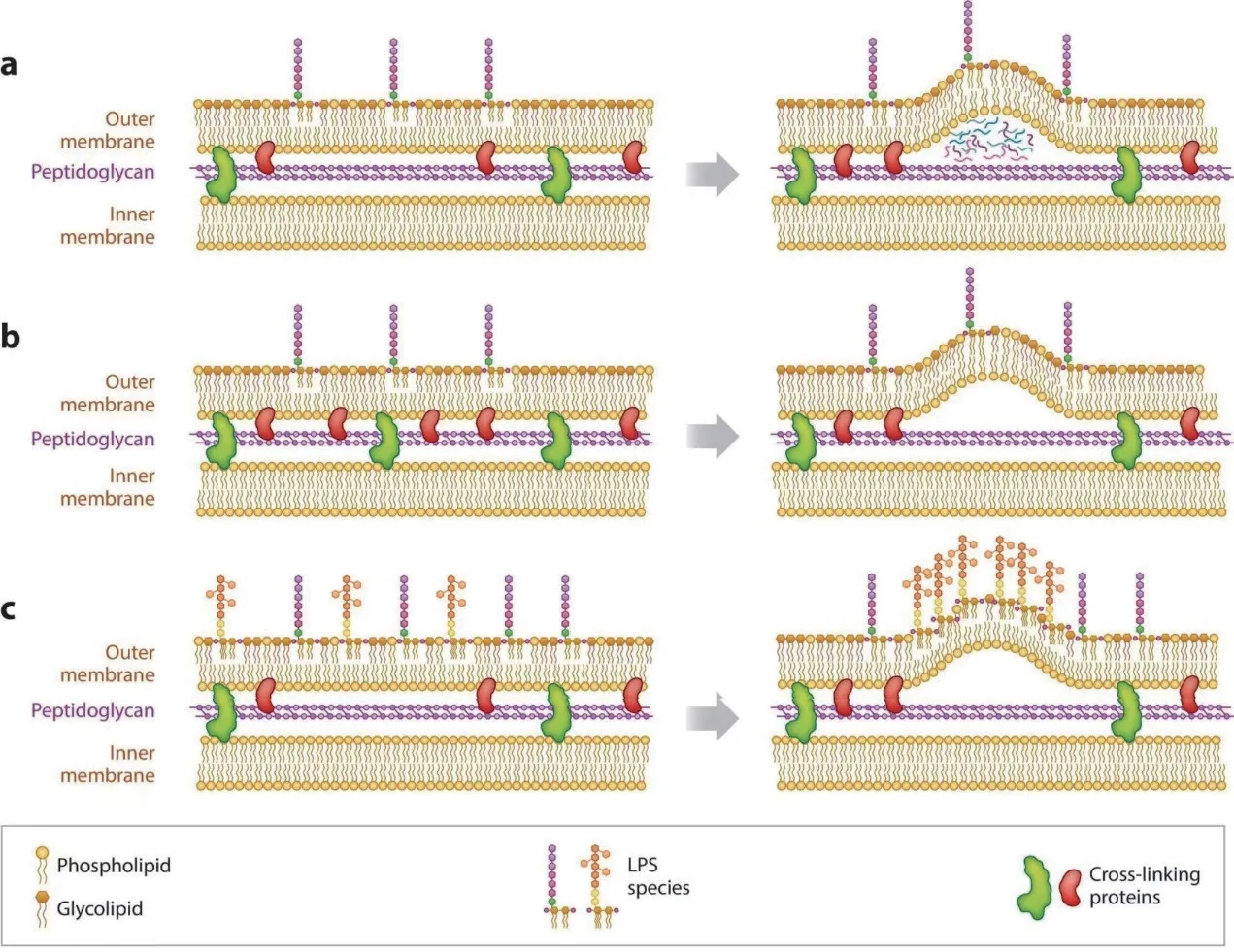
图1 革兰阴性菌外膜囊泡生物发生过程Fig.1 Biogenesis of outer membrane vesicles in gram-negative bacteria
1.1 压力聚集学说
革兰阴性菌的细胞膜由外膜(outer membrane,OM)和内膜(inner membrane, IM)组成,在OM 与IM 之间有一层肽聚糖(peptidoglycan, PG)连接OM和IM。Mcbroom 等[8]发现革兰阴性菌OMVs 的产生是一种包膜应激反应,当细胞周质中存在错误折叠的有毒产物、高度过表达的蛋白质、肽聚糖片段以及脂多糖(lipopolysaccharide, LPS)片段时,异常组分在局部聚集引起了包膜应激(图1‑a),最终外膜会包裹异常组分向外突出形成OMVs 并将其释放。
1.2 膜交联学说
膜交联学说是最早提出的OMVs 生物发生机制,该学说将OMVs 的生物发生与囊泡形成部位的外膜-肽聚糖-内膜交联的减少联系起来(图1‑b),外膜和肽聚糖层通过交联蛋白共价连接,并通过此连接与内膜共价连接。当去除连接外膜层与肽聚糖层的蛋白质、参与肽聚糖平衡代谢进而影响外膜层与肽聚糖层交联的蛋白质以及连接外膜层与内膜层的蛋白质时,外膜的一部分会从肽聚糖层解离并向胞外凸起,夹断后就形成了囊泡[9-11]。
1.3 脂类富集学说
在外膜中加入修饰过的曲率诱导分子,如LPS或磷脂等脂类,这些曲率诱导分子会改变外膜局部的膜磷脂组成成分、电荷或空间构型等,进而使外膜的曲率发生改变,导致OM 发生局部弯曲(图1‑c),OM‑PG 连接被破坏,从而诱导OMVs 的形成和释放[8,12-13]。
2 基于基因改造增加OMVs 产量的研究
通过基因改造的方法增加OMVs 产量的研究已在国内外有诸多报道,研究大多基于细菌自身OMVs 的生物发生机制进行设计,从而选择相应的基因进行改造,以确认通过某些基因的改造是否能达到增加OMVs 产量的效果。
2.1 基于压力聚集学说的基因改造
革兰阴性菌OMVs 的产生是一种包膜应激反应,当革兰阴性菌的周质中存在错误折叠的蛋白质废物、PG 片段和LPS 片段时,这些废物会被包裹在OMVs中并释放[8]。因此在革兰阴性菌中缺失参与修复和/或消除错误折叠的周质蛋白基因,基因缺失突变株都会表现出OMVs 产量增加。
人工诱导蛋白质废物在周质中积累主要是通过缺失蛋白酶基因或缺失参与σE包膜应激反应途径的蛋白质来实现。通常认为DegP 蛋白在高温下主要作为蛋白酶发挥水解蛋白质的作用,以消除未折叠的外膜蛋白[13]。研究发现,在大肠杆菌、鼠伤寒沙门氏菌、霍乱弧菌和铜绿假单胞菌中缺失DegP 蛋白后均表现出囊泡增加[8]。值得注意的是,这种情况下增加的囊泡并不依赖于OM‑PG 交联水平减少[14];degQ 基因编码丝氨酸蛋白酶,其作用是断裂大分子蛋白质中的肽键,使之成为小分子蛋白质,对Shewanella oneidensis degQ 突变株进行OMVs 定量评估表明,与野生型菌株相比,degQ 突变株的OMVs产量增加了5 倍[15-16]。在多数革兰阴性菌中,σE包膜应激反应途径由错误折叠的外膜蛋白激活,导致σE转录因子的释放以及消除错误折叠的外膜蛋白的基因的转录活化[17]。degS 基因编码属于HtrA 家族的内膜锚定的周质内肽酶,在存在未折叠蛋白(例如外膜蛋白)的情况下,DegS 参与释放σE并激活参与修复和/或消除错误折叠的周质蛋白的基因的转录[17]。目前仅有鼠伤寒沙门氏菌和大肠杆菌中有degS 缺失的研究报道,其结果表明degS 缺失后,囊泡的产量明显增加[18];此外,还有一种同样参与σE包膜应激反应途径的RseA 蛋白,目前仅在鼠疫杆菌中进行了基因缺失,其突变株也表现出高囊泡性[19]。
人工诱导PG 片段在周质中积累主要通过抑制细菌的肽聚糖回收循环和β-内酰胺酶诱导过程[20]。Schwechheimer 等[20]的研究发现在大肠杆菌ΔampGΔamiD 双基因突变株(AmpG:IM 渗透酶,负责将多肽从周质转运到细胞质以进行肽聚糖循环;AmiD:β-内酰胺酶)中,存在PG 片段过大无法通过孔蛋白而在周质中聚集的现象,与野生株相比,突变株OMVs 产量增加了约14 倍。此外,牙龈卟啉单胞菌自身溶血素的突变株(ami 突变)也表现出OMVs 产量增加。因为缺乏自身溶血素活性阻止了牙龈卟啉单胞菌降解周质肽聚糖片段,周质中不能被降解的肽聚糖则发生聚集并通过OMVs 排出[21]。
最近研究结果表明,大肠杆菌ΔrfaC,ΔrfaG 和ΔrfaP 突变株改变了LPS 核心多糖结构,包膜中LPS合成过程被破坏从而导致细菌周质出现LPS 积累,对上述3 株突变株OMVs 产量分析发现OMVs 产量均增加[20]。
2.2 基于膜交联学说的基因改造
膜交联学说涉及到的蛋白质可以分为1.2 中所述的三类蛋白,在大多数革兰阴性菌中缺失相关的蛋白基因后,基因缺失突变株表现出OMVs 的产量增加。
连接外膜层与肽聚糖层的蛋白有Pal、Lpp、NlpI 和OmpA 蛋白等脂蛋白或外膜蛋白[1]。Pal 定位于外膜的内层,与肽聚糖层相互作用,促进膜的稳定性,Pal 蛋白的破坏会导致沙门氏杆菌、大肠杆菌、铜绿假单胞菌、霍乱弧菌等多种革兰阴性菌的OMVs 释放增加[12,22];Lpp 是革兰阴性菌中的主要外膜脂蛋白,是唯一与肽聚糖层相连并在包膜结构中起独特作用的共价脂蛋白,Lpp 的N 端结构域被酰化并插入到外膜中,而C 端结构域与肽聚糖层共价连接[22]。Lpp 的失活会导致铜绿假单胞菌、大肠杆菌和鼠伤寒沙门氏杆菌的OMVs 产量增加[18,23];OmpA 蛋白是革兰阴性菌的主要外膜蛋白之一,它在外膜和底层肽聚糖层之间提供物理联系,即连接作用[11]。缺失ompA 会导致大肠杆菌、沙门氏菌和霍乱弧菌的外膜囊泡增加[20]。
NlpI 是一种脂蛋白,不仅部分决定(约40%)Lpp‑PG 交联的形成,还可以通过参与肽聚糖分解和合成的平衡,影响肽聚糖层结构,进而影响外膜与肽聚糖层交联。在沙门氏菌、铜绿假单胞菌、幽门螺旋杆菌和副猪嗜血杆菌中nlpI 基因缺失均导致OMVs 产量增加[13]。除nlpI 外,能影响肽聚糖的合成与重塑的基因还有mrcB 和yipP[18]。据报道,在大肠杆菌和伤寒沙门氏菌中缺失mrcB 会影响包膜稳定性,促进囊泡分泌[20]。yibP 基因(也称为envC)编码一种与细胞分裂和肽聚糖水解相关的酶,缺失yibP 会导致细菌分裂缺陷,在大肠杆菌和沙门氏菌中会产生丝状细菌,但是突变株的OMVs 产量会增加[18]。
连接外膜层与内膜层的蛋白质主要包括TolA、TolB、TolQ 和TolR 等 蛋 白, 其 中TolA、TolQ 和TolR 在内膜形成一个复合体,而TolB 是一个外膜蛋白,与Lpp、OmpA 和Pal 相互作用,这4 种蛋白与Pal 蛋白组成Tol‑Pal 系统,这些蛋白中任何一个发生突变都会导致外膜完整性出现缺陷(周质内容物泄漏、洗涤剂不耐受),但是也会出现OMVs 产量增加[1,18]。研究还发现,Tol 蛋白或与Tol‑Pal 系统相互作用的蛋白质(例如丝状噬菌体的次要外壳g3p 蛋白和大肠杆菌素的易位结构域)过量表达导致特异性地破坏细胞包膜的稳定性从而诱导囊泡大量产生[3]。上述蛋白基因中最令人感兴趣的是tolR,该基因已被证明可使不同革兰阴性菌(包括大肠杆菌、志贺氏菌和沙门氏菌)的囊泡增产至足以支持疫苗试验。尽管膜完整性受损,但缺失tolR 的细菌已成为OMVs 应用的宝贵工具,因为缺失株能产生由外膜相关蛋白和周质蛋白组成的均匀OMVs,同时OMVs 内还不含有由于基因编辑而“泄漏”的内膜相关蛋白和细胞质蛋白[24]。此外,还可以进一步进行基因工程改造加工OMVs,例如设计抗原呈递。迄今为止已测序的所有革兰阴性菌的基因组中均发现有Tol‑Pal 系统蛋白的同系物,因此Tol‑Pal 编辑很可能是囊泡大量生产的通用策略。事实上,Tol‑Pal 途径的修饰已被证明可以增加非致病性大肠杆菌、肠外致病性大肠杆菌、福氏志贺氏菌、沙门氏菌和鼠伤寒沙门氏菌的OMVs 产量[1,12,20,25]。
2.3 基于脂类富集学说的基因改造
在外膜层中加入修饰过的磷脂或LPS 等曲率诱导分子,使OM 的曲率发生变化,OM‑PG 连接被破坏,从而促进产生OMVs[2,9,26-27]。
通过膜磷脂的修饰改变细菌OM 曲率进而增加OMVs 产量的方法主要涉及两方面。第一方面是通过基因修饰改变膜磷脂的组成成分,膜磷脂成分的改变会导致外膜曲率发生改变,进而会引起包膜应激[3]。嗜冷的南极细菌Shewanella livingstonensis Ac10 的orf5 和plsC1 基因在其合成二十碳五烯酸(EPA)的过程中起着至关重要的作用,二十碳五烯酸是其膜磷脂的组成成分,作为磷脂的酰基存在于细胞膜中;另外该细菌的plsC1 和plsC4 基因编码参与膜磷脂合成的酰基转移酶。Yokoyama 等[15]分别构建该细菌的orf5、plsC1 或plsC4 基因缺失突变株,发现突变株的膜磷脂的组成成分发生了改变,并对缺失株进行囊泡产量进行定量分析。结果表明,基因缺失株的OMVs 产量增加了约5 倍;第二方面是通过基因修饰影响磷脂由外膜向内膜的逆行转移过程,导致磷脂在外膜中积累,影响外膜的曲率。在革兰阴性菌中,OmpC‑Mla 系统负责将外膜外层中错位磷脂运送到内膜。MlaA 脂蛋白与嵌入外膜的OmpC 蛋白相互作用,并将外膜外层中的磷脂转移到该系统的另一个组成成分MlaC 蛋白。随后MlaC将这些磷脂送到位于内膜的MlaFEDB 复合物,该复合物可以将磷脂重新整合到内膜上。Sutterlin 等[28]构建了大肠杆菌mlaA 缺失突变株,发现突变株囊泡产量增加,但是突变株会因为囊泡的过度产生而降低外膜中的脂质水平,降低的脂质水平会被来自内膜的脂质所补充,而内膜脂质的降低会导致细胞裂解。Roier 等[10]突变了流感嗜血杆菌的vacJ 和yrbE基因,它们分别与大肠杆菌的mlaA 和mlaE 基因同源,vacJ 和yrbE 突变株的囊泡产量分别增加了1.6倍和2.2 倍,同时在霍乱弧菌和空肠弯曲杆菌中构建了vacJ 和yrbE 的突变株,也发现突变株外膜囊泡产量增加。
通过LPS 的修饰改变细菌OM 曲率进而增加OMVs 产量的方法主要分为两方面。第一方面是改变LPS 携带的电荷。有研究指出,LPS 可以在OMVs 中富集,直接或间接影响OMVs 组成和外膜曲率,进而影响OMVs 产量[29]。例如,铜绿假单胞菌产生两种含有不同O 侧链抗原的LPS:带中性电荷的LPS 和带负电荷的LPS,对OMVs 进行检测发现囊泡内仅有带负电荷的LPS,对这个现象的假设是OMVs 是在带负电荷的LPS 更丰富的区域产生的,并且电荷排斥会导致外膜曲率发生改变进而促进外膜弯曲释放OMVs,在仅产生带负电荷的LPS 的菌株中发现OMVs 产量增加也证实了这种假设[30];鼠肠道病原体啮齿枸橼酸杆菌中的pmrC 和cptA 均负责LPS 修饰,PmrC 和CptA 起连接磷酸乙醇胺和核心多糖的作用。但是成功连接后细菌内带负电荷的LPS 的合成减少,所以在啮齿枸橼酸杆菌的ΔcptA 和ΔpmrC 突变株中,OMVs 的分泌量都高于野生株[31]。第二方面是改变LPS 的空间构型。PagL 是一种通过去除酰基链来修饰脂质A 的酶,在鼠伤寒沙门氏菌中,表达PagL 的菌株外膜显示六酰化脂质A 占主导地位,而在OMVs 主要含有五酰化脂质A。上述差异现象是由于完全酰化和脱酰化的脂质A 其疏水部分横截面的变化而具有不同的空间构型导致的,六酰化脂质A 呈圆锥形,而脱酰化脂质A 呈圆柱形或倒锥形,具有圆柱形或倒锥形的脂质会增大膜曲率,导致外膜突出并形成OMVs。所以当PagL 在鼠伤寒沙门氏菌中过表达时,产生的OMVs 几乎是野生株的4 倍[20,30]。
此外,还有一种独特的仅限于铜绿假单胞菌和产生喹诺酮信号(pseudomonas quinolone signal, PQS)的相关细菌的双层耦合模型,铜绿假单胞菌分泌的PQS 会插入OM 中增大OM 曲率,使OM 迅速扩增,最终导致囊泡形成[32]。在其他革兰阴性菌中添加外源性PQS 也会刺激OMVs 的形成,在铜绿假单胞菌中缺失oprF 基因会上调PQS 来诱导OMVs 的分泌[9,25]。
3 基于优化生长条件增产OMVs
细菌OMVs 的产生是一种受环境控制的特定的分泌过程,在生产OMVs 的时候,对细菌进行特定的一些处理。物理刺激如温度、溶解氧含量和超声处理等;生化刺激如洗涤剂样分子、抗生素、抗菌肽和提取剂等;以及限制生长所需的营养元素如铁、氨基酸和硫酸盐等,均会对OMVs 的生成产生一定影响[33-38]。
3.1 物理条件刺激增加OMVs产量
研究表明,生长温度对绝大多数细菌的OMVs产生均有影响。37℃培养条件下大肠杆菌的囊泡产量约为30℃培养条件下的5 倍。这种现象在大肠杆菌degP 缺失突变株中显著增强,OMVs 产量增加超过150 倍[37-38]。推测其原因可能是由于degP 缺失突变株周质中错误折叠的蛋白质水平升高,从而激活影响囊泡的应激反应途径,且膜也变得更有流动性,使OM 能够凸起并释放OMVs。另外,较高的生长温度也会增加细胞分裂的速度,同时增加细胞壁的生长和周转率,进一步促进OMVs 的释放。百日咳杆菌和支气管败血波氏杆菌在55℃下孵育1 h可显著增强OMVs 释放,且不会影响蛋白质的含量和构象。并且热休克蛋白GroEL 的含量在温度变化后没有增加,这可能是因为在56℃时细菌体内蛋白质的合成完全受到抑制[39-41]。
在工业生产OMVs 的过程中,通过控制培养液中的溶解氧含量,可以在发酵罐中通过氧化应激反应刺激细菌产生更多的OMVs[42-43]。例如在脑膜炎奈瑟球菌中,将溶氧含量从30%增加到150%后,OMVs 的产量提高了4 倍[42-43],其作用机制可能是OMVs 的释放可以减轻细菌承受的氧含量高的环境压力。这种以释放OMVs 的形式减轻环境应激压力的方式可能与细菌为消除错误或未折叠蛋白质而释放OMVs 的形式相似。然而在铜绿假单胞菌中,将有氧培养改变为缺氧培养,OMVs 产量提高了6 倍,该现象的调节机制尚未得到进一步研究[43]。
在副猪嗜血杆菌中,可以通过超声处理来诱导OMVs 的分泌[11]。但是这种方法是通过对细菌沉淀进行超声处理来制备,超声使细菌的膜破碎并融合裂解形成OMVs,由于上述OMVs 不是从细菌上清液制备的,而细菌上清液是传统天然OMVs 的聚集地,因此超声诱导的OMVs 可能含有天然OMVs 中并不存在的物质。所以,尽管通过细菌超声处理获得了高OMVs 产量,但由此产生的囊泡并不一定含有天然OMVs 的蛋白组成。因此,若想要将超声处理诱导的OMVs 作为疫苗开发还需要进一步研究。
3.2 生化条件刺激增加OMVs产量
洗涤剂提取OMVs 是传统工业生产中使用最广泛的方法,第一代脑膜炎奈瑟菌B 群OMVs 疫苗即是基于洗涤剂提取制备的[7]。洗涤剂样分子例如脱氧胆酸盐或十二烷基硫酸钠处理细菌后,洗涤剂与细菌膜相互作用以增加外膜囊泡的形成,同时去除外膜中的LPS,由此产生的OMVs 缺乏LPS,缺乏LPS 的OMVs 减少了动物机体对LPS 的炎症反应[44]。然而LPS 丢失的同时会导致许多抗原的丢失。此外,OMVs 的内在佐剂活性在LPS 去除时同样会丧失。所以这种制备方法的使用在现代生产中越来越少,科学家们一直致力于寻找新的方法来诱导OMVs 释放并减少LPS 的毒性。
现代生产中常用的诱导OMVs 的另一种方法是使用提取分子,如EDTA。这些提取分子旨在破坏细菌膜的稳定性,从而达到增产OMVs 的目的[4,44]。其具体作用原理为EDTA 作为一种螯合剂,可以去除环境中的钙离子,而细菌体内钙离子通过中和LPS 和其他阴离子脂质的负电荷来稳定细胞壁。钙离子的去除会导致LPS 的负电荷相互排斥,从而破坏膜的稳定性。但EDTA 的作用相对来说比较温和,因此会在OMVs 中保留LPS 和天然成分[4]。因此,使用EDTA 可以提高OMVs 的产量,并且这些OMVs 更适合用于疫苗开发,但由于LPS 仍然存在,且缺乏钙离子,因此这些OMVs 可能尚不稳定。
目前增加OMVs 释放的另一种方法是通过补充外部分子来诱导膜应激,例如天然存在的抗菌肽(antimicrobial Peptides, AMPs)[37,43]。AMPs 是 先 天免疫系统的一部分,可由不同的细胞类型表达。其通常对细菌膜具有高亲和力,能破坏膜的完整性,使细胞内外屏障丧失,从而杀死细菌,因此AMPs增加OMVs 的产生可能是细菌免受诱导应激的一种手段[45]。此外还有多肽类抗生素,如多黏菌素B 和多黏菌素E 等,这些分子也被证明可以诱导OMVs释放。它们诱导OMVs 的机制可能与AMPs 机制相似,即基于膜的破坏导致细菌应激并释放OMVs[37,43]。
靶向细菌胞内发挥作用的抗生素也被证明可以诱导OMVs 释放,例如环丙沙星、庆大霉素、氨苄西林和亚胺培南等。Maredia 等[46]证实,与未处理的细菌相比,用环丙沙星处理的铜绿假单胞菌OMVs 的产量增加了100 倍;同样是在铜绿假单胞菌中,有研究表明抗生素会诱导PQS 分泌,而PQS 又被证明诱导OMVs 形成,因此在这个过程中OMVs 的形成可能与细菌对抗生素的反应有关[47-48];有学者对通过庆大霉素诱导肠外致病性大肠杆菌产生的OMVs 进行表征和质谱法分析,发现诱导得到的OMVs 直径没有改变。相对于天然OMVs,抗生素诱导得到的大多数OMVs 内存在大量细胞质和周质蛋白,这些蛋白可能是庆大霉素干扰核糖体机制后形成的错误折叠蛋白质[49];另外由氨苄西林诱导的大肠杆菌OMVs 也被证明含有过量的Pal 蛋白,进一步证明抗生素可以改变OMVs 内物质[33,49];在另一项研究中,将鲍曼不动杆菌用四环素和亚胺培南刺激,并且对所得的OMVs 进行了定量分析。四环素没有诱导OMVs 释放,但与未经处理的对照组相比,OMVs 产量在暴露于亚胺培南后增加了2.2 倍,并且外膜蛋白和蛋白酶含量均相对增加。此外埃伐环素诱导鲍曼不动杆菌产生的OMVs 同样不仅含有相对更多的外膜蛋白,还含有抗性相关蛋白,如ATP 结合盒式蛋白(ABC 转运蛋白)和其他转运蛋白[34,50]。结果表明这种诱导方法的可能风险,即亚致死浓度的抗生素可能导致细菌对抗生素耐药性的产生。
3.3 限制生长所需的营养元素增加OMVs产量
在试验或者生产中,通过补充铁螯合物质如去铁氧胺、乙二胺二羟基苯乙酸和双嘧啶来实现对培养基进行铁限制。幽门螺杆菌中在铁限制培养条件下会导致OMVs 产量显著增加,但OMVs 中相关毒力因子VacA 的表达降低,铁盐环境能够恢复其表达水平[43]。同样,对流感嗜血杆菌、大肠杆菌和霍乱弧菌产生的OMVs 的研究发现,铁限制条件有利于OMVs 产量的增加[35,39]。对脑膜炎奈瑟菌的研究表明,半胱氨酸的耗竭可以引发细菌生长停滞,并释放出足够数量的OMVs 以用于疫苗生产,这些囊泡是自发释放的,且与人类疫苗生产系统所需的囊泡高度相似。通过转录组分析表明,在该研究中半胱氨酸消耗会损害铁硫蛋白组装引起氧化应激作为囊泡增加的细胞内信号[51]。
由于半胱氨酸消耗时增强的OMVs 释放与氧化应激和氧化还原反应有关,因此该团队进一步研究了更多氧化硫源对OMVs 释放的影响。结果表明,脑膜炎奈瑟菌在硫酸盐(氧化硫源)上的生长过程相似,OMVs 释放通常由硫消耗引发。硫酸盐耗竭导致OMVs 释放增加超过半胱氨酸耗竭。蛋白质组学表明,硫消耗还会导致氧化应激反应并上调磷脂和LPS 生物合成。此外,硫消耗产生的OMVs 中磷脂富集[51]。因此对该现象推测为硫消耗引起磷脂过度产生,进而导致外膜膨胀增加并随后释放OMVs。
4 基于优化生产工艺提升OMVs 产量
实验室及工业生产中,OMVs 典型的工艺流程包括以下步骤:(1)在液体培养基中培养;(2)去除完整的细菌:低速离心法去除大部分细菌,其余细菌通过无菌过滤进一步消除;(3)浓缩培养物滤液:可以直接对培养物滤液进行超速离心,由于通常取得的OMVs 浓度较低,在离心之前,可以使用沉淀或超滤来预浓缩滤液;(4)纯化:根据生产的OMVs 制剂所需的纯度,选择一种合适的纯化方法以除去其他细胞外物质如鞭毛、纤毛、毛状体和大蛋白质复合物或聚集体等,常用的纯化方法有密度梯度离心和凝胶过滤[39,52]。
在生产中对这套工艺流程进行优化,使用新的技术代替原有步骤是一个很好的切入点。例如OMVs 传统上是通过超速离心、梯度离心、超滤或尺寸排阻色谱法分离[53],但这些技术或者具有相对较高的操作成本,或者缺乏大规模生产所需的可靠性、产量和可重复性。相反有一种新的静水过滤透析(HFD)分离方法,作为通过选择性富集尿液样本快速识别细菌性尿路感染的一种方法[54]。现已有实验成功地将其用于从革兰阴性病原体肺炎放线芽孢杆菌和厌食杆菌中大规模分离OMVs[52]。HFD已被证明是一种经济高效且简单可靠的OMVs 分离方法,特别是在需要大量OMVs 的情况下,例如体内免疫试验。HFD 的另一个优点是,它提供了相当一致的批次再现性,这一特征对于疫苗开发至关重要[52]。由于HFD 最近才被开发为OMVs 分离技术,因此目前使用HFD 进行OMVs 分离的研究较少,无法与其他OMVs 分离方法进行适当的比较。尽管如此,HFD 仍然是大规模生产OMVs 疫苗最有前途的技术之一。
此外,目前的OMVs 生产工艺大多是批量工艺,批量工艺生产OMVs 的特点是产量相对较低,成本较高。而将OMVs 生产过程从批量处理过渡到连续处理可以提高体积生产率,提高设备利用率,缩短周期时间和减少设施占地面积,从而降低生产和投资成本,并产生更高质量的产品[55]。批量处理即原材料在工艺开始时被装入系统,产品被一次性排出,并且在原料充填和产品排出之间,没有任何成分会排出系统;而连续处理则是在整个工艺过程中,原料和产品分别不断地被注入和排出系统。Gerritzen 等[56]研究了脑膜炎奈瑟菌OMVs 的持续生产工艺,当连续培养脑膜炎奈瑟菌达到稳定状态时,其OMVs 浓度与周质在批量工艺中达到的浓度相似,并且连续培养时稳态是可重复的,可以保持至少600 d。当稀释速率达到L/d 时,连续培养的体积生产率可达到4.0×1014OMVs/(L·d)(稀释速率等于培养液在发酵罐中平均停留时间的倒数),通过提高稀释率来优化体积生产率,可以进一步强化该过程。当以3.6/d 的稀释速率连续生产OMVs 时,与批量OMVs 生产相比,OMVs 产量增加了9 倍。在实验过程中,OMVs 的测试特性没有变化,表明连续生产工艺对于任何应用的OMVs 生产都是可行的。
5 展望
革兰阴性菌OMVs 的纳米尺寸、脂质膜结构以及远距离递送活性分子等特点,使其成为具有广泛应用前景的疫苗开发平台[6,57]。但天然OMVs 的产量较低,因此在实验室和工业生产中提高OMVs 产量是未来OMVs 疫苗研究和开发的关键环节,本文综述了通过遗传基因改造、物理条件刺激、生化条件刺激、限制生长所需的营养元素和优化生产工艺等方式增加OMVs 产量的研究进展。目前已有的绝大部分增产方法仅在实验室里应用,具体应用到实际生产中还有待进一步研究。此外还需要不断的寻找新的低成本、简易的增产方法以满足生产所需。在研究增产的同时还应该考虑到,这些干预措施中的任何一种方法都可能会引起OMVs 成分的变化,这在疫苗开发中可能是有利的,因为OMVs 本身可以被认为是免疫调节蛋白的“载体”,通过结合遗传操作、培养条件以及分离和纯化方案,可以设计囊泡内容物以满足疫苗开发的需求。此外,由于人工干预的囊泡与细菌生理释放的天然囊泡大不相同,因此在研究OMVs 的生理和环境作用时,应避免对囊泡释放过程的影响。最后,基于OMVs 的疫苗开发还有一个挑战,就是由于LPS 的存在而导致的体内毒性效应,虽然现在已经研究了许多方案,例如通过遗传修饰和洗涤剂处理等以降低毒性,但要在增产和减毒之间达到理想平衡,还有很长的路要走。
