植物向重力反应中PIN-FORMED 介导的生长素极性运输调控
2024-04-17王贤彭亚坤陈猛孔梦娟谭树堂
王贤 彭亚坤 陈猛 孔梦娟 谭树堂
(中国科学技术大学生命科学与医学部生命科学学院前沿交叉科学与生物医学研究所,合肥 230027)
植物在重力引导下的不对称生长称为植物的向重力性(gravitropism)。植物的向重力性是植物适应陆地环境的重要过程。植物向重力性反应(gravit‑ropic response)的第一步是感受重力信号,根冠的柱细胞和茎的内皮层细胞中存在淀粉体,这些淀粉体被命名为平衡石,被认为是重力的感受器。根冠柱细胞和茎内皮层细胞通过淀粉体的沉降来感受重力变化[1-2]。近年来通过模式生物拟南芥(Arabidopsis thaliana L.)的遗传学和细胞生物学研究,基本上解析了植物向重力性反应过程中信号转导的分子机理和细胞学基础,大大增进了我们对于植物向重力性的认识。
长期以来,科学家们便认识到,植物激素生长素在植物的向重力性反应中发挥重要调控作用。细胞间生长素的定向运输是生长素不对称分布和细胞差异伸长的主要机制。在植物组织生长素的定向流动中,生长素输出载体PIN‑FORMED(PIN)的极性定位发挥重要作用[3-4]。模式生物拟南芥的基因组编码了8 个PIN 蛋白,分别称为PIN1-PIN8。在向重力反应过程中,根冠柱细胞中的PIN3、PIN7 等蛋白的极性定位发生改变,最终影响生长素在根尖的不对称分布从而产生向地性弯曲。另外,在向重力反应中细胞骨架的排列发生改变,其影响PIN 蛋白在胞内的运输和定位。近几十年的研究表明,PIN蛋白在质膜上的极性定位决定生长素的运输方向,是生长素在植物体内不对称分布的决定因素。因此,本文从植物向重力反应、PIN 蛋白介导的生长素极性运输、PIN 的内膜运输和(重)定位及PIN 的蛋白翻译后修饰等方面,探讨植物向重力反应中PIN蛋白介导的生长素极性运输调控。
1 植物的向重力性
1.1 植物的重力信号感知
重力是影响植物生长发育的重要环境因素。植物器官根据重力控制其生长方向,即向重力性。在这个过程中,植物的茎向上生长,表现为负向重力性,利于植物的出土、光合作用等;而根向下生长,表现为正向重力性,利于固着和吸收水分、营养等。重力响应包括几个连续过程,即重力感应、重力信号传导、细胞间信号传输和器官不对称生长。
对重力刺激有响应的植物器官中,例如根冠和茎的内皮层,通常观察到含有致密淀粉颗粒的质体,被称为淀粉体(支链淀粉体)。植物器官偏离重力方向后,受到重力刺激,这些器官重定向,淀粉体沿着新的重力矢量沉积。目前被广为接受的淀粉体-平衡石假说认为,植物通过体内一类富含淀粉体的特殊细胞即平衡石细胞来完成对重力的感知。在根冠柱细胞中,可观察到随重力方向沉降的淀粉体。在物理和遗传上去除根冠可以令根部丧失重力响应,表明根冠负责重力感受或响应[5-6]。激光消融根冠中特定细胞实验发现,第二层小柱细胞的内部细胞对根的向重力性贡献最大[7]。在几种地上部组织中,包括单子叶植物的胚芽鞘和胚轴,以及双子叶植物的下胚轴和茎(花序)的维管束鞘观察到沉降的淀粉体,表明这些组织是重力感知部位。在模式植物拟南芥中,有遗传学证据表明,内皮层是地上部枝条重力感知组织。sgr1(shoot gravitropism1,也称作scarecrow, scr)和sgr7(shoot gravitropism7,也称作short‑root, shr)突变体在根和地上部中都缺乏内皮层,导致地上部完全丧失向重力性,而它们的根仍然对重力刺激有反应[8]。
1.2 植物的重力传感机制
在模式植物拟南芥中,淀粉在根冠柱细胞和内皮层细胞内质体中高度积累,称为淀粉体,含有致密淀粉颗粒的支链淀粉体比周围的细胞质重,导致在重力刺激时在平衡细胞中沉积到细胞底部[2]。缺乏淀粉合成能力的拟南芥磷酸葡萄糖变位酶(pgm)突变体在根和茎中表现出向重力性降低的表型[9-10]。淀粉过量突变体(sex1)在各组织器官中存在过量沉降淀粉体,下胚轴对重力响应更敏感[11]。
重力感应细胞感知淀粉体沉降的机制在最近取得的关于LZY 蛋白的突破性进展之前,并不完全清楚。曾有研究人员推测,质膜上可被拉伸等机械力信号激活的Ca2+通道作为重力传感器,可能通过沉降的淀粉体与内质网相互作用,内质网膜局部变形激活钙离子通,或可能通过重力传感细胞内的肌动蛋白丝激活,钙离子被释放并充当重力信号转导中的第二信使[12]。然而,机械性敏感离子通道与重力响应之间的关系尚未报道。重力刺激下,拟南芥根冠柱细胞Ca2+水平没有任何变化[13]。胞质Ca2+变化是高度局部化的,所使用的技术无法检测到。为了证明胞质Ca2+瞬时变化是由重力刺激诱导的,拟南芥幼苗中表达apoaegorin(钙离子指示利)的拟南芥幼苗在重力刺激下促进胞质游离Ca2+浓度增加[14],由于空间分辨率不足,并不清楚是否是根冠柱细胞胞质Ca2+水平变化。这些结果依赖于未来使用更加先进的技术得到证实,例如使用高灵敏度Ca2+传感器的活细胞成像分析,以证明Ca2+的变化与重力信号传导之间的联系。
鉴于淀粉体将重力传递到膜和细胞骨架等细胞组分,重力反应对重力大小敏感。然而,结合离心超重力和倾斜仪来改变植物外界重力环境的生理实验表明,几种被子植物的茎向重力性不取决于重力的大小,而是取决于倾斜角度[15]。因而有学者提出了位置传感假说,平衡石细胞类似于倾斜仪方式通过淀粉体在细胞内位置而不是重力大小感知倾斜[16]。活细胞直接观察和仿生实验发现,淀粉体以肌动蛋白依赖的方式动态移动,即使在轻微倾斜角度下也可以做出反应[17]。位置传感器假说可能是一个有趣的概念,它将淀粉体沉积与向重力性的生化信号转导联系起来。
1.3 根中参与重力信号传导基因
最新成果显示,LAZY 家族蛋白在植物重力感知过程中发挥重要作用。植物感知到重力矢量的变化后,淀粉体沉降触发信号转导改变细胞中生长素运输方向。一些基因已经证明参与重力信号转导在根冠细胞中表达和发挥作用。
在近十几年的研究中,LAZY 家族基因相关研究结果对于促进向重力信号转导过程的理解至关重要。LAZY1 最初在水稻中发现,水稻lazy1 突变体茎(叶鞘和胚芽鞘)具有重力响应缺陷[18-19]。基于序列相似性比对,在拟南芥中发现6 个AtLAZY(也称作NEGATIVE GRAVITROPIC RESPONSE OF ROOTS,NGR 或DEEPER ROOTING1, DRO1)家族成员和一个功能相反的基因[20-21]。本综述中将这个基因家族统 称 为LAZY1‑LIKE(LZY)。LZY1、LZY2 和LZY3在拟南芥茎的向重力性中发挥冗余作用,而LZY2、LZY3 和LZY4 在根向重力性中发挥功能[22-23]。lzy1 lzy2 lzy3 三突变体植株的地上部沿地面生长,几乎完全丧失了负向重力性。通过SCR(SCARECROW)启动子特异性在茎内皮层细胞表达LZY 基因可以恢复三突变体茎的向重力缺陷,并且淀粉体沉降不受LZYs 影响[22],说明LZYs 在淀粉体感受重力之后的过程中发挥作用。lzy1 lzy2 lzy3 重定向后,茎中上下侧IAA5 转录水平没有明显差异,LZY 在重定向茎中生长素的不对称分布起关键作用[22]。lzy1 lzy2 lzy3突变体重定向后根中未观察到生长素荧光报告基因DR5rev::GFP 不对称表达。lzy2 lzy3 lzy4 突变体重定向后,根中DR5rev::GFP 和DII::Venus 的表达表明,生长素在根上侧的积累增加[21,23]。这些结果表明,LZY 蛋白在植物重力响应过程和生长素不对称分布中起作用。
遗传学证据表明,PIN3 在LZYs 下游起着重要的作用。LZY3 的CCL 结构域可以与RCC1‑like domain(RLD)蛋白的BRX 结构域相互作用,根据淀粉体沉积后的重力方向,以极化方式将RLD 蛋白募集到侧根的根冠柱细胞质膜上,形成LZY‑RLD 复合体,从而引起PIN3 的重新定位以调节生长素的流动方向,导致侧根的向重力性发生变化[24]。此外,还有一种含有BRX 结构域的蛋白BRX‑LIKE4(BRXL4)能与LZY1 相互作用,通过将LZY1 从其发挥作用的质膜转移到细胞核来负调控LZY1 的作用[25]。值得注意的是,当重力方向改变后,重定位的重力刺激会激活促分裂素原活化蛋白激酶(MAPK)介导的LZY 蛋白的磷酸化,从而增加其与淀粉体表面几种质体外膜转运(translocons at the outer envelope membrane of chloroplasts, TOC)蛋白的相互作用,促使LZY 蛋白由质膜向淀粉体转运[26]。在淀粉体向新的重力方向沉积后,LZY 又会通过淀粉体转移到质膜上,在新的重力方向下侧形成极性定位,将淀粉体的位置信息传递给质膜,从而发出重力方向的信号[27]。这样的一种细胞学机制很好地解释了植物重力感知的淀粉体沉降是如何转化为细胞的极化和生长素转运方向的改变的,大大促进了我们对于植物向重力性的认识(图1)。

图1 根和地上部重力感应位置及相关调控基因Fig.1 Gravity-sensing positions and related regulators in roots and shoots
ARG1(ALTERED RESPONSE TO GRAVITY1)蛋白是根和下胚轴向性所必需的,其含有DnaJ 结构域和一个卷曲螺旋区,主要与膜互作相关,一部分区域与肌动蛋白细胞骨架相互作用[28-29]。ARG1及其同源基因ARG1‑LIKE2(ARL2)突变减弱了重力刺激下根尖生长素的横向再分布,但淀粉积累正常[30]。垂直生长的arg1 arl2 双突变体的根冠柱细胞中,PIN3 的表达模式和亚细胞定位与野生型没有明显区别。然而,重力刺激下,PIN3 蛋白在arg1 arl2根冠柱细胞的重新定位受到影响[30]。因此,ARG1和ARL2 可能在重力信号传导中起作用,影响PIN3的重定位和重力刺激后生长素的不对称分布。
目 前, 数 个SGRs(SHOOT GRAVITROPISMs)已被证明参与不同植物器官的向重力反应。sgr1/scr(scarecrow)和sgr7/shr(short‑root)突变体在地上部(包括下胚轴和茎中)没有正常的内胚层,导致地上部向重力性缺陷[8]。sgr2、zig(zigzag)/sgr4和sgr8/grv2(gravitropism defective2)/kam2(kata‑mari2)在下胚轴和茎内皮层中淀粉体不会向新的重力方向沉积,但根的向重力响应正常[31-33]。sgr3、sgr5 和sgr6 的茎而不是下胚轴或根的向重力反应缺陷[31,34-35]。SGR2 编码液泡膜磷脂酶A1(phospholi‑pase A1, PA‑PLA1),SGR3 编码的t‑SNARE AtVAM3与ZIG/SGR4 编码的v‑SNARE AtVTI11 形成稳定的SNARE 复合物,介导的囊泡转运到内皮层细胞中的液泡前体/液泡,突变体中液泡功能或形成的缺陷可能会干扰淀粉体的运动,导致无法感知重力变化[34,36-37]。SGR5 在功能上与其他SGR 成员不同,其主要在茎中重力感知的早期过程中起作用。研究发现高温诱导SGR5 选择性剪接,在茎的向重力作用减弱[38]。另外,SGR9 编码定位于淀粉体上的RING 型E3 泛素连接酶[39]。SGR9 调节淀粉体和F‑肌动蛋白之间的相互作用,并促进淀粉体与F‑肌动蛋白的分离,使淀粉体沿重力方向沉积[39]。
这些发现为我们理解植物向重力性的分子机制提供了很好的基础,但是ARG/ARLs、SGRs 是否或者如何参与LZYs 介导的重力感知过程,有待于未来深入的细胞学或生物化学探索。
2 PIN 蛋白介导的生长素极性运输
生长素是最早被发现的一类植物激素,在调节植物发育和向性生长中具有重要作用。种子植物中,生长素主要通过极性运输或维管系统进行运输,极性运输对建立和维持生长素浓度梯度至关重要,进而调节植物感知并响应发育和环境信号。在生长素极性运输过程中,位于膜上的转运蛋白发挥关键作用。PIN‑FORMED(PIN)是定位在质膜上的生长素外排载体,通过极性定位调节细胞生长素的输出方向。PIN 的极性定位决定了组织内生长素在细胞间的转运方向,在胚胎发生、器官发生、组织分化和植物向性等多个生长发育过程中具有重要的调控作用[40]。
PIN 介导的生长素极性运输在植物向重力反应过程具有重要功能。在向重力反应过程中,PIN 的极性分布会影响茎和根两侧生长素的不对称分布,导致器官发生不对称生长而弯曲。pin2 突变阻断了重力诱导的生长素不对称再分布并导致根出现向重力缺陷表型,表明PIN2 在根向重力反应中发挥重要作用,生长素通过中柱从地上部运输到根尖进入皮层和表皮细胞,通过PIN2 向伸长区和分生区转运[3,41]。重力刺激后生长素分布的时空调节与重力刺激根上下侧细胞中的PIN2 丰度相关,根下侧细胞中生长素分布增加伴随着刺激后PIN2 丰度增加随后逐渐减少;另一方面,根上侧细胞中生长素分布减少伴随着PIN2 丰度先减少随后增加。根上下侧细胞中质膜PIN2 蛋白水平对称恢复可能促进重新建立对称的生长素运输,导致根垂直生长[41-42]。重力刺激后PIN2 在细胞内的重新定位取决于蛋白酶体活性[43]。有研究表明,在向重力过程中,植物激素赤霉素(gibberellin, GA)也发生不对称分布,下侧GA水平较高。GA 通过抑制PIN2 蛋白向液泡的降解来稳定PIN 蛋白,从而有助于稳定根下侧PIN2,促进生长素不对称运输和分布[44]。此外,根下侧生长素的增加促进了编码分泌性小肽的GLVs(GOLVENs,也称作ROOT GROWTH FACTOR LIKE)基因的表达。GLVs 基因在表皮和皮层细胞中的差异表达调节生长素运输加剧PIN2 的极性分布[45]。另外,PIN3和PIN7 也参与根的向重力过程,这两个蛋白均极性定位于根冠柱细胞的质膜上。重力刺激后,PIN3 和PIN7 极化到根冠柱细胞的下侧,生长素运输到根尖下侧并驱动重力弯曲[46]。因此,重力刺激后根冠柱细胞PIN3 和PIN7 重新极化以及表皮细胞PIN2 不对称分布促进生长素的再分布,抑制根上侧生长素积累导致根向下弯曲。
拟南芥多个PIN 家族的成员参与到植物地上部的向重力反应中。pin3 突变导致下胚轴重力反应缺失,同源基因的突变体pin4 和pin7 以及pin4 pin7双突变体在下胚轴向重力响应方面没有表现出任何缺陷[47-48]。而pin3 pin7 双突变体和pin3 pin4 pin7三突变体的表型强于pin3 单突变体[47-48]。这些遗传证据表明,PIN3 是拟南芥下胚轴向重力过程中生长素差异运输的主要参与者,而其他PIN 转运蛋白发挥冗余作用[47]。重力刺激后下胚轴内皮层细胞中PIN3 极化到细胞下侧的质膜,介导生长素向下胚轴下侧运输和积累促进生长和下胚轴弯曲[49]。
根的向重力性对于其三维构型(root system architecture, RSA)十分重要,主要表现为主根和侧根以一定的角度进行生长。向重力性定点角(gravitropic setpoint angle, GSA)抑制根的正向重力生长促进根系径向扩张。在细胞水平上,生长素极性运输导致伸长区不对称生长决定GSA 形成。在侧根(lateral root, LR)形成早期阶段,PIN3 在根冠柱细胞质膜上表达并不对称分布,随后在底部极化影响生长素不对称分布促进GSA 形成[50]。侧根形成后期,GSA 形成时,PIN3 整体表达水平降低,与生长素不对称运输减少以及侧根以恒定GSA 非差异生长有关[50-51]。地上部枝条稳定在一定非垂直的角度生长依赖于生长素介导的负向重力性机制,通过调节重力感应细胞中PIN 的极化来控制侧枝GSA[52]。拟南芥胞吐复合体亚基EXO70A3(EXOCYST70A3)通过调控PIN4 的亚细胞定位和生长素的极性转运,在根GSA 和根系结构的调控中发挥重要功能,影响拟南芥不同生态型对不同生态环境的适应[53]。
3 PIN 的内膜运输和(重)定位
PIN 的极性分布是通过质膜和内体区室(endosomal compartments)之间连续动态循环来维持的[54]。PIN 通过内吞作用分选到反式高尔基网(trans‑Golgi network, TGN)和 早 期 内 体(early endosome, EE),进而通过囊泡运输到质膜与膜融合或通过多囊泡体(muti‑vesicular bodies, MVB)进入液泡降解[55-57]。
3.1 网格蛋白介导的PIN蛋白的内吞作用
PIN 蛋白通过网格蛋白介导的内吞作用(CME)从质膜(plasma membrane, PM)内化[56]。网格蛋白由重链(clathrin heavy chain, CHC)和轻链(clathrin light chain, CLC)组成[58],包被着囊泡。chc 和clc突变体在PIN 运输、极性定位中表现出缺陷,从而影响生长素分布和向性响应[55,59-60]。CHCs 是PIN蛋白被内吞和极性分布过程中所必需的[55-56]。而CLC2 和CLC3 影响CHC 与膜结合,以及生长素介导质膜蛋白内化和胞内运输,clc2 clc3 双突变体中生长素运输和分布缺陷,导致生长素相关的多个发育过程出生缺陷[60]。PIP5K1 和PIP5K2 磷脂激酶共同调节的PI(4,5)P2在网格蛋白介导的质膜运输、PIN 极化和生长素分布方面发挥重要作用。pip5k1 pip5k2 双突变体影响生长素运输并干扰PIN1、PIN2极化和内体循环[61]。生长素结合蛋白ABP1 通过将网格蛋白募集到PM 促进CME 并介导生长素对CME的抑制[60]。最近的结果表明,ABP1 互作蛋白TMKs和调控因子MAKR2 在PIN2 介导的植物向重力反应中具有重要调控作用[62-63]。植物激素生长素通过TMK 激活质膜上的质子泵,酸化细胞壁,促进细胞的伸长及组织生长[64-65]。
3.2 囊泡运输调控PIN蛋白的(重)定位
在内吞和再循环过程中,PIN 蛋白分布于囊泡中,许多相关的调控蛋白均可以影响PIN 蛋白运输。细胞骨架调控囊泡运输,RAB 和ARF 小GTP酶将膜连接到细胞骨架,是细胞内运输的主要调节因子[66]。ARF 蛋白以GDP 形式与囊泡膜较弱结合,以GTP 形式紧密结合。在ARF 与膜结合后,小G 蛋白ADP 核糖基化因子的鸟苷酸交换因子(ARF‑GEF)被募集将ARF 小G 蛋白上的GDP 转变为GTP。小分子化合物布雷菲德菌素A(Brefeldin A,BFA)通过与ARF‑GDP/ARF‑GEF 复合物结合来抑制ARF 蛋白的活化,可逆地抑制PIN1 从内体区室到质膜极性结构域的囊泡运输[67-68]。对BFA 敏感的ARF‑GEF GNOM 主要定位于高尔基体,部分定位于质膜和TGN/EE(trans‑Golgi network/early endosome)。GNOM 调节PIN1 内体循环,进一步影响PIN1 的极性。BFA 对GNOM 的长时间(超过12 h)抑制导致PIN1 从根细胞的基部异常定位于细胞顶端,但遗传改造的BFA 不敏感的GNOMM696L‑myc 转基因系仅导致PIN1 的再循环对BFA 不敏感[69]。BFA 处理或者GNOM 蛋白功能缺失都会抑制PIN1 质膜-内体之间的循环并破坏其基底极性分布,但对PIN2 的顶端极性定位影响不大,说明PIN 蛋白的顶端极性定位通过其他BFA 不敏感的ARF‑GEF 介导[70]。GNL1(GNOM‑LIKE1)是 一 种 类 似GNOM 的ARF‑GEF,在内质网到高尔基体运输中具有保守功能,在PIN2的内吞过程中具有选择功能[69]。拟南芥磷酯翻转酶ALA3 可 以 与GNOM 和BIG3(BIG/SEC7‑RELATED PROTEIN3)等ARF‑GEF 互作,调控PIN 的顶-基部极性定位,参与根的向重力性反应、子叶发育和叶维管束发育等多个过程中[71]。
在生物合成分泌和内吞作用后,PIN 蛋白一部分被回收到特定的质膜区域极性定位,一部分通过晚期内体(late endosomes, LE)或液泡前体(prevacuolar compartment, PVC)运输到液泡膜降解。磷脂酰肌醇‑3 激酶(PI‑3K)是调节PIN 液泡降解所必需的,使用PI‑3K 抑制剂渥曼青霉素(wortmannin, WM)处理导致LE 中PIN1 和PIN2 的积累[72-73]。液泡中以泛素化依赖的方式调节PIN 蛋白周转也有助于质膜处PIN 蛋白极性[43]。PIN1 和PIN2 在snx1‑1(sorting nexin1‑1)和vps29‑3(vacuolar protein sorting29‑3)突变体中质膜上定位减少,AtSNX1 和VPS29 已被证明是独立于GNOM 的不同内体区室介导PIN 蛋白从PVC免于降解进入再循环途径[72-73]。AP‑3(ADAPTOR PROTEIN3)和内体分选复合物(ESCRT)参与液泡PIN 蛋白的降解和分选[74-75]。
4 PIN 蛋白的可逆磷酸化修饰
PIN 介导的生长素转运需要通过蛋白激酶调节PIN 的激活、极性分布和运输。与PIN 磷酸化相关的激酶家族主要有AGC 激酶、受体激酶(RLK)、MAP 激酶和钙调蛋白激酶(Ca2+/CALMODULIN‑DEPENDENT PROTEIN KINASE‑RELATED KINASEs,CRKs)。与蛋白激酶相反,某些磷酸酶也参与其中,包括蛋白磷酸酶2A(PP2A)、PP1 和PP6 等(图2)。

图2 翻译后修饰调节PIN 蛋白定位Fig.2 Post-translational modifications regulate the localization of PIN
4.1 AGC激酶对于PIN蛋白的活性和极性定位起着重要的调控作用
拟南芥基因组编码39 种AGC 激酶,其中23 种AGC 激 酶 形 成AGCVIII 亚 家 族[76]。在AG‑CVIII 激酶中,有两个亚家族直接参与PIN 介导的 生 长 素 转 运:PID(PINOID)、WAG1(WAVY ROOT GROWTH1)和WAG2,以及D6PK 和D6PK‑LIKE1-3。
PID/WAGs 磷酸化PIN 蛋白,既可以激活PIN转运生长素的活性,也调控其蛋白的极性定位。pid突变体具有针状花序,与pin1 突变体表型类似,这意味着PID 在生长素转运或信号转导中发挥作用[77-78]。PID 的过表达诱导根部内皮层和中柱PIN1、皮层PIN2 和表皮及皮层PIN4 从基部到顶部的异常极性定位,导致生长素浓度梯度丧失以及胚胎和幼苗根发育缺陷。pid 功能缺失突变体导致花序分生组织表皮层PIN 从基部向顶端极性的转换抑制,无法建立顶端器官形成所需的局部生长素积累,阻止了新的侧向器官的发生,从而形成针状花序[79]。进一步遗传和生化分析表明,WAG1 和WAG2 与PID 之间功能冗余,PID、WAG1 和WAG2 主要在表皮和侧根冠细胞中表达,pid wag1 wag2 三突变体幼苗的根具有更明显的向重力性缺失表型,干扰PIN 顶端定位影响生长素运输,导致子叶发育、根系生长和根向重力缺陷[80]。PID/WAGs 磷酸化PIN蛋白的胞内结构域(PIN‑HL)3 个高度保守TPRXS(N/S)基序的中间丝氨酸残基S1‑S3,调节PIN 极性定位[81-82]。PID、WAG 与PIN 蛋白相互作用并磷酸化招募MAB4/MEL(MACCHI‑BOU4/MAB4(EN‑P1)‑LIKE)支架蛋白形成PIN/PID/MAB4 复合物形成正反馈调控,增加PIN 磷酸化并限制PIN 在其极性结构域的横向扩散[83-84]。拟南芥WAV3(WAVY GROWTH 3)/WAVH 亚家族E3 泛素连接酶独立于PID/WAG 蛋白激酶,在调控PIN 蛋白极性定位发挥重要作用[85]。此外,PID/WAGs 调节PIN3 蛋白在下胚轴向光性以及茎和根的向重力过程中的重新定位[86-87]。最近的研究表明,PP2A 可以去磷酸化PIN3 蛋白,与蛋白激酶PID/WAG 介导的磷酸化形成一种拮抗机制,参与到侧根的角度维持和根系统的形态建成中[51]。
拟南芥D6PK 及其同源蛋白D6PKL1-D6PKL3主要调节PIN 转运生长素的活性。D6PK 和D6PKL活性丧失导致典型生长素相关表型,如下胚轴向光性、负向重力性、避阴以及侧根和芽分化,这些表型与极性生长素运输受阻和分布异常相关[88-90]。与非极性定位的PID 不同,D6PK 在根表皮和中柱、下胚轴、茎和顶端分生组织细胞中,与细胞基底侧极性分布的PIN 蛋白共定位[90-92]。与PID 类似,D6PK 也可以磷酸化PIN 蛋白丝氨酸S1‑S3,此外,D6PK 还磷酸化S4 和S5,虽然这两个位点在PIN3、PIN4 和PIN7 中保守,但PIN1 中不存在S5,PIN2缺乏S4 和S5。与PID 相反,D6PK 磷酸化PIN 不会改变PIN 蛋白极性,而是影响PIN 蛋白转运生长素的能力。D6PK 和PID/WAGs 对PIN 的不同作用可能的原因是其对不同磷酸化位点的偏好[80,93]。
与D6PK 类似,与BRX 相关的蛋白激酶PAX(PROTEIN KINASE ASSOCIATED WITH BRX)对韧皮部发育至关重要[94]。PAX 与BRX 是PIN 蛋白激活的正向和负向调节因子,一起作为“分子变阻器”磷酸化并激活PIN 蛋白,动态调节生长素运输和维管发育。在较低生长素水平下,质膜上PAX 招募BRX(BREVIS RADIX)并抑制PAX 活性,从而抑制PIN 的磷酸化,随着细胞生长素水平升高,BRX降解或运输到细胞核释放PAX,PAX 被激活并刺激生长素运输[95-96]。此外,该调节模块另一个组成部分,生长素激活的磷脂酰肌醇‑4‑磷酸5‑激酶(PIP5K),PIP5K 与BRX 相互作用,其靶向质膜有助于局部增强磷脂酰肌醇‑4,5‑二磷酸[PI(4,5)P2]的分布,共同形成一种自我增强调节模块[96-97]。PDK1 也是AGC 激酶家族的成员,通常充当上游信号来磷酸化和激活D6PK 和PAX 以调节PIN 的极性,被认为是AGC 激酶活性的主要调节因子[97-99]。综上所述,AGCIII 家族激酶在PIN 极性调节和生长素运输方面可能具有独立但部分重叠的作用。
4.2 参与调控PIN蛋白功能的其他蛋白激酶
除了AGC 激酶外,其他类型的蛋白激酶也参与调节PIN 的磷酸化。在拟南芥分枝的调控过程中,MKK‑MAPK 信号级联途径起着重要的调控作用。MKK7‑MPK6 磷酸化PIN1 的第337 位丝氨酸残基(S337)位点,影响PIN1 的细胞内分布和极性定位,进而调节极性生长素的运输[100]。PIN1‑HL 中的T227、T248 和T286 位于S1‑S3 属于PID 磷酸化位点TPRXS(N/S)基序的一部分,被MPK4 和MPK6磷酸化[101]。MAPK 级联信号传导途径是正常生长发育必需的,同时生物和非生物胁迫信号转导方面也被发现起着广泛的调控作用。因此,MAP 激酶调节生长素运输可能是植物适应胁迫的重要组成部分。
拟南芥编码的8 个钙相关蛋白激酶(CRK)大多定位在质膜并在体外磷酸化PIN 蛋白。CRK5 在表皮和皮层细胞PM 呈现为“U”形定位,在crk5突变体中,其他蛋白极性定位不受影响,但PIN2 在表皮细胞顶侧表达水平降低,皮层细胞从基底侧到顶侧定位转换[102-103]。CRK5 激酶通过磷酸化PIN1、PIN2 和PIN3 调节蛋白活性介导根向重力反应、顶端钩发育和调控胚胎发育过程[104-105]。
最近,质膜定位的受体样激酶(receptor like kinase, RLK)成为另一类在质膜处磷酸化PIN 蛋白的激酶。受体激酶CAMEL(CANALIZATION‑RELATED AUXIN‑REGULATED MALECTIN‑TYPE RLK)及其相互作用蛋白CANAR(CANALIZATION‑RELATED RECEPTOR‑LIKE KINASE)共 同 与PIN蛋白互作并磷酸化PIN。PIN1 中CAMEL 磷酸位点的突变影响其极性分布和运输, 从而表现出叶脉和维管损伤后的再生缺陷[106]。
4.3 多种蛋白磷酸酶参与调控PIN蛋白的功能
可逆磷酸化修饰影响植物PIN 蛋白的极性定位,从而改变生长素运输方向。与蛋白激酶相反,磷酸酶使PIN 蛋白去磷酸化。PP2A 磷酸酶是一种由支架亚基A、调控亚基B 和催化亚基C 组成的异源三聚体。PP2A 通过使PIN 蛋白去磷酸化来拮抗PID,二者共同决定PIN 蛋白的极性定位和转运活性[107]。近期研究表明,PP2A 的C 亚基能够与ABA受体PYR/PYLs 相结合,PP2A 的A 亚基直接与SA结合,以抑制PP2A 磷酸酶活性,从而调节PIN 蛋白的极性和根系发育[108-109]。有趣的是,PP2AA(PP2AA1‑PP2AA3)、SAL(SAPS domain‑like) 和FyPP1/3(PHYTOCHROME‑ASSOCIATED SERINE/THREONINE PROTEIN PHOSPHATASE1/3)之间相互作用形成PP6 异源三聚体全酶复合物。FyPP1/3、SAL 和PP2AA 与一部分PIN 蛋白相互作用,对于SAL,相互作用的强度取决于PIN 磷酸化状态。因此,PP6 通过拮抗PID,直接调节PIN 蛋白磷酸化促进PIN 蛋白基部定位,进而影响生长素极性运输和植物发育[110]。此外,PP1 家族一个成员,TOPP4(TYPE‑ONE PROTEIN PHOSPHATASE4) 与PID 拮抗调节PIN1 蛋白磷酸化,调控生长素在表皮细胞内外的极性分布,控制铺板细胞的形态建成[111]。
5 其他蛋白翻译后修饰参与调控PIN 的功能
5.1 PIN的氧化还原修饰
S‑亚硝基化(S‑nitrosylation),是一种基于氧化还原的蛋白质翻译后修饰,可通过改变蛋白的构象、稳定性、亚细胞定位、生物化学活性或蛋白质-蛋白质相互作用来调节蛋白的功能。细胞内蛋白S‑亚硝基化的水平是动态的,由一氧化氮(NO)水平和S‑亚硝基谷胱甘肽还原酶(GSNOR)和硫氧还蛋白(Trxs)催化的去亚硝基化调控[112-113]。GSNOR1 的缺乏通过一种未知机制抑制了PIN 的内吞作用。由于NO 也可以通过S‑亚硝基化调节蛋白质功能,因此NO 可能直接通过S‑亚硝基化PIN 或间接通过S‑亚硝基化内吞途径中的其他关键蛋白质调节PIN内化[114-115]。
5.2 PIN的寡聚(二聚化)
生长素转运由PIN 蛋白的亚细胞极性定位决定,但对于PIN 蛋白复合物组成和调控方面的分子机制尚不清楚。生物化学实验表明,PIN 核心复合体由PIN1、PIN2、PIN3、PIN4 和PIN7 的同源二聚体和异源二聚体组成(其中PIN1 同源二聚体最为普遍),生长素转运抑制剂和调节剂,如内源黄酮醇和NPA(N‑1‑naphthylphthalamic acid),稳定PIN1 二聚体,影响极性生长素运输,PIN1 胞质结构域的磷酸化可消除这种抑制作用[116-117]。最近的结构生物学证据表明,典型PIN1 和PIN3 蛋白以及非典型PIN8蛋白以对称性的同源二聚体方式组装,每个单体具有10 次跨膜螺旋,呈现出典型的NhaA 蛋白折叠方式,被分为支架(scaffold)结构域和转运(transporter)结构域。区别于PIN8 二聚体向胞外开放状态的构象,PIN1 呈现向细胞质侧开放的构象,同时,在胞质侧,还具有一个由β 折叠片组成的结构域[118-119]。PIN1的跨膜结构域共享一个保守的NhaA‑fold。在底物与PIN1 的复合物结构中,IAA 通过疏水堆积和氢键进行配位,抑制剂NPA 与IAA 以更高的亲和力竞争同一位点。PIN3 支架结构域中的跨膜螺旋1/2/7 参与二聚化,二聚化的PIN3 蛋白在二聚体界面形成一个面向胞外的腔,每个亚基都是面朝内的构象[120]。
PIN 处于内向开放状态时,细胞内的IAA 结合在内向开放口袋中,引起PIN 二聚体由内向开放状态向外向开放状态转换,IAA 被释放至细胞外。生长素运输抑制剂NPA 结合在底物结合位点,阻碍了IAA 的结合,同时抑制转运过程中PIN 的潜在构象变化,并使蛋白处于朝内侧开放的构象,抑制生长素极性运输。
5.3 Pin1At调控PIN1蛋白的构象
PIN 蛋白胞内结构域TPRXS 基序内的脯氨酸残基,可以发生顺式/反式丙酰基异构化。Pin1 肽基脯氨酰顺反异构酶(peptidylprolyl cis‑trans isomerase,PPIase)是生物体信号转导途径的关键调节因子,特异性识别磷酸化的S/T‑P 序列,催化其中的肽键发生顺反异构,从而改变相关蛋白质特性,包括稳定性、亚细胞定位、磷酸化状态、催化活性等[121]。拟南芥同源蛋白Pin1At 参与根的向重力性过程,Pin1At 过表达和pp2aa1 对增强根向重力缺陷表型具有协同作用,Pin1At 的下调抑制pp2aa1 和35S::PID的根向重力缺陷。Pin1At 催化PIN1 HL 中磷酸化Ser/Thr‑Pro 基序的顺式/反式构象变化,并影响PID和PP2As 介导的根冠柱细胞PM 中PIN1 的极性定位和生长素的转运,这与根向重力性的调节相关[122]。
6 PIN 蛋白的抑制剂
特异性抑制剂在生长素运输和PIN 蛋白转运生长素分子机制的探究中发挥了关键作用。抑草生(NPA)是经典的生长素转运抑制剂。研究发现,NPA 直接结合并抑制PIN 蛋白的转运活性,使膜对生长素的渗透性降低,抑制生长素外排并阻断生长素转运介导的植物反应。内源性黄酮醇可以稳定PIN 二聚体以调节生长素外排,其方式与NPA 相同。另一种经典的抑制剂,2,3,5‑三碘苯甲酸(TIBA),除了直接抑制PIN 介导的生长素运输外,也可通过干扰PIN 囊泡运输过程来破坏PIN 的膜定位。值得注意的是,有多种化合物被报道通过间接的途径影响PIN 蛋白在内膜系统的分布,例如褪黑素、ES4、BFA 和渥曼青霉素等。表1 对PIN 蛋白相关抑制剂进行了总结。
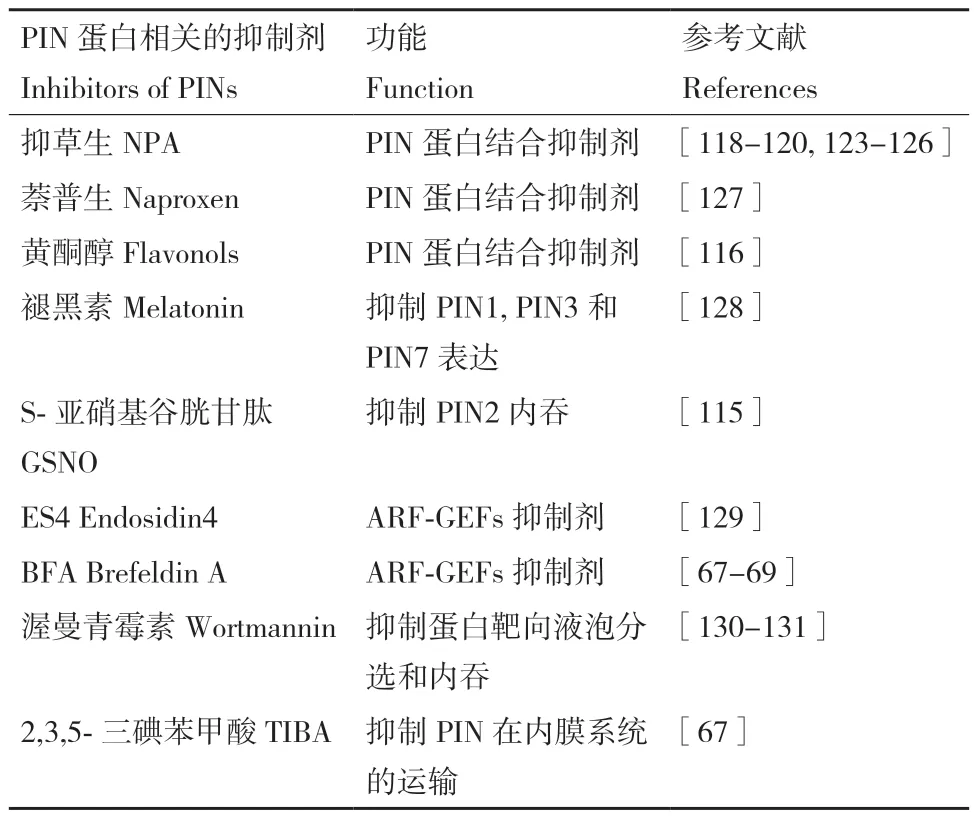
表1 PINs 蛋白相关的抑制剂Table 1 Related inhibitors of PINs
7 总结与展望
近几十年的研究表明,PIN 蛋白介导的生长素极性运输在受重力等环境刺激的器官中产生或维持生长素梯度方面发挥着不可或缺的作用。响应重力刺激后,PIN 的极性定位决定生长素流向的改变,从而形成一种将外部物理信号转化为生长素诱导的生长反应的机制。
通过20 多年来的分子遗传学和细胞生物学研究,已建立一个以PIN 蛋白为核心的生长素分布的模型。PIN 蛋白的调控发挥重要作用。PIN 在细胞内会经历分泌、回收或降解等过程,其中GNOM 起到回收PIN 的作用,且PIN 的磷酸化等翻译后修饰状态可以改变PIN 在内膜的分选并进而改变极性定位。尽管在PIN 介导的生长素极性运输调控方面已有较多的研究,但仍有一些重要的调控机制尚不清楚。例如,PIN 蛋白极化的关键决定因素、PIN 本身的细胞行为等。已知GNOM 或GNL1 负责PIN 的回收运输,但其他因素,如其他ARF 小G 蛋白和Rab 小G 蛋白在此过程中的作用仍待研究[132]。尽管组成型内吞循环和GNOM 介导的极性循环的模型与多种生物过程中的PIN 极化变化一致,但该模型仅来源于BFA 处理实验,并且尚未在正常条件下观察到这些过程。在磷酸化和去磷酸化方面,该模型缺乏直接证据来确定磷酸化状态对于PIN 极性定位还是转运活性的影响起主导作用。最近一项研究表明,PID可能并不能被简单地认为通过磷酸化PIN 蛋白而参与生长素途径和花的发育,而是通过更为复杂的方式参与到PIN 介导的生长素运输中,相关的分子机制有待于更加深入的研究[133]。此外,还有许多其他相关因素没有纳入该模型,例如,泛素化修饰的PIN 是否被导向液泡进行降解,脂质如PI4P、PI(4,5)P2和PA 的分布是否可以影响PIN 的定位,生长素通过胞间连丝的转运如何与PIN 介导的转运进行协作等[134-137]。
植物通过PIN 极性转换或通过改变PIN 运输途径来调节PIN 蛋白丰度的信号通路和机制仍然不完全清楚。利用遗传学、生物化学、先进成像手段和其他尖端技术的多学科方法将有助于未来的研究,以便更好地理解植物向重力反应中PIN 的极性调控。
