植物褪黑素:植物应答非生物胁迫的新兴信号分子
2024-04-17周宏丹罗晓萍涂米雪李忠光
周宏丹 罗晓萍 涂米雪 李忠光
(云南师范大学生命科学学院 生物能源持续开发利用教育部工程研究中心 云南省生物质能与环境生物技术重点实验室,昆明 650500)
褪黑素(melatonin, MT)是一种新兴的植物激素,与传统五大类植物激素生长素(auxin, IAA)、赤霉素(gibberellin, GA)、细胞分裂素(cytokinin,CTK)、乙烯(ethylene, ETH)和脱落酸(abscisic acid, ABA)相比,其鉴定仅有20 多年的历史。从化学结构上讲,MT 是一种色氨酸衍生物,化学名称为N‑乙酰‑5‑甲氧基色胺,是广泛存在于动植物体内的小分子吲哚胺类物质。1958 年Lerner 等[1]从牛的松果体中分离提取出了该物质,认为它是一种对动物生理活动具有调节作用的神经激素。随后的1993 年,van Tassel 等[2]采用放射性免疫分析法和气相色谱-质谱联用的方法,也从牵牛花(Ipomoeanil L.)和番茄(Solanum lycopersicum L.)中检测到MT。接着,1995 年,利用放射性免疫分析法,科学家从24 种食用植物中也分离到MT,并发现MT 浓度具有物种和器官特异性[3-4]。直至2004 年,为区别于动物MT,Blask 等[5]将植物中的MT 命名为植物褪黑素(phytomelatonin)。从生理功能上来说,MT 与其他植物激素相似,它不仅调控种子萌发和根系构型[6],也调节昼夜节律、光周期及生物和非生物胁迫耐性[7-8]。随着研究的深入,发现MT 在正常生理条件下,其在植物体内的含量很低,一般为pmol/g鲜重到nmol/g 鲜重[9],但在高温、低温、干旱、盐渍、重金属、紫外辐射和水涝等逆境胁迫下,MT 的含量可增加上百倍,继而引发MT 信号,增强植物对这些逆境胁迫的抵抗能力[7-9]。
一般认为,MT 是一种多效性的信号分子,在植物应答逆境胁迫中扮演着新的角色。MT 既可以作为活性氧(reactive oxygen species, ROS)清除剂,直接清除ROS;也可通过激活抗氧化系统和渗透调节系统,维持细胞的氧化还原平衡[9]。众所周知,逆境胁迫可导致细胞中ROS 的产生速率大于其清除速率,继而氧化损伤膜脂、蛋白质、DNA 等生物大分子[10-11]。相应地,MT 可通过直接清除ROS 或激活抗氧化系统,缓解ROS 引发的氧化胁迫[12]。此外,逆境胁迫可诱发渗透胁迫,导致植物细胞缺水。在此过程中,MT 一方面可积累脯氨酸(proline, Pro)等渗透调节物质,继而保持原生质与环境的渗透平衡和细胞膜结构的完整性,减轻胁迫造成的光抑制;另一方面,MT 可调节抗逆相关基因(HSFA1s、LpTDC1、SLTDC1、SNAT1、ASMT 和COMT 等)的表达,提高逆境蛋白的水平,实现植物耐逆性的提高[12]。此外,MT 也可与其他信号交互作用,激活多重保护系统,从而保护植物免受胁迫伤害[13-15]。研究表明,MT 与钙(Ca2+)、ABA、GA、多胺(polyamine,PA)、一氧化氮(nitric oxide, NO)和H2S(hydrogen sulfide, H2S)等信号分子之间存在级联[13-15],但确切的机理尚未完全清楚。
20 多年来,MT 代谢及其在植物应答非生物胁迫方面的生理功能更加明晰,取得了可喜的进步。因此,本文基于MT 在植物中的最新研究进展,概述了MT 在植物中的代谢及亚细胞定位,归纳其在植物应答高温、低温、干旱、盐渍、重金属、紫外辐射和水涝等非生物胁迫中的作用,为深入理解MT的信号作用奠定了理论基础。
1 MT 代谢
植物中MT 的代谢包括合成代谢和分解代谢,二者分述如下。
1.1 MT合成代谢
相对而言,MT 在哺乳动物、两栖动物、鸟类等脊椎动物中的合成途径较为清楚[16],其在动植物中的合成具有许多相似之处,仅在反应顺序、合成酶和中间产物等方面存在差异。由于植物自身可合成MT 的前体色氨酸(tryptophan, Trp),所以其合成途径比动物中更为灵活[17-18]。一般认为,MT 可在植物细胞的叶绿体、细胞质和线粒体中合成,至少涉及4 个步骤、5 条途径和6 个关键酶(图1)。
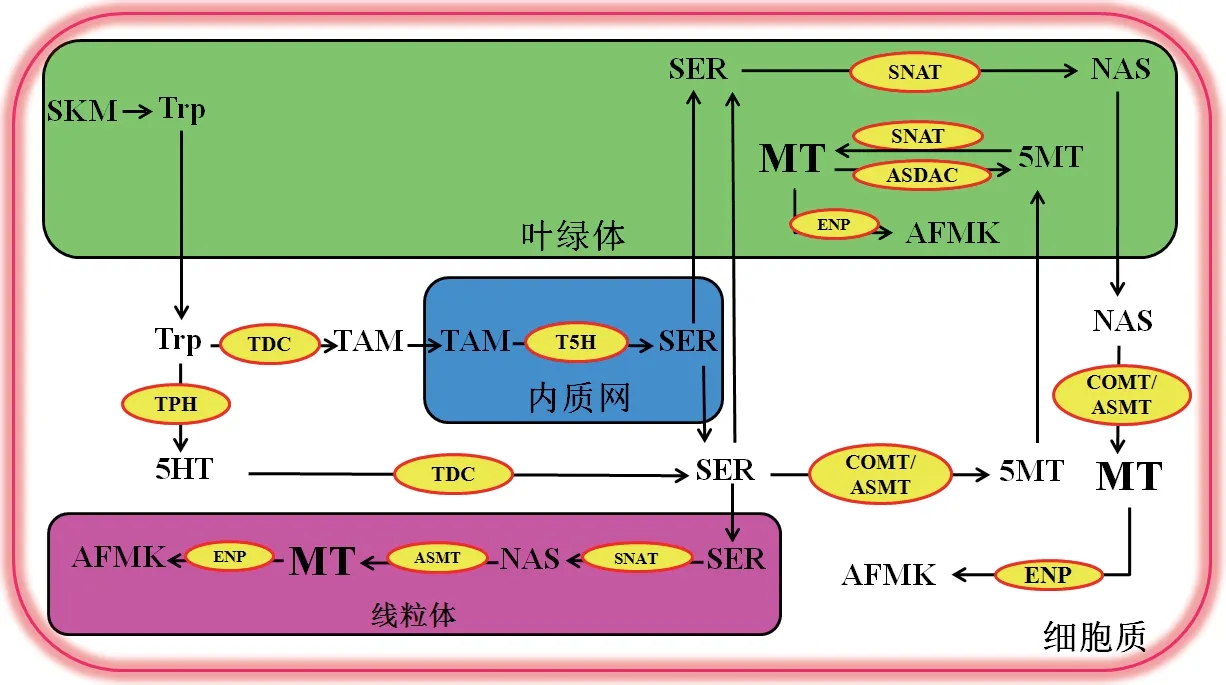
图1 植物中褪黑素的合成途径Fig.1 Biosynthetic pathway of melatonin in plants
利用同位素标记法,Murch 等[19]从贯叶连翘(Hypericum perforatum cv.)中检测到MT 合成的主要前体物质Trp,从此掀起了植物中MT 生物合成的研究热潮。一般认为,MT 合成的4 条途径都以5‑羟色胺(serotonin, SER)作为中间体,整个合成过程中包括4 个连续的酶促反应。在正常情况下,在叶绿体中,植物可以通过莽草酸(shikimate, SKM)途径合成Trp。Trp 进入细胞质后,在Trp 羟化酶(tryp‑tophan hydroxylase, TPH)的作用下转化成5‑羟色氨酸(5‑hydroxytryptophan, 5HT),但至今植物中并未克隆到TPH。接着,5HT 经Trp 脱羧酶(tryptophan decarboxylase, TDC)作用生成SER,并且Zhao 等[20]在牡丹(Paeonin lactiflora Pall.)中发现TDC 是MT合成代谢的限速基因。此外,Kang 等[21]在水稻(Oryza sativa L.)探索到MT 合成代谢第一步的产物是色胺(tryptamine, TAM)而不是5HT,而第二步则是色胺在色氨酸‑5‑羟化酶(tryptophan‑5‑hydroxy‑lase, T5H)的作用下转化成SER。催化这两个步骤的酶TDC 和T5H 分别在细胞质和内质网中,因此Trp 到SER 的生物合成途径是从叶绿体开始,并在内质网中结束。SER 在芳香族氨基酸脱羧酶(aromatic L‑amino acid decarboxylase, AADC)或TDC 催 化 下生成TAM。随后,TAM 在5‑羟色氨‑N‑乙酰转移酶(serotonin N‑acetyltransferase, SNAT)的催化作用下乙酰化为N‑乙酰‑5‑羟色胺(N‑acetylserotonin,NAS)[22]。厚皮刺果松(Pinus taeda)和拟南芥(Arabidopsis thaliana)的SNAT 定位于叶绿体中,而咖啡酸‑O‑甲基转移酶(caffeic acid O‑methyltrans‑ferase, COMT)则定位于细胞质中[23]。在条斑紫菜(Pyropia yezoensis)中,由于SNAT 缺少N 端叶绿素转运蛋白,而定位于细胞质中[24]。所以,在细胞质中,NAS 在N‑乙酰血清素甲基转移酶(N‑acetylserotonin methyltransferase, ASMT)和COMT 的催化下合成MT[25-26]。此外,SER 也可先在COMT/ASMT 催化下合成5‑甲氧基色胺(5‑methoxytryptamine, 5MT),再在叶绿体中经SNAT 作用生成MT。利用激光共聚焦显微镜观察到水稻ASMT 位于细胞质中[27]。虽然植物线粒体、细胞质和叶绿体中都可合成MT,但大部分情况下主要在叶绿体中合成,特别是在逆境胁迫条件下和高SER 含量的情况下[28]。
1.2 MT分解代谢
关于MT 合成代谢的研究较为丰富,但分解代谢却鲜有报道,其代谢机制尚未完全清楚[29]。尽管植物与动物的MT 分解代谢物类似,但过程是否相同,尚未完全证实[28]。目前认为,MT 主要通过酶促、非酶促和假酶促反应(enzymatic, non‑enzymatic, and pseudoenzymatic reaction, ENP)3 种途径进行降解,其降解的共同产物是N1‑乙酰基‑N2‑甲酰基‑5‑甲氧基 犬 尿 酰 胺(N1‑acetyl‑N2‑formyl‑5‑methoxykynuram‑ine, AFMK)[30-32](图1)。Tan 等[30]在水葫芦(Ei‑chhornia crassipes(Mart.)Solms)中鉴定到第一种MT 代谢产物AFMK,且吲哚胺2, 3‑双加氧酶(in‑doleamine 2, 3‑dioxygenase, IDO)与AFMK 的含量有关。同时,在此实验中也检测到另一种代谢产物N1‑乙酰基‑5‑甲氧基犬尿酰胺(N1‑acetyl‑5‑methoxyky‑nuramine, AMK)。研究发现,过表达IDO 会导致MT含量的降低;水稻中也证实IDO 可催化MT 分解代谢产生AFMK[31]。此外,MT 与超氧阴离子(super‑oxide anion, O2·-)的非酶促反应,以及MT 与细胞色素c(cytochrome c, Cyt c)或血红蛋白(hemoglobin,HB)的假酶促反应,均可产生AFMK[31]。研究发现,AFMK 和AMK 均已被证明具有保护细胞的作用,且AMK 是ROS 的有效清除剂[32]。
一般认为,MT 的分解既发生在细胞质,也发生在叶绿体中[33]。MT 的主要代谢产物2‑羟基褪黑素(2‑hydroxymelatonin, 2‑OHM),可保护植物免受多种非生物胁迫,在植物响应非生物胁迫的保护作用甚至比MT 更有效[34-36]。在水稻中2‑OHM 的合成酶褪黑素2‑羟化酶(melatonin 2‑hydroxylase,M2H)已经成功被鉴定和克隆[37]。MT 的其他主要代谢产物4‑羟基褪黑素(4‑hydroxymelatonin, 4‑OHM)和6‑羟基褪黑素(6‑hydroxymelatonin, 6‑OHM)相较于MT 的水平较低[38]。此外,在植物中还发现了一种新的MT 代谢产物环‑3‑羟基褪黑素(3‑hydroxyme‑latonin, c3OHM),其由褪黑素3‑羟化酶(melatonin 3‑hydroxylase, M3H)催化MT 产生[39]。虽然c3OHM在植物中的作用未完全清楚,但如果编码M2H 的基因表达受到抑制,发现c3OHM 的生成量显著提高,这表明c3OHM 与MT 代谢存在潜在关联[40]。目前,关于植物MT 分解代谢途径的研究仍处于早期阶段,有待于进一步探索。
2 MT 应答非生物胁迫
如上所述,MT 作为一种新兴的植物信号分子,不仅调节植物生长发育,还应答逆境胁迫。此部分主要讨论MT 在植物应答高温、低温、干旱、盐渍、水涝、重金属、紫外辐射等逆境胁迫中的作用(图2)。
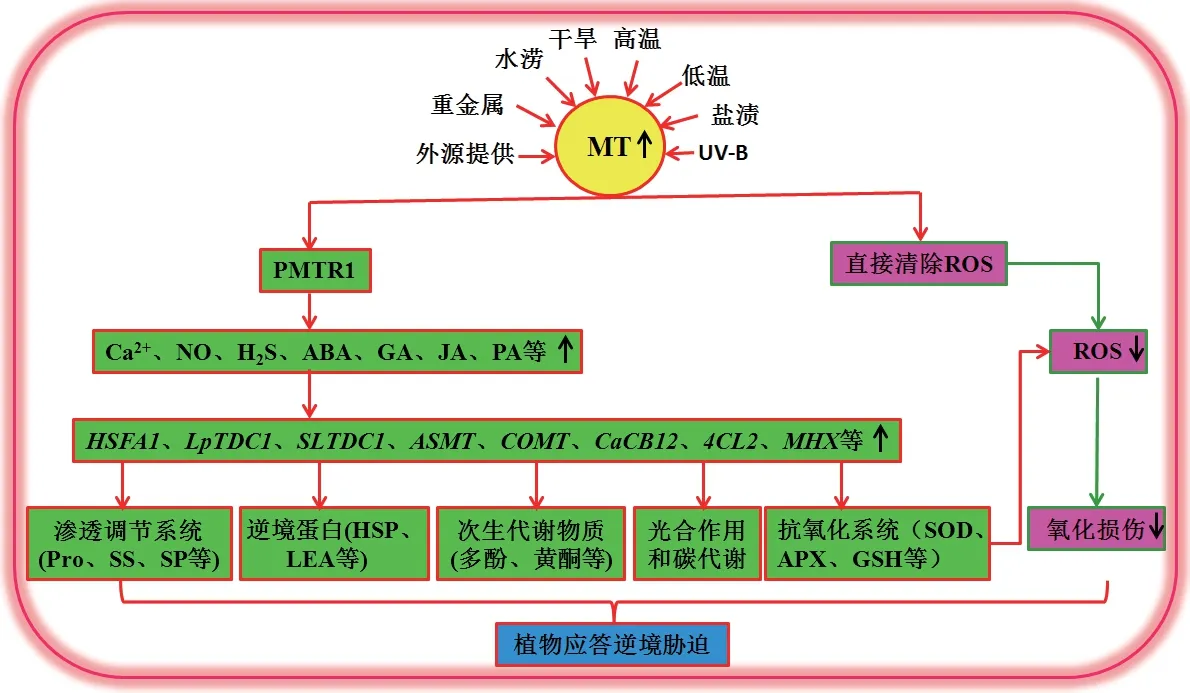
图2 植物褪黑素在植物应答非生物胁迫中的作用Fig.2 Role of phytomelatonin in plant response to abiotic stress
2.1 MT应答高温胁迫
由于全球气候变暖,高温胁迫对农业生产造成的损失逐年增加。如何提高植物对高温胁迫的抵抗能力,已成为亟待解决的问题。高温胁迫会导致植物体内ROS 爆发,即ROS 的过量积累,破坏植物固有的防御系统,造成细胞膜损伤,阻碍蛋白质合成和细胞分裂,从而影响植株生长[41]。高温胁迫可提高内源MT 水平,引发MT 信号,继而通过与Ca2+、ABA、GA、PA、NO 和H2S 等信号交互作用,改善植物对高温的抵抗能力(图2)。
MT 可提高植物的耐热性。MT 不仅是一种有效的ROS 清除剂,也可作为信号分子启动抗氧化系统的活力,继而保持细胞的氧化还原平衡。Li等[42]提出MT 可通过调节玉米抗氧化系统、甲基乙二醛解毒系统及渗透调节系统的活力,提高玉米(Zea mays L.)幼苗的耐热性。此外,对高温胁迫下的生菜(Lactuca sativa L.)喷施MT,发现丙二醛(malondialdehyde, MDA)含量减少,而超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)活性提高,暗示外源MT 能够有效提高抗氧化系统的活力[43]。类似地,MT 也可削弱光系统II(photosystem II, PSII)在供体侧和受体侧每个光化学反应中心(photochemical reaction center,RC)的电子转移效率,增加单位横截面积的RC 数量,提高抗氧化系统的活力,防止PSII 的氧化损伤,从而减轻高温造成的植株损伤[44]。
此外,MT 可与其他信号交互作用,提高植株的耐热性。热激转录因子(heat shock factors,HSFs)是调控植物细胞热激响应基因转录的关键因子,MT可上调热激因子的表达,介导植物热激反应。研究发现,MT 可上调A1 类热激因子(HSFA1s)的转录,热激蛋白基因HSP90 和HSP101 的表达,有助于MT 介导的拟南芥耐热性的提高[45]。而后,徐晨潇等[46]从黄瓜(Cucumis sativus)幼苗中发现MT 和Ca2+的交互作用可上调HSF7、HSP70.1 及HSP70.11的表达,减少ROS 的积累,从而减轻高温引起的植株过氧化损伤。此外,高温胁迫可提高植物内源ABA 水平,但过量的ABA 会导致叶片衰老。高温胁迫可上调MT 生物合成基因(LpTDC1、LpTDC2、LpCOMT1、LpASMT1 和LpASMT3)、ABA 分 解 代 谢基因LpABA8Ox1 和GA 生物合成基因(LpGA20ox1和LpGA3ox)的表达,继而增加MT 和GA 水平,降低ABA 含量,抑制叶片衰老[47]。Iqbal 等[48]发现MT 与H2S 在抵御高温胁迫的过程中存在交互作用,高温胁迫下,MT 不仅通过提高抗氧化酶的活性来减轻氧化胁迫,还可提高植物的光合作用和碳水化合物代谢,而这些生理过程可被H2S 介导。类似地,MT 还可通过调节硝酸还原酶(nitrite reductase, NR)和一氧化氮合酶(nitric oxide synthetase, NOS)的活性,提高植物内源PA 和NO 水平,减轻高温胁迫对番茄幼苗的损伤[49]。
2.2 MT应答冷胁迫
冷胁迫是影响植物生长发育的重要环境因子。低温胁迫会导致绿叶枯萎、抑制光合作用、破坏细胞膜、降低结构蛋白和功能蛋白的活性,从而引起细胞代谢紊乱,对植物造成伤害[50]。MT 处理,可促进冷胁迫下冷响应相关基因的表达,提高植株抗氧化系统的活力,缓解冷胁迫造成的损伤(图2)。
MT 可提高植物的耐冷性。冷胁迫可使ROS 过量积累,打破植物细胞氧化还原平衡,造成氧化损伤。MT 处理可增加SOD、CAT、抗坏血酸过氧化物酶(ascorbate peroxidase, APX)和谷胱甘肽还原酶(glutathione reductase, GR)等抗氧化酶活性,从而降低ROS 水平,减轻脂质过氧化[51]。外源MT 处理,一方面可提高香蕉(Musa acuminate L.)果实中磷脂和不饱和脂肪酸的含量,诱导ROS 清除酶的活性,减轻氧化胁迫;另一方面,可下调MaPPO1、MaPPO2 和MaPPO3 的表达,抑制多酚氧化酶(polyphenol oxidase, PPO)活性,从而减轻冷害引起的果皮褐变[52]。此外,MT 也可通过提高琥珀酸脱氢酶(succinate dehydrogenase, SDH)和细胞色素氧化酶(cytochrome oxidase, CCO)等与能量代谢相关的酶的活性来缓解冷害[53]。外源喷施MT,可通过提高过氧化物酶(peroxidase, POD)活性及可溶性糖(soluble sugar, SS)含量,缓解低温胁迫伤害[54]。在辣椒(Capsicum annuum L.)中,外源MT 不仅能激活叶片抗氧化系统活力,也可增加苗期和开花期Pro含量,维持细胞渗透压,减少细胞膜质过氧化,进而缓解因冷胁迫导致的损伤[55]。
MT 除抗氧化和抗渗透胁迫外,还可通过调节光合作用相关基因的表达,以及与其他植物激素的交互作用,以此应答冷胁迫。外源MT 可上调光合色素合成相关基因(CaCB12、CaCAB4、CaCAB7、CaCAB8、CaCAB21 和CaCAB37)的表达,继而提高光合效率[56-57]。如上所述,色氨酸脱羧酶基因1(SlTDC1)是MT 生物合成的第一个限速基因,参与各种非生物胁迫下光合作用的调节。在低温胁迫下,过表达SLTDC1 可提高番茄光合作用[58]。此外,MT也可通过降低ABA 含量,增加GA/ABA 比值来促进低温胁迫下黄瓜种子的萌发[59]。
2.3 MT应答干旱胁迫
干旱胁迫影响植物整个生活史。当植物遭受干旱胁迫时,会对其代谢和发育等多个生理过程产生不同程度的影响,甚至导致植物死亡。研究表明,MT 可通过增强抗氧化酶活性,上调与植物细胞分裂、光合作用、有机物代谢、脂肪酸合成及抗坏血酸代谢的基因表达,来提高对干旱胁迫的抵抗能力[60](图2)。
MT 可提高植物耐旱性。干旱胁迫下,MT 处理可调节抗逆相关基因的表达,实现植株抗旱能力的增强[61]。在苹果(Malus baccata Borkh.)中,上调MT 合成基因MdTDC1、MdAANAT2、MdT5H4 和MdASMT1 的表达,能有效地维持干旱条件下的水分平衡[62]。更有趣的是,Wei 等[63]在拟南芥中鉴定到第一个MT 受体CAND2/PMTR1。随后,在拟南芥中过表达ZmPMTR1,可诱导气孔关闭,从而减少水分散失,提高植物对干旱胁迫的耐受性[64]。MT 还可通过维持低水平的过氧化氢(hydrogen peroxide, H2O2),减轻干旱胁迫对光合作用和细胞膜的氧化损伤[65]。类似地,外源MT 能显著降低甜菜(Beta vulgaris L.)的电解质渗漏率(rate of electrolyte leakage, REL)和MDA 含量,提高SS、胚胎晚期丰富蛋白(late embryogenesis abundant, LEA)、可溶性蛋白质(soluble protein, SP)和游离Pro 水平,维持细胞稳态[66]。然而,MT 对根部POD 和SOD 活性没有显著影响,但可进一步提高干旱植株根部CAT活性,暗示抗氧化酶间的协同作用。在干旱胁迫下,MT 可通过促进主根和侧根的生长、气孔开放,从而增强光合作用,提高油菜(Brassica nupus L.)的抗旱性[67]。总的来说,MT 可直接清除H2O2,或通过增强抗氧化酶活性,间接清除ROS,这两种机制协同作用,改善气孔运动,继而提高抗旱性。
MT 也与其他植物激素交互作用,提高植物干旱胁迫耐性。MT 不仅可增加茉莉酸(jasmonic acid,JA)的含量,还可上调与木质素合成相关基因(4CL2、P5CS1 和CCR2)及淀粉和蔗糖代谢相关基因(PME53和SUS4)的表达[68],从而增强小麦的抗旱性。一般认为,ABA 在植物抗旱性中起关键作用,水分亏缺可增加ABA 的合成,进而导致气孔关闭。MT 预处理可选择性下调ABA 合成基因MdNCED3,上调ABA 分 解 代 谢 基 因MdCYP707A1 和MdCYP707A2,从而提高干旱敏感的湖北海棠(Malus hupehensis Rehder.)的耐旱性[62]。
2.4 MT应答盐胁迫
由于不合理灌溉及过度施肥导致的土壤盐分增加,产生盐胁迫。盐胁迫会导致植物胞内离子失衡、渗透压增大、ROS 过度积累等次级胁迫,抑制细胞分裂和生长,导致茎叶发育不良,从而抑制农作物的生长发育[69]。MT 作为抗氧化剂,可清除盐胁迫产生的过量ROS,也可通过调节抗氧化系统相关基因的转录水平,提高抗氧化酶CAT、POD 和SOD 的活性来清除ROS[70]。这些有助于维持细胞膜的稳定性和完整性,减轻细胞膜损伤,并从盐胁迫中恢复。
MT 可提高植物的耐盐性。如上所述,MT 被认为是一种有效的内源性自由基清除剂[71]。盐胁迫下,MT 可促进苜蓿(medicago sativa L.)光合色素的合成,直接影响光合速率;同时提高Pro 和SP 含量,减轻渗透胁迫,降低MDA 含量,缓解因膜脂过氧化造成的膜损伤[72]。此外,MT 可调节盐胁迫下ABA和GA 相关基因(GhABF2、GhDPBF2、GhGID1C 和GhGIDIB)的表达,来提高棉花(Gossypium hirsutum L.)种子的耐盐性[73]。类似地,盐胁迫可上调MT 合成相关基因(SNAT1、ASMT 和COMT)的表达,提高盐芥(Eutrema salsugineum)中的MT 水平[74]。研究还发现,盐胁迫下,经MT 引发的朝天椒,其根、茎和叶中K+含量显著降低,缓解盐胁迫对植株的伤害,其中100 μmol/L MT 引发效果最好[75]。
类似地,MT 常与其他信号分子相互作用,调节植物体的氧化还原平衡,提高植物抗盐性。MT 可提高L‑/D 半 胱氨酸脱巯基酶(L‑Dcysteine desulfhydrase, L‑/DCD)的活性,诱导H2S 产生,从而调节光合效率和抗氧化酶基因的表达,提高抗氧化酶活性,缓解盐胁迫下ROS 爆发[13]。此外,MT 可与NO、H2S 和分裂原活化蛋白激酶(mitogen‑activated protein kinase, MAPK)信号级联,诱导植物的耐盐性[14,71,76]。
2.5 MT应答重金属胁迫
农田土壤重金属含量过高,是限制作物生长发育的重要胁迫因子之一。重金属污染物主要包括镉(Cd)、镍(Ni)、铜(Cu)、铅(Pb)、铝(Al)、砷(As)和铬(Cr)[77]。重金属胁迫会扰乱植物的光合作用、呼吸作用、新陈代谢和激素调节等生理过程,导致细胞代谢失调[78]。研究表明,MT 可降低重金属在根部的积累,调节激素信号传导途径,平衡矿质营养,增强抗氧化系统的防御能力,从而减轻重金属离子对植物的毒害作用[79]。
MT 可提高植物重金属胁迫耐性。MT 处理可增强抗氧化酶活性,清除ROS 的积累,从而减轻植物脂质和蛋白质的氧化损伤,缓解Al 的毒害作用[80]。MT 不仅可通过激活抗氧化系统,上调抗坏血酸-谷胱甘肽(ascorbate‑glutathione pathway, AsA‑GSH)循环相关基因的表达,调节Pro 和次生代谢物(secondary metabolites, SM)的水平,继而提高辣椒对重金属的耐受性[81]。此外,MT 和独脚金内酯(strigolactone,SL)协同作用,可通过调节抗逆相关基因的转录,诱导抗氧化系统和甲基乙二醛脱毒系统活力,减轻Cr 对番茄的毒害作用[82]。
同样地,外源MT 可提高植物对Cd 的吸收、运输和解毒相关基因(HA7、NRAMP1、NRAMP3、HMA4、PCR2、NAS1、MT2、ABCC1、MHX)的表达,从而减少苹果植株地上部分对Cd 的积累,减轻Cd的毒害[83]。类似地,外源MT 还通过上调重金属转运蛋白基因,如ABC 和PCR2 的表达,减轻拟南芥中Cd 的积累[65]。说明在重金属胁迫下,MT 一般以提高抗氧化系统活力和减少植物细胞积累重金属的方式,来保护植物免受重金属胁迫。
2.6 MT应答紫外辐射和水涝胁迫
MT 可缓解紫外辐射对植物的伤害。长期的紫外辐射(ultraviolet‑B, UV‑B)会产生自由基,导致植物细胞膜脂过氧化,对植物造成伤害。如上所述,MT具有清除自由基的能力,保护细胞免受伤害(图2)。在UV‑B 胁迫下,MT 能有效减少ROS 的积累,保护细胞膜和光合色素的完整性,减少细胞的死亡[84]。此外,UV‑B 辐射还可通过上调MT 合成基因(SNAT、COMT 和ASMT)来改变内源MT 水平[85],进而调节谷胱甘肽过氧化物酶2(GPX2)和谷胱甘肽过氧化物酶7(GPX7)基因的表达来缓解UV‑B 损伤[86]。
类似地,MT 可提高植物的耐涝性。在强降雨和排水较差的地区,涝害是一种主要的非生物胁迫因子。MT 可通过提高光合色素含量,促进气孔运动,提高PSII 的电子传递效率来增强花椒(Zanthoxylum armatum)的光合作用[87]。此外,MT 处理的猕猴桃(Actinidia chinensis var.),可提高根部γ-氨基丁酸(γ-aminobutyric acid, GABA)和Pro 的含量,有助于提高植物的耐涝性[88],暗示MT 与氨基酸代谢的交互作用。
3 总结与展望
虽然MT 在植物体内含量较低,但其作为一种多效性的新兴植物信号分子,不仅在种子萌发、气孔运动、光合作用、植物生长和发育中起着关键的调节作用,而且在增强植物抗性方面的作用也已得到广泛的认可。就目前的研究来看,几乎所有的逆境胁迫和外源提供,都可促进植物细胞中MT的积累,引发MT 信号,继而提高植物对高温、低温、干旱、盐渍、重金属、紫外辐射、水涝等逆境胁迫的抵御能力[8]。总的来说,MT 可通过多种机制赋予植物抵御非生物胁迫的能力,主要表现在以下几个方面:(1)MT 可作为ROS 清除剂和/或信号分子,通过调节抗氧化系统的活力,清除逆境胁迫中植物过量积累的ROS,降低MDA 含量,减轻因膜脂过氧化造成的细胞损伤,维持细胞的氧化还原平衡;(2)MT可提高Pro、SS、LEA 和SP 等渗透调节物质的含量,通过细胞渗透调节,减轻渗透胁迫伤害;(3)MT 可上调逆境胁迫相关基因表达,促进植物在逆境胁迫条件下次生代谢物的合成,维持代谢平衡;(4)MT可通过调节转运蛋白(如离子转运器和重金属转运蛋白)的表达和活力,减轻盐、重金属的积累,以此缓解金属离子的毒害作用;(5)MT 可通过与其他信号分子如Ca2+、NO、H2S、ABA、GA、JA、PA 等的交互作用,上调逆境胁迫响应基因的表达,提高植物的胁迫应答和适应能力。
总之,近年来MT 在植物生物学方面的研究,取得了较大的进展,但仍有许多未知的地方需要继续阐明。虽然目前已初步明确MT 可在细胞质、叶绿体、线粒体中合成,但其代谢途径及亚细胞定位,特别是分解代谢,尚未完全清楚。MT 与其他信号分子如Ca2+、H2S、NO、ABA、GA、JA、糖等在植物应答非生物胁迫过程中的交互作用,虽已有初步报道[89-91],但它们形成的信号网络及交互作用的机理,仍有待补充和完善。虽然Wei 等[63]在拟南芥中,已鉴定到第一个定位于质膜的MT 受体CAND2/PMTR1,但MT 作为两亲分子可透过生物膜,胞内及其他细胞器中是否存在其受体,仍待探究。MT 从种子萌发到植物衰老,皆具有广泛的生理作用,但相对于其他激素,其在植物生长发育和应答逆境胁迫中的生理、生化及分子机理,有待于用生理、生化、分子、组学和多组学的手段进一步解析。
