氧化应激在慢性阻塞性肺疾病中的生物标志物研究及中药预测*
2024-04-16朱金燕胡华鹏云艳娇刘明
朱金燕,胡华鹏,云艳娇,刘明
1 云南中医药大学 云南昆明 650500
2 昆明市中医医院 云南昆明 650011
慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease,COPD)简称慢阻肺,是一种复杂的呼吸系统疾病,以气流受限不完全可逆、气道慢性炎症及肺气肿破坏为主要特征,且与吸入有害颗粒或气体及异常炎症反应有关[1]。现COPD以药物治疗为主,如糖皮质激素、祛痰药及支气管扩张药等,然而临床疗效并未令人满意,且具有容易引起不良反应,如感染和免疫抑制[2],故进一步明确发病机制,寻找新的干预手段是必要的。COPD属于中医“肺胀”范畴,作为一种进行性发展疾病,中医中药在改善患者肺功能、减轻临床症状、控制炎症反应、提高生活质量等方面有较好的疗效与优势[3-4]。
氧化应激是指体内氧化与抗氧化失衡的一种状态,以氧化为主导,可导致细胞功能障碍和组织损伤[5]。吸烟作为引起COPD最常见的危险因素,香烟烟雾是诱发患者气道内氧化应激的主要原因。烟雾中的氧化剂会分解肺部结缔组织,致肺泡支架结构破坏,出现肺气肿[6];此外氧化剂还可通过损害肺泡巨噬细胞的吞噬能力来延迟炎症的消退[7]。近年来越来越多的研究强调了氧化应激在各种疾病发生发展中的重要性[8-10]。但针对COPD中的氧化应激差异基因的研究较少,基于此本研究综合运用生物信息学分析,探索氧化应激对COPD的发展作用,同时鉴定中心基因和治疗中药,以对疾病的诊疗提供新的见解。
材料与方法
1 数据下载与预处理
从基因表达综合数据库GEO(https://www.ncbi.nlm.nih.gov/geo/)下载COPD系列矩阵文件及平台文件,选取基因集GSE10006作为实验组,基因集GSE76925作为验证组。数据集具体信息见表1。

表1 GEO数据集具体信息
2 获取氧化应激差异表达基因
使用R语言中的“limma”包,设置adj.P value<0.05,|logFC|>1.0,筛选疾病组与正常组间的差异表达基因(DEG)。同时,从GeneCards数据库获取氧化应激基因,保留Relevance score≥7的基因。最后,计算两者交集确定氧化应激差异表达基因(DEOSGs)。
3 富集分析
使用R语言的“org.Hs.eg.db”及“clusterProfiler”包对1.2中得到的DEOSGs分别进行基因本体(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。选择从MSigDB数据库(http://www.gseamsigdb.org/gsea/downloads.jsp)下载的“c2.cp.kegg.v7.5.1.entrez.gmt”和“c5.bp.v7.5.1.entrez.gmt”子集合作为参考基因集进行基因集变异分析(Gene Set Enrichment Analysis,GSEA)分析,设置排列检验1000次,P<0.05。
4 蛋白互作网络
将DEOSGs导入String数据库(https://stringdb.org/)构建蛋白互作网络(PPI)。使用Cytoscape软件(版本3.9.1)中的CytoHubba插件、MCODE插件获得候选中心基因;其中CytoHubba采用MCC算法,MCODE使用了默认参数(Degree Cutoff=2、Node Score Cutoff=0.2、K-Core=2和Max Depth=100)。
5 中心基因鉴定
基于验证组评估候选中心基因的准确性;使用“limma”包对候选基因进行差异分析,结果以P<0.05为标准;同时使用R中“pROC包”分析受试者工作特征曲线(receiver operating characteristic curve,ROC),评估候选基因在COPD诊断中的作用,以曲线下面积(Areas Under Curve,AUC)>0.65为标准。评估两者结果确定中心基因。
6 免疫浸润分析
运用CIBERSORT(https://cibersort.stanford.edu/)进行分析,采用反卷积算法处理标记基因表达值,设置P<0.05,评估正常和COPD肺组织中22种免疫细胞的比例。
7 中心基因与免疫细胞的相关性分析
为了进一步明确中心基因与免疫细胞的关系,我们运用R语言中的 “ggExtra”和“ggpubr”包,设置P<0.05,进行中心基因的表达与免疫细胞相对比例的相关性研究。
8 中药预测
通过Coremine(https://coremine.com/medical/)数据库对中心基因进行中药预测,设置P<0.05。并用Cytoscap 3.9.1构建“靶点-中药”网络。使用《中国药典》2020年版对预测中药进行性味、归经统计整理,并将结果使用雷达图展示。
结果
1 DEGs与DEOSGs获取
共获得104个DEGs,其中上调基因65个,下调基因39个,根据校正后的P值,将差异程度较大的前25个上调和下调基因用热图展示(图1A),并通过火山图展示所有差异基因(图1A)。从GeneCards数据库获得824个氧化应激基因,通过韦恩分析得到13个氧化应激差异表达基因(图1C),其中上调基因9个,下调基因4个(图1D)。

图1 DEGs与DEOSGs相关结果A:DEGs的聚类热图;B:DEGs分布火山图;C:维恩图,显示DEOSGs;D:DEOSGs分布火山图
2 富集分析结果
为了分析差异表达的氧化应激基因的潜在生物学功能,我们进行了GO、KEGG富集分析。总共富集到816个生物过程(BPs),21个细胞成分(CCs),81个分子功能(MFs)和24个KEGG途径。GO结果表明DEOSGs主要参与氧化应激反应、脂多糖、血液微粒子、质膜等(图2A、B);KEGG结果提示DEOSGs与动脉硬化、利什曼病及AGE-RAGE信号通路在糖尿病并发症中的作用等通路相关(图2C、D)。为进一步探索DEOSGs与COPD相关的关键生物学信息途径,我们进行了GSEA分析,最终在吞噬体、急性炎症反应、乳腺癌、Wnt信号传导途径等通路上得到富集(图4)。
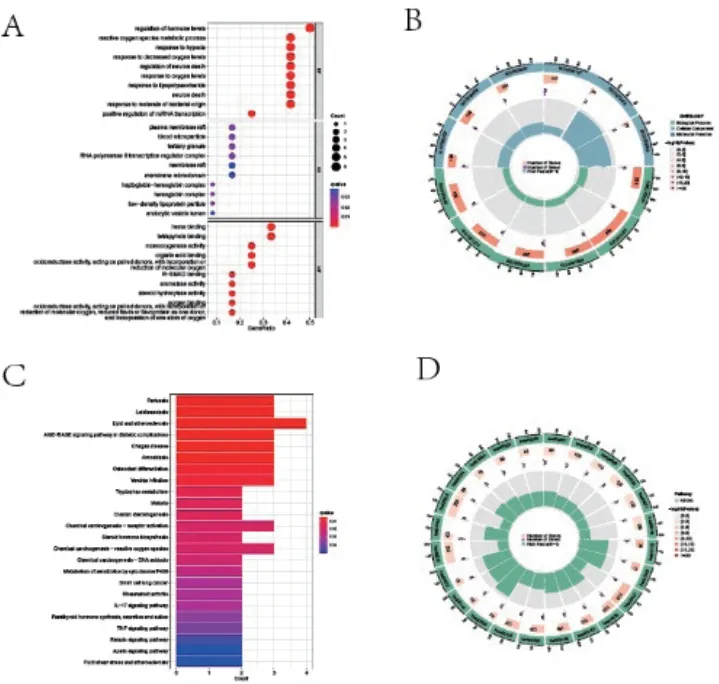
图2 GO与KEGG富集结果(A和B:GO分子功能富集结果;C和D:KEGG通路富集结果)
3 PPI网络分析与候选中心基因的鉴定
将DEOSGs导入String数据库后,得到由13个节点和25条连线组成的PPI网络,如图3A所示。通过Cytoscape软件的CytoHubba插件提取了网络中中介值排名前10的基因(图3B),分别为:CCL2、PPARG、ITGAM、FN1、FOS、EGR1、ALOX5、NOS2、TREM2、CYP1A1,图中基因颜色越深,代表该基因中介值越高,在网络中越处于核心位置。使用MCODE插件寻找关键子网络,选取网络分数最高(5.600)的模块作为目标子网络,其由6个节点和28条连线组成(图4),包含基因是:FN1、FOS、PPARG、ITGAM、EGR1、CCL2。因此CCL2、PPARG、ITGAM、FN1、FOS、、EGR1为候选中心基因。

图3 GSEA富集分析结果
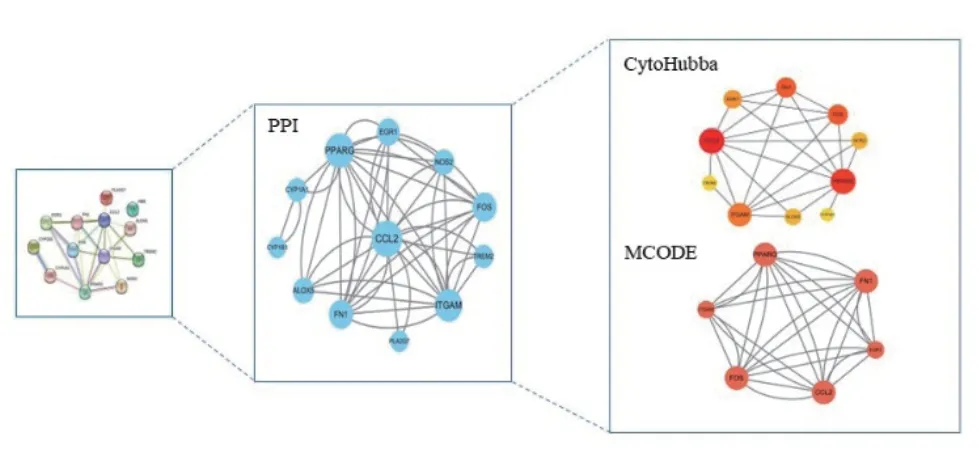
图4 PPI网络
4 中心基因的鉴定
GSE76925作为验证数据集进行差异分析及ROC曲线分析,设置P<0.05,AUC≥0.65,结果见图5,可见FN1及PPARG通过了两种验证方式,将其纳入中心基因,表明它们对COPD患者诊断能力具有较强特异性和敏感性。
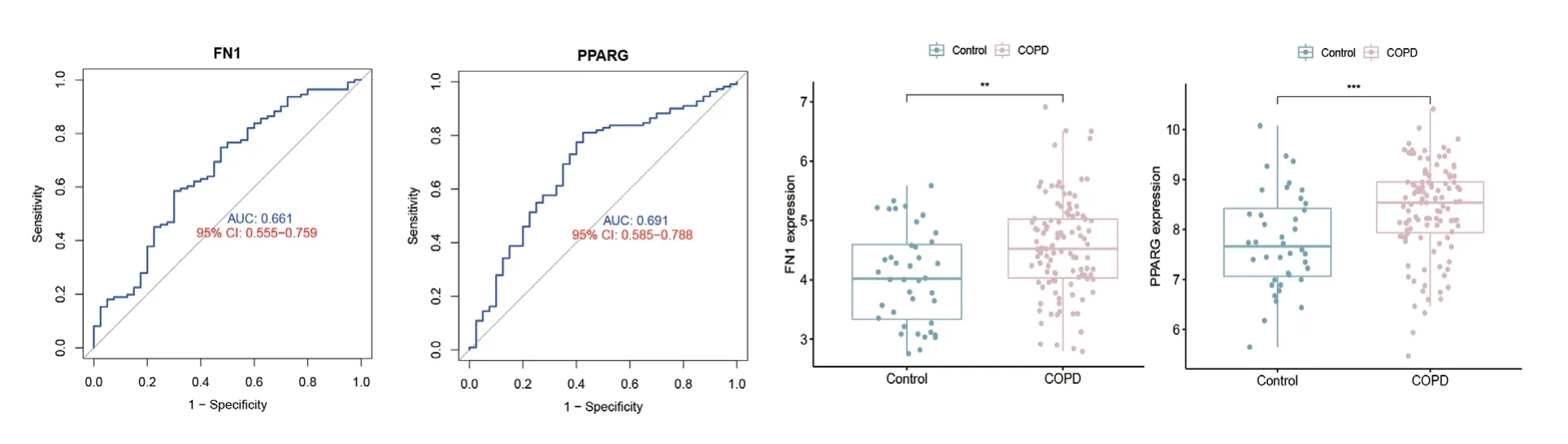
图5 通过验证的2个中心基因相对表达量和ROC曲线
5 免疫细胞浸润分析
利用CIBERSORT算法,我们首先计算了COPD组和正常组样品在22种免疫细胞浸润的比例(图6A)。其中,活化的肥大细胞与中性粒细胞之间正相关性最强(r=0.54);活化的肥大细胞与未活化的肥大细胞之间负相关性最强(r=-0.49)(图6B)。差异表达显示,与正常组相比,未活化的肥大细胞在COPD组织中的浸润程度明显增高;活化的肥大细胞浸润较低(图6C)。因此,活化的肥大细胞与未活化的肥大细胞可能是潜在的核心免疫细胞,参与COPD的发生发展。
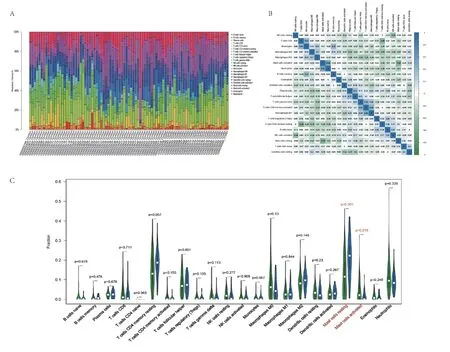
图6 CIBERSORT分析结果
6 中心基因与免疫细胞的相关性分析
将得到的两个中心基因与22种免疫细胞进行相关性分析,我们发现,中心基因与9种免疫细胞存在相关性。其中M0巨噬细胞、M2巨噬细胞与FN1呈正相关;初始B细胞、浆细胞、滤泡辅助性T细胞与FN1呈负相关。嗜酸性粒细胞、M0巨噬细胞、M2巨噬细胞与PPARG呈正相关;未活化的肥大细胞、未活化的CD4+记忆性T细胞、浆细胞、调节性T细胞与PPARG呈负相关。具体见图7。
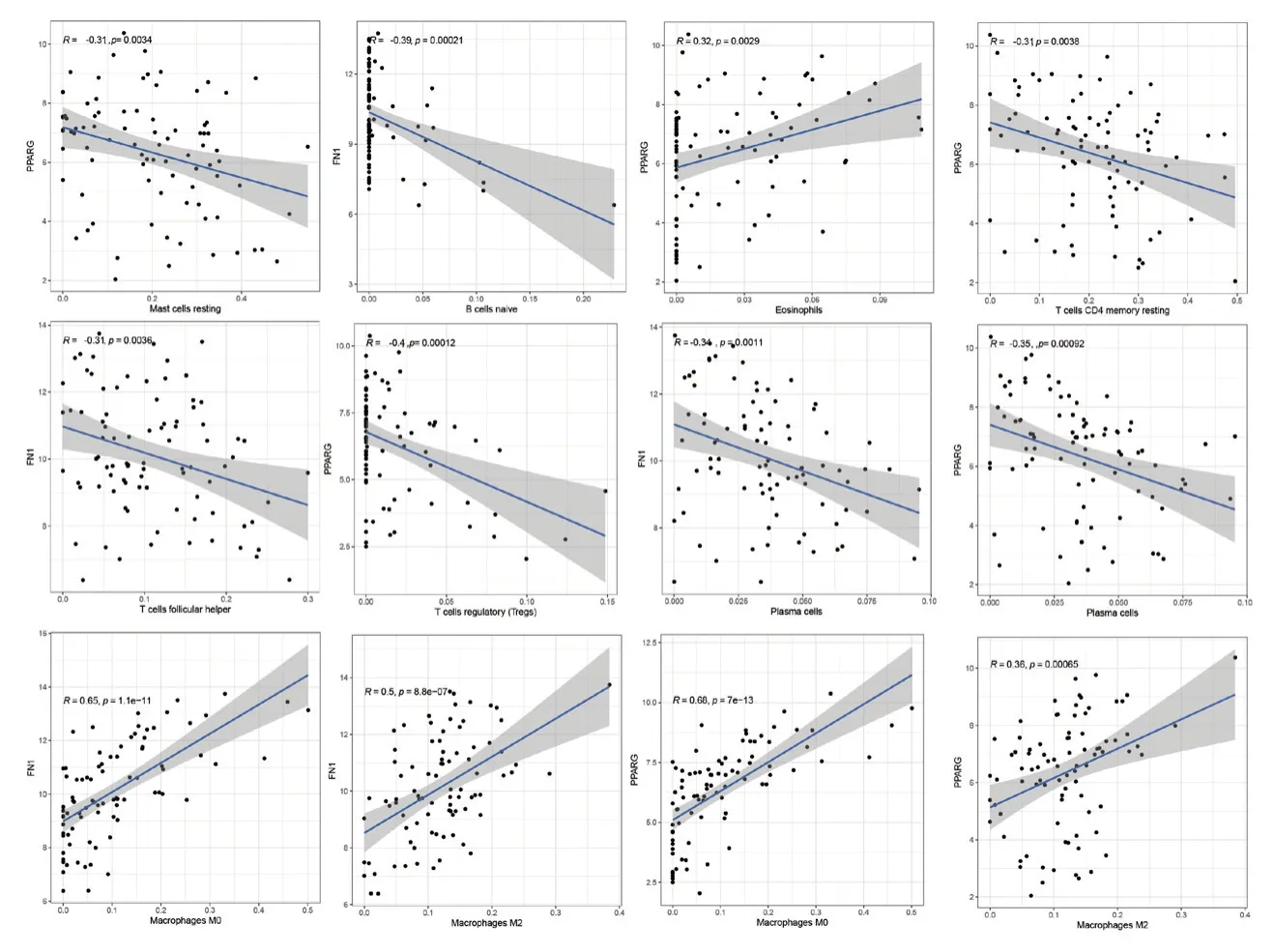
图7 2个中心基因的表达水平与9种免疫细胞相对比例的相关性(P<0.05)
7 中药及化合物预测与分子对接
通过检索Coremine数据库,预测具有潜在干预COPD氧化应激的中药,符合P<0.05的有桑叶、天南星、人参、泽泻、木香、蓖麻子、丹参、大黄等43味中药,见表2,根据P值的大小(P值越小则关联性越强),排名前5的有人参、大黄、天南星、木香、蕲蛇,见表2、图8。将43味中药导入Cytoscape3.9.1构建“靶点-中药”网络图,并对其进行性味归经统计分析,其中四气以温、寒、微温、微寒为主;五味以甘、苦、辛为主;主要归肝、肺、脾、胃、肾经,见图9。
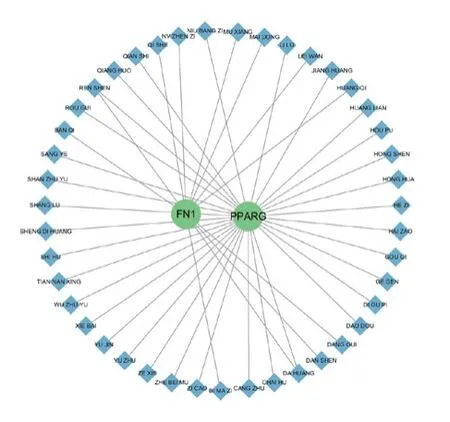
图8 基因-中药网络图

图9 性味、归经统计图

表2 预测中药汇总表
讨论
COPD是全球第三大死因,尽管过去十年在诊断和治疗选择方面取得了重大进展,但每年仍有24多万人死于这种使人衰弱的疾病[11]。鉴于缺乏有价值的生物标志物,早期诊断COPD非常困难的,这种现象进一步导致不良的临床结果。最近愈来愈多的文献表明,氧化应激和多种肺系疾病相关,如急性肺损伤、肺癌和肺囊性纤维化等[12-14]。然而有关氧化应激与COPD的生物信息学研究并不突出。在本文章中,我们获取了13个DEOSGs,证实了COPD中确实存在氧化应激,并与免疫反应有关。
富集分析提示,DEOSGs主要与激素水平的调节、活性氧代谢过程、对缺氧的反应等生物学过程有关。这些发现与先前发现的COPD相关因素一致。先前的研究已经注意到氧化应激是COPD的主要发病驱动机制之一,由于香烟烟雾和空气污染中的外源性活性氧以及肺部炎症和结构细胞产生的内源性活性氧增多,会造成气道上皮细胞损伤,诱导平滑肌细胞增生,致肺功能下降[15]。涉及通路“脂质与动脉粥样硬化”、“糖尿病并发症中的AGE信号通路”、“IL-17信号通路” 等,动脉粥样硬化和COPD作为相互影响的全身性炎症性疾病,有研究表明COPD在动脉粥样硬化性动脉疾病患者中非常普遍,脂质与动脉粥样硬化通路可能是干预两者的核心通路[16]。GSEA分析从整体上提示,Wnt信号通路在COPD中起重要作用。有研究[17]发现使用GSK3抑制剂激活Wnt通路,可以减弱香烟烟雾诱导的肺部炎症和损伤从而治疗COPD。
通过进一步差异分析和ROC曲线分析,确定了2个中心基因。纤维连接蛋白1(FN1)属于FN家族的成员,是一种存在于细胞外中的糖蛋白,参与多种细胞生物学过程[18-19]。近年来,有研究表明FN1可影响人体免疫微环境,可以作为早期检测气道重塑的生物标志物[20]。Pei[21]等观察到FN1与香烟烟雾提取物诱导的气道上皮细胞的糖皮质激素抵抗密切相关。PPARG是一类由配体调节的核激素受体[22]。Zhao[23]等研究发现PPARG在肺腺癌患者体内表达下调,激活PPARG可能是治疗肺腺癌的有效治疗策略;且有动物实验表明PPARG细胞具有显著的活性氧,提示PPARG会参与体内的氧化应激反应[24]。此前鲜有FN1、PPARG与COPD之间的相关报道,这些研究增加了中心基因的可信度,并提示FN1、PPARG可作为COPD的生物标志物及治疗靶点。此外,我们发现肥大细胞在COPD与普通人群中存在差异,而PPARG与肥大细胞呈负相关,这为进一步研究提供了基础。
COPD属于中医“肺胀”“喘证”“咳嗽”等范畴,病位在肺,与脾肾相关,本虚、肺气郁结或复感外邪是其发病的主要机制。通过对COPD氧化应激相关的中心基因进行中药预测,结果提示人参、大黄、天南星、木香、蕲蛇等5味中药可能是针对COPD患者具有突出治疗作用的靶向中药。Sun等[25]通过体外实验证明人参的活性成分人参皂苷Rg1可减轻氧化应激损伤;薛伟栋等[26]发现木香的有效成分木香烃内酯可通过抑制p53 信号通路从而发挥抗氧化应激作用。四气五味结果提示,药物多寒温并用,甘苦互施,COPD患者在稳定期、后期以本虚为主,而甘能补能缓,主入脾经,补后天之本。归经主归肝、肺、脾经,由于COPD患者咳嗽咳痰经久不愈,致使肺脏虚损,子盗母气,则脾脏受累,运化失职,致痰饮内生,病久则累及至肾,致肾不纳气。《丁甘仁医案》指出:“肺若悬钟,撞之则鸣,水亏不能涵木,木叩金鸣”,日久肾病及肝,母病及子,则肝肾阴虚,虚火上炎犯肺发为病。可见本研究所预测中药与受广泛认可的COPD的中医治疗用药基本相符,为临床选药提高新的配伍。
综上,本研究肯定了氧化应激在COPD中的作用,通过相关生物信息学分析发现了13个DEOSGs,最终鉴定了2个中心基因,并预测了相关治疗中药。然而本研究仍存在一定的局限性,首先本研究样本量较小,且没有考虑种族差异和细胞多样性,其次受回顾性分析的限制,我们缺乏对研究数据中重要临床信息的分析。未来需要更大规模的前瞻性研究来验证我们的结论。
