己二酸铵对铝合金硬质氧化膜性能的影响
2024-04-12李孝坤雷鸣科路长远
李孝坤,雷鸣科,路长远,3
(1.黄河水利职业技术学院,河南 开封 475004; 2.河南省绿色涂层材料工程技术研究中心,河南 开封 475004; 3.开封市水生态修复材料重点实验室,河南 开封 475004)
铝合金具有密度小、比强度高、塑性和导电导热性能好等优点,作为一种金属结构材料在工业中得到广泛应用[1-3]。然而,铝合金的硬度较低,耐磨性能和耐腐蚀性能不够理想,难以在较为苛刻的工况下长时间服役。为了提高铝合金的综合性能,国内外科研工作者尝试并验证了多种表面处理工艺[4-10]。相比较而言,阳极氧化工艺的性价比最高,其成本低,工艺参数容易控制,并且氧化膜的性能良好。
硬质阳极氧化工艺是一种特殊的阳极氧化工艺,其特殊性主要体现在电解液温度低,形成的硬质氧化膜较厚并且综合性能良好。通过硬质阳极氧化可以显著提高铝合金表面性能,近年来受到越来越多的关注[11-14]。虽然硬质氧化膜较厚并且综合性能良好,但是通过改良电解液或优化硬质阳极氧化工艺参数从而进一步提高硬质氧化膜的综合性能具有现实意义。加入添加剂(包括有机化合物、无机盐等)是改良电解液常用的措施,已经被证实能有效提高氧化膜的综合性能。己二酸铵是一种具有特殊功能的有机化合物,在电解电容工业中被广泛用于制备阻挡型氧化膜。近年来,已有学者将己二酸铵作为添加剂加入电解液中,并研究其对铝合金常规阳极氧化的影响,证实添加适量己二酸铵能减少氧化膜的缺陷,改善其致密性从而提高耐腐蚀性能[15]。然而,尚未见将己二酸铵用于制备硬质氧化膜相关报道。从进一步提高硬质氧化膜综合性能从而满足不同行业苛刻应用要求的角度出发,开展这方面研究工作十分必要。本文研究己二酸铵对铝合金硬质氧化膜性能的影响,旨在确定最佳的己二酸铵浓度,用于改良电解液从而获得综合性能优良的硬质氧化膜。
1 实 验
1.1 材料与试剂
实验选用2024铝合金,将板材裁切成多个尺寸相同的试样:40 mm×22 mm×1 mm,其化学成分如下:Cu 3.8%~4.9%、Mg 1.2%~1.8%、Mn 0.3%~1.0%、Zn 0.25%、Cr 0.1%,余量为Al。实验使用麦克林试剂,包括浓硫酸(质量分数为98%)、丙酮、硝酸钠、己二酸铵、氯化钠等,均为分析纯等级。
1.2 铝合金硬质阳极氧化
铝合金试样在硬质阳极氧化之前必须进行预处理,步骤如下:(1)使用牌号为1000#、2000#的砂纸逐级打磨试样表面;(2)选用丙酮作为去污除油剂,通过浸泡的方式并在超声波振荡作用下去除试样表面油污;(3)使用去离子水清洗去污除油后的试样;(4)选用硝酸钠(质量浓度为50 g/L)与去离子水配制的溶液作为活化液,通过浸泡的方式溶解试样表面自然形成的氧化膜;(5)再使用去离子水清洗试样;(6)使用吹风机吹干试样表面水膜,然后置于干燥箱中待用。
使用导电夹分别夹持石墨板和预处理后的铝合金试样,放入自制的电解槽中,设置恒定电流密度2 A/dm2进行硬质阳极氧化实验。实验分成6组,第1组作为对比实验,采用纯硫酸电解液,成分为浓硫酸180 g/L。第2~6组实验采用添加己二酸铵的硫酸电解液,己二酸铵浓度依次为5 g/L、12 g/L、20 g/L、28 g/L、35 g/L。每组实验过程中电解液温度都控制在5 ℃左右,电压为90 V,氧化时间为60 min。
1.3 硬质氧化膜表征与测试
采用MERLIN Compact型扫描电镜、X-Max80型能谱仪对不同硬质氧化膜的微观形貌与化学成分进行表征和分析,每个试样局部放大10000倍拍摄微观形貌图像,然后降低倍数进行面扫描,获得硬质氧化膜的能谱图及所含元素的质量分数。
采用Minitest700型测厚仪和THVS-50型数显维氏硬度计分别测定不同硬质氧化膜的厚度、硬度,在测定前使用酒精棉清洁试样表面。测定厚度时选取不同位置测3次,取平均值。手握测厚仪探头并按压使其垂直接触试样表面,保持适当时间后显示厚度值。测定硬度时也选取不同位置测3次,取平均值。施加恒定载荷0.98 N,保持15 s后硬度计压头缓慢提升卸除载荷,随即显示硬度值。
采用MFT-4000型表面性能测试仪和HC1004型电子天平(精度为0.1 mg)测试不同硬质氧化膜的耐磨性能,为了获得能够反映客观规律的数据(如摩擦系数、磨损失重),摩擦实验在无润滑工况下进行,选取直径4 mm的GCr15钢球作为对磨件,裁切不同硬质氧化膜制备的标准试样作为待测件。施加恒定载荷5 N使对磨件沿着待测件表面往复滑动,摩擦行程、频率及摩擦时间分别为10 mm、2 Hz、8 min。测试过程中在电脑端显示动态摩擦系数,取平均值得到不同硬质氧化膜的摩擦系数。摩擦实验前后试样的质量差值即为硬质氧化膜的磨损失重。
采用CS2350型电化学工作站模拟不同硬质氧化膜的电化学腐蚀过程,以封装后的硬质氧化膜试样作为工作电极,铂电极和饱和甘汞电极分别作为辅助电极、参比电极,并配制质量分数3.5%的氯化钠溶液作为腐蚀介质。在稳定开路电位状态下恒定速度扫描(1 mV/s)获得不同硬质氧化膜的极化曲线,并借助于电化学工作站配备的软件拟合测试数据,获得用于分析不同硬质氧化膜耐腐蚀性能的腐蚀电化学参数。浸泡腐蚀实验是模拟不同硬质氧化膜在3.5%氯化钠溶液中静态腐蚀导致表面被破坏的过程,14 d后取出所有试样,使用去离子水冲洗并立即吹干,然后采用扫描电镜观察不同硬质氧化膜浸泡腐蚀后的微观形貌。
2 结果与讨论
2.1 微观形貌
图1所示为铝合金基体、不添加和添加己二酸铵制备的不同硬质氧化膜的微观形貌。

图1 铝合金基体和不同硬质氧化膜的微观形貌Fig.1 Microstructure of aluminum alloy matrix and different hard oxide films
图1(a)铝合金基体表面与其他有硬质氧化膜的形貌不同;图1(b)~图1(g)为在铝合金基体上制备的不同硬质氧化膜的形貌,其特征存在相似之处,即表面都遭受溶解和烧蚀,形成一些微小孔洞以及深浅不同、形状各异的烧蚀坑。从图1(b)看出,不添加己二酸铵制备的硬质氧化膜表面溶解和烧蚀程度严重,形成的烧蚀坑尺寸和深度差别较大,最大的烧蚀坑尺寸超过2 μm,深度也达到微米级,其表面致密性差。分别添加5 g/L、12 g/L、20 g/L己二酸铵制备的硬质氧化膜,见图1(c)、图1(d)和图1(e),溶解和烧蚀程度逐渐减轻,形成的烧蚀坑数量减少并且变浅,表面趋于平整,致密性逐渐提高。然而,添加28 g/L、35 g/L己二酸铵制备的硬质氧化膜,见图1(f)、图1(g),溶解和烧蚀程度反而加重,表面形成尺寸接近或超过2 μm的烧蚀坑增多,烧蚀坑深度也增加,这两种硬质氧化膜的致密性与添加20 g/L己二酸铵制备的硬质氧化膜相比降低了。
根据对图1中各种情况下微观形貌的比较,可以认为,己二酸铵能参与硬质氧化膜形成过程,改变了硬质氧化膜的介电性能,影响铝离子传导过程并限制铝离子向电解液的迁移,从而减轻硬质氧化膜的溶解和烧蚀程度。在一定范围内己二酸铵的浓度越高,在硬质阳极氧化成膜过程中起到明显的减轻溶解和烧蚀程度作用,促进形成较致密的硬质氧化膜。但己二酸铵浓度过高造成电解液的氧化性减弱,加之己二酸铵属于弱酸弱碱盐溶于水呈弱酸性,浓度过高的情况下导致电解液的酸性增强(pH值降低约0.5~1.0),对硬质氧化膜溶解程度加重,从而影响硬质氧化膜生长速度和均匀性。此外,由于硬质氧化膜的均匀性不佳,局部可能遭受严重溶解和烧蚀,导致表面变得粗糙,其致密性降低。
2.2 化学成分和厚度
图2所示为添加不同浓度己二酸铵时制备的硬质氧化膜的能谱图。表1为不同硬质氧化膜中各元素的质量分数。

表1 不同硬质氧化膜中各元素的质量分数Tab.1 Mass fraction of each element in different hard oxide films

图2 不同硬质氧化膜的能谱图Fig.2 Energy spectrum of different hard oxide films
根据图2(a)~图2(f)分析可知,添加己二酸铵并未改变硬质氧化膜的元素组成,不同硬质氧化膜都含有Al、O、S和C元素。Al和O元素是由于铝合金基体发生氧化反应成膜而存在,S元素可能是电解液中的硫酸根参与硬质膜形成过程中引入[16-17]。C元素并非硬质氧化反应的产物,而是含碳物质吸附在硬质氧化膜表面时引入。随着己二酸铵浓度从0增加到20 g/L,硬质氧化膜中Al、O和S元素的质量分数都呈升高趋势,而C元素的质量分数降低,如表1所示。但随着己二酸铵浓度从20 g/L继续增加到35 g/L,硬质氧化膜中Al、O和S元素的质量分数都呈降低趋势,而C元素的质量分数升高。C元素通常被视为干扰元素,其质量分数变化无参考意义。
图3所示为不添加和添加己二酸铵不同浓度时制备的不同硬质氧化膜的厚度。从图3看出,不添加己二酸铵制备的硬质氧化膜厚度为18.7 μm,而添加5 g/L、12 g/L、20 g/L己二酸铵制备的硬质氧化膜厚度依次增加,相比于不添加己二酸铵制备的硬质氧化膜厚度增幅为0.6 μm、1.9 μm、2.5 μm。氧化膜的形成过程和溶解过程是相互对立而又密切关联,当氧化膜的生长速度快于溶解速度,表现为厚度逐渐增加。由于添加适量己二酸铵能减轻硬质氧化膜溶解和烧蚀程度,即溶解速度减缓,而硬质氧化膜持续形成,因此厚度增加。然而,添加28 g/L、35 g/L己二酸铵制备的硬质氧化膜与添加20 g/L己二酸铵制备的硬质氧化膜相比厚度降低。这是由于己二酸铵浓度过高会造成硬质氧化膜的溶解和烧蚀程度加重,溶解速度快于生长速度,因此硬质氧化膜的厚度呈降低趋势。
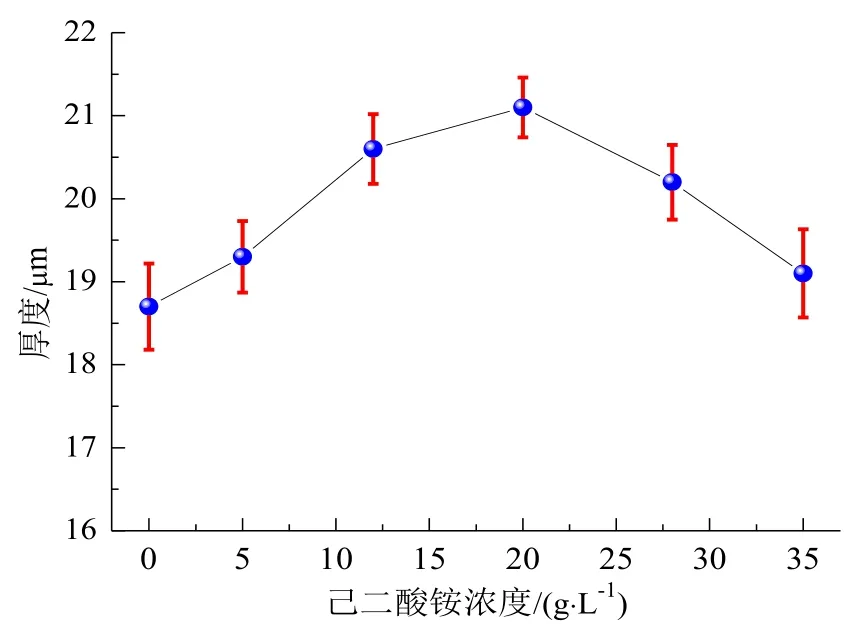
图3 不同硬质氧化膜的厚度Fig.3 Thickness of different hard oxide films
2.3 硬度和耐磨性能分析
图4所示为不添加和添加己二酸铵制备的不同硬质氧化膜的硬度。从图4看出,随着己二酸铵浓度从0增加到35 g/L,硬质氧化膜的硬度呈现先增大后减小趋势。由于添加适量己二酸铵能减轻硬质氧化膜的溶解和烧蚀程度,促进形成较致密的硬质氧化膜并且使硬质氧化膜增厚,当外部载荷作用时抵御表面弹塑性变形能力增强,因此硬度增大。但当己二酸铵浓度超过20 g/L,由于硬质氧化膜的致密性和厚度降低,加之均匀性不佳,当外部载荷作用时抵御表面弹塑性变形能力减弱,因此硬度呈现减小趋势。添加20 g/L己二酸铵制备的硬质氧化膜硬度最高,达到380.8 HV,是铝合金基体硬度(90 HV)的4.2倍。该硬质氧化膜的均匀性好、表面结构较致密并且厚度达到21.2 μm,具有较强的抵御表面弹塑性变形能力,致使相同外部载荷压入形成的压痕小,因此表现出较高硬度。
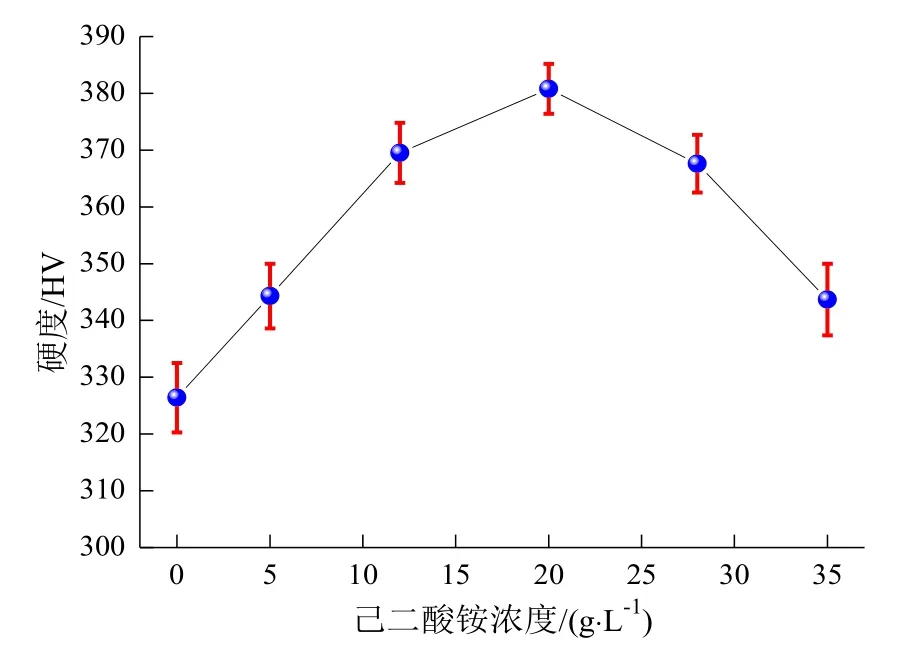
图4 不同硬质氧化膜的硬度Fig.4 Hardness of different hard oxide films
图5所示为不添加和添加己二酸铵制备的不同硬质氧化膜的摩擦系数,图6所示为不添加和添加己二酸铵制备的不同硬质氧化膜的磨损失重。从图5和图6看出,随着己二酸铵浓度从0增加到35 g/L,硬质氧化膜的摩擦系数和磨损失重均呈现先降低后升高趋势。不添加己二酸铵制备的硬质氧化膜的摩擦系数和磨损失重均较高,依次为0.64、1.32 mg。添加20 g/L己二酸铵制备的硬质氧化膜的摩擦系数和磨损失重仅为0.52、0.87 mg,与铝合金基体(摩擦系数为0.72、磨损失重为1.60 mg)相比分别降低约28%和46%,其耐磨性能最好。然而,添加35 g/L己二酸铵制备的硬质氧化膜的摩擦系数和磨损失重分别达到0.62、1.25 mg,其耐磨性能变差。这表明添加适量己二酸铵能明显提高硬质氧化膜的耐磨性能,但己二酸铵浓度过高造成硬质氧化膜的耐磨性能下降。其原因在于添加适量己二酸铵促进形成均匀性好、表面结构较致密且较厚的硬质氧化膜,其硬度高,具有较强的抵御表面弹塑性变形能力。摩擦实验过程中,当GCr15钢球在恒定载荷作用下压入硬质氧化膜做往复滑动时,硬质氧化膜表面致密性越好、厚度和硬度越大,抵御钢球压入的抗力就越强,越能有效抑制钢球往复滑动过程中造成的弹塑性变形程度,从而表现为耐磨性能提高。但当己二酸铵浓度超过20 g/L,由于硬质氧化膜的均匀性不佳,致密性和厚度均降低导致硬度减小,抵御钢球压入的抗力变弱,钢球沿着硬质氧化膜表面往复滑动过程中容易造成较大程度弹塑性变形,硬质氧化膜从而表现为耐磨性能下降。

图5 不同硬质氧化膜的摩擦系数Fig.5 Friction coefficient of different hard oxide films

图6 不同硬质氧化膜的磨损失重Fig.6 Wear loss of different hard oxide films
2.4 耐腐蚀性能
图7所示为铝合金基体、不添加和添加己二酸铵制备的不同硬质氧化膜的极化曲线,表2所示为通过拟合极化曲线得到的腐蚀电化学参数。通常情况下,腐蚀电位越负,材料的腐蚀倾向越强,腐蚀电流密度越低,材料的腐蚀速度越慢[18-20]。

表2 极化曲线拟合得到的腐蚀电化学参数Tab.2 Electrochemical parameters of corrosion obtained by fitting of polarization curves

图7 铝合金基体和不同硬质氧化膜的极化曲线Fig.7 Polarization curves of aluminum alloy matrix and different hard oxide films
结合图7和表2可知,铝合金基体具有最负的腐蚀电位-0.637 V和最高的腐蚀电流密度66.31 μA/cm2,在3.5%氯化钠溶液中其腐蚀倾向强,并且腐蚀速度相对快。不添加己二酸铵制备的硬质氧化膜的腐蚀电位为-0.586 V,腐蚀电流密度较铝合金基体有所降低,但降低幅度不到一个数量级。由于不添加己二酸铵制备的硬质氧化膜表面溶解和烧蚀程度严重,形成一些尺寸大且较深的烧蚀坑,烧蚀坑处容易汇聚氯化钠溶液成为腐蚀敏感区域,导致硬质氧化膜腐蚀反应速度加快,因此其耐腐蚀性能与铝合金基体相比并未显著提高。
分别添加5 g/L、12 g/L、20 g/L己二酸铵制备的硬质氧化膜腐蚀电位较铝合金基体的腐蚀电位正移幅度依次增加,腐蚀电流密度的降低幅度都超过一个数量级。这表明添加适量己二酸铵能明显提高硬质氧化膜的耐腐蚀性能,其原因在于添加适量己二酸铵有利于减轻硬质氧化膜的溶解和烧蚀程度,促进形成致密性较好的硬质氧化膜,表面烧蚀坑浅并且数量少,阻碍了氯化钠溶液在局部汇聚,有效的降低腐蚀倾向并减缓腐蚀速度,因此硬质氧化膜的耐腐蚀性能逐步提高。然而,添加28 g/L或35 g/L己二酸铵制备的硬质氧化膜腐蚀电位明显负移,逐渐接近铝合金基体的腐蚀电位,腐蚀电流密度也呈增加趋势,这表明添加过量己二酸铵导致硬质氧化膜的耐腐蚀性能下降。由于己二酸铵浓度过高造成硬质氧化膜溶解和烧蚀程度加重,表面形成一些尺寸接近和超过2 μm的烧蚀坑,使得氯化钠溶液容易在不同区域汇聚造成腐蚀倾向增强,腐蚀反应速度加快,因此硬质氧化膜的耐腐蚀性能下降。相比之下,添加20 g/L己二酸铵制备的硬质氧化膜具有最正的腐蚀电位-0.515 V和最低的腐蚀电流密度1.45 μA/cm2,其耐腐蚀性能最好。该硬质氧化膜表面较平整且结构致密,抑制腐蚀反应能力强,表现出弱腐蚀倾向。加之其厚度达到21.2 μm,阻挡腐蚀介质能力强,因此表现出更好的耐腐蚀性能。
图8所示为铝合金基体、不添加和添加己二酸铵制备的不同硬质氧化膜在氯化钠溶液中浸泡腐蚀14 d后的微观形貌。从图8(a)看出,铝合金基体浸泡腐蚀后表面形成类似阶梯状结构以及一些形状各异并且深浅不等的坑洞,其腐蚀程度严重。从图8(b)看出,不添加己二酸铵制备的硬质氧化膜浸泡腐蚀后表面形成类似花蕊状结构,也形成一些形状各异、深浅不等的坑洞,但整体腐蚀程度与铝合金基体相比较轻。从图8(c)~8(e)看出,添加5 g/L、12 g/L、20 g/L己二酸铵制备的硬质氧化膜的腐蚀程度依次减轻,浸泡腐蚀后表面致密性仍然较好,只形成一些小尺寸较浅的坑洞。尤其是添加20 g/L己二酸铵制备的硬质氧化膜,腐蚀后表面的坑洞很少,其腐蚀程度最轻。由于添加适量己二酸铵有利于减轻硬质氧化膜溶解和烧蚀程度,使得硬质氧化膜表面形成少量烧蚀坑,致密性逐渐提高,阻碍氯化钠溶液在局部区域汇聚,明显降低了腐蚀倾向并且减缓腐蚀速度,所以硬质氧化膜的腐蚀程度减轻。从图8(f)和8(g)看出,添加28 g/L、35 g/L己二酸铵制备的硬质氧化膜浸泡腐蚀后表面形成的坑洞尺寸大,而且深度也达到微米级,腐蚀程度较严重。这进一步表明添加过量己二酸铵造成硬质氧化膜的耐腐蚀性能下降,与上述极化曲线分析结果一致。

图8 铝合金基体和不同硬质氧化膜在氯化钠溶液中浸泡腐蚀14 d后的微观形貌Fig.8 Microstructure of aluminum alloy matrix and different hard oxide films after immersion in sodium chloride solution for 14 days
3 结 论
(1)在不添加和添加己二酸铵的硫酸电解液中制备出具有不同形貌特征的硬质氧化膜,它们的厚度、硬度、耐磨性能和耐腐蚀性能存在差异。添加适量己二酸铵减轻了硬质氧化膜的溶解和烧蚀程度,促进形成表面较均匀致密的硬质氧化膜,并使其硬度增大,耐磨性能和耐腐蚀性能明显提高。
(2)添加20 g/L己二酸铵制备的硬质氧化膜表面均匀性和致密性最好,厚度达到21.2 μm,其硬度是铝合金基体的4.2倍,摩擦系数和磨损失重与铝合金基体相比分别降低约28%、46%,腐蚀电流密度仅为1.45 μA/cm2,与铝合金基体相比降低了超过一个数量级。适量己二酸铵通过参与硬质氧化膜形成过程明显减轻溶解和烧蚀程度,因此该硬质氧化膜表现出更好的耐磨性能和耐腐蚀性能。
