树莓多糖组分RPP-6的分离、结构表征及其体外免疫和抗氧化活性研究
2024-04-11陆杰杨永晶尹星星王学红晁沐
陆杰 杨永晶 尹星星 王学红 晁沐
摘 要 旨在对从树莓粗多糖中分离纯化出的树莓多糖组分RPP-6进行结构表征及体外免疫活性和抗氧化活性研究。采用DEAE-Sepharose Fast Flow和Sephadex G-200对树莓粗多糖进行分离纯化。结合高效凝胶渗透色谱法(High-Performance Gel Permeation Chromatography,HPGPC)、傅里叶红外光谱法(Fourier Transform Infrared Spectroscopy,FT-IR)、气相色谱-质谱联用(Gas Chromatography and Mass Spectrometry,GC-MS)和甲基化等方法对RPP-6的结构进行表征。利用小鼠巨噬细胞RAW264.7和自由基清除试验研究RPP-6的体外免疫与抗氧化活性。结果表明,RPP-6是一种酸性杂多糖,由阿拉伯糖、葡萄糖、半乳糖、鼠李糖和甘露糖组成,摩尔比为37.8∶30.8∶21.4∶6.0∶3.9 。RPP-6的峰位分子质量为7.645 ku、重均分子质量为7.769 ku、数均分子质量为6.310 ku。RPP-6中存在15种单糖连接方式,其中Araf-(1→、→4,6)-Glcp- (1→、→4)-Galp-(1→和→4)-Xylp-(1→为主要连接方式,含量分别为20.64%、8.59%、24.04%和 16.92%。RPP-6能明显提高小鼠巨噬细胞RAW264.7的活力和吞噬能力,并促进细胞中TNF-α(Tumor Necrosis Factor,TNF)、IL-6(Interleukin-6,IL-6)、IL-1β(Interleukin-1β,IL-1β)和NO(Nitric Oxide,NO)释放。RPP-6对ABTS·+具有较高的清除作用,对DPPH·的清除作用不明显。表明RPP-6是一种多支链的均一酸性杂多糖,具有显著的免疫增强活性和一定的抗氧化活性。
关键词 树莓;结构表征;免疫活性;抗氧化活性
树莓(Rubus idaeus L.)是蔷薇科悬钩子属植物,又名悬钩子、覆盆子、三月泡、山莓等,在中国东北、甘肃、青海、新疆和西藏等地均有分布[1-2]。树莓为药食同源植物,其果实鲜嫩多汁,酸甜可口,具有很高的营养价值和药用价值以及悠久的用药历史[3]。古籍中记载覆盆子为“金玉之品”,味甘性平、无毒,具有益气轻身、益肾固精、补肝明目和缩尿等功效[4]。现代药理学研究发现,树莓包含多种营养成分,如多糖、氨基酸、黄酮类、蛋白质、维生素等,具有补肾、保肝、抗肿瘤、降血压、抗衰老等药理活性,被誉为“黄金水果”[5]。研究表明,树莓果实能够制作成乳酸菌发酵饮料、葡萄酒饮品、果冻和糖果等食品;其叶细胞提取物还能够通过改善皮肤的粗糙度和抑制皱纹的产生达到抗衰老和美白的效果[6-7]。可见,树莓不仅能够加工制成各种食品,在医药、保健品、化妆品等领域也有广泛的开发利用前景。
多糖是生物体中必不可缺的物质之一,是由多个单糖分子缩合、失水形成的一类高分子碳水化合物[8]。天然多糖广泛存在于植物、动物和微生物中。其中,植物是天然多糖的重要来源[9]。研究表明,植物多糖毒副作用低,具有免疫调节、抗氧化、抗肿瘤、抗疲劳、降血糖、抗菌等诸多活性,其中免疫调节和抗氧化活性尤为显著[10-13]。植物多糖能够激活免疫系统中的T淋巴细胞、B淋巴细胞、巨噬细胞和自然杀伤细胞等各类免疫细胞,促进细胞因子的分泌,从多方面调节免疫[14]。例如,构树叶多糖能够提高环磷酰胺诱导的雌性小鼠ICR的脾脏系数、白细胞数量、血清蛋白和血清抗体水平,修复肠道及脾脏组织损伤,从而提高小鼠的免疫功能[15]。黄芪多糖通过提高小鼠巨噬细胞RAW264.7的吞噬能力,促进一氧化氮(Nitric Oxide,NO)、肿瘤坏死因子(Tumour Necrosis Factor,TNF)、粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage Colony-stimulating Factor,GM-CSF)、白介素-6(Interleukin-6,IL-6)以及白介素-1β(Interleukin-1β,IL-1β)的分泌,表现出显著的免疫增强活性[16]。此外,植物多糖还可以有效地清除各类自由基[12]。研究表明,艾叶粗多糖能够有效清除羟基自由基(Hydroxyl Radical,·OH)和超氧阴离子自由基(Superoxide Radical,O2-·),具有显著的抗氧化活性[17]。苦瓜粗多糖清除O2-·、 ·OH和DPPH自由基(1,1-Diphenyl-2-picryl-hydrazy Radical,DPPH·),具有较好的抗氧化作用[18]。由此可见,植物多糖可以作为天然的免疫调节剂和抗氧化剂,有巨大的开发潜力。
多糖是树莓的主要活性物质之一,也是树莓含量较高的营养成分[5]。徐丽萍等[19]通过响应面法优化红树莓多糖提取工艺,多糖产率可以达到10.69%。前期研究发现,栽培于青藏高原的红树莓中多糖提取率高达11.75%[20]。可见,树莓是多糖的理想来源材料。近年来,一些学者发现树莓多糖具有抗肿瘤、抗炎、降血糖、抗氧化、降血压、抗衰老等多种功能[3, 5, 21]。如Zhang等[22]从悬钩子果实和叶子中提取的粗多糖,能够清除DPPH·,表現出良好的抗氧化活性;从树莓果肉中提取的树莓粗多糖RPP,能够提高荷瘤小鼠血清中TNF-α、干扰素-γ(Interferon-γ,IFN-γ)和白介素-2(Interleukin-2,IL-2)的浓度,具有显著的免疫增强活性[23]。随着树莓多糖研究的逐渐深入,一些具有生物活性的多糖组分不断从树莓粗多糖中分离纯化出来。例如,悬钩子果胶粗多糖经DEAE cellulose-52纤维柱和Sephacryl S300凝胶柱分离纯化得到的果胶多糖组分RCHP-S在小鼠巨噬细胞RAW264.7中对IL-1β、IL-6和TNF-α的mRNA水平有显著抑制作用,表现出明显的免疫增强活性[24];采用D4020树脂柱和Sephadex G-100葡聚糖凝胶柱分离纯化得到的树莓多糖组分RCP-I和RCP-Ⅱ,能够显著地清除DPPH·和·OH,体现出较强的体外抗氧化作用[25]。综上所述,树莓多糖在免疫调节剂和抗氧化剂的开发和应用方面具有极大的前景。
本研究对树莓粗多糖进行分离纯化,获得多糖组分RPP-6并研究其结构特征。通过小鼠巨噬细胞RAW264.7模型和自由基清除试验研究RPP-6的体外免疫调节和体外抗氧化活性,以期为树莓多糖组分的进一步研究奠定试验基础,也为树莓多糖的开发和利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
树莓冷冻果购自青海树莓农业产业化有限公司(青海湟源);小鼠巨噬细胞RAW264.7购自中国科学院细胞库;RAW264.7细胞专用培养基购自武汉普诺赛生命科技有限公司;单糖标准品:鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖购自上海西格玛奥德里奇贸易有限公司;氯化钠、三氟乙酸、乙酸均购自赛默飞世尔科技公司;硼氘化钠、高氯酸、甲醇均购自默克生命科学有限公司;乙酸酐、醋酐、氢氧化钠均购自上海沪试实验器材股份有限公司;碘甲烷、二甲基亚砜、氢化钠均购自上海阿达玛斯试剂有限公司;乙酸乙酯购自北京沃凯生物科技有限公司;磷酸缓冲液(PBS)购自青海莱茵尔生物科技有限责任公司;DEAE-琼脂糖凝胶(DEAE-Sepharose Fast Flow),葡聚糖凝胶Superdex G-200,甲基化试剂盒均购自扬州博瑞糖生物技术有限公司;CCK-8试剂盒购自武汉伊莱瑞特生物科技股份有限公司;TNF-α、IL-6、IL-1β酶聯免疫吸附测定(Enzyme Linked-Immuno-Sorbent Assay,ELISA)试剂盒购自武汉博士德生物工程有限公司;NO测定试剂盒购自武汉生物技术有限公司;Phagocytosis Assay Kit(IgG FITC)购自Cayman化工公司;过硫酸钾购自上海广诺化学科技有限公司;抗坏血酸(VC)购自上海展云化工有限公司;DPPH、ABTS购自北京索莱宝科技有限公司。
1.2 设备与仪器
HF100三气培养箱(上海力申科学仪器有限公司),AC2-4S8-CN生物安全柜(太仓艺思高医疗器械科技有限公司),Multiskan MK3酶标仪和D-37520 离心机(中国赛默飞世尔科技公司),CPA225D电子天平(北京赛多利斯仪器系统有限公司),R-1001VN旋转蒸发仪(郑州长城科工贸有限公司),UGC-24M 氮吹仪和101-1BS真空干燥箱(力辰科技有限公司),MS7-H550-Pro磁力搅拌器(无锡德凡仪器有限公司),RI-502 SHODEX示差折光检测器(日本昭和电工基团),RID-10A FRC-10A高效液相色谱仪和GCMS-QP201气相质谱联用仪(日本岛津公司),BSZ-100自动收集器、BRT105-104-102串联凝胶柱和多糖凝胶纯化系统(扬州博瑞糖生物技术有限公司),FT-IR650傅里叶变换红外光谱仪(天津港东科技发展股份有限公司),SYNERGY LX 多功能酶标仪(美国伯腾仪器有限公司)。
1.3 树莓多糖的分离纯化
1.3.1 树莓粗多糖的提取 采用水提醇沉法制备树莓粗多糖[26]。树莓冷冻果置于55 ℃干燥箱中除去水分,将其粉碎并筛除形状完好的树莓籽,得到树莓果粉。称取100 g树莓果粉,加入石油醚(m∶V=1∶4),并置于磁力搅拌器中搅拌除脂。收集并风干滤渣,加入80%乙醇(m∶V= 1∶4),于60 ℃加热回流除去色素、单糖和寡糖,重复2次。风干滤渣后,加入水(m∶V=1∶5),于60 ℃超声提取1 h。离心取上清,利用Sevag法除蛋白[27],此操作重复3次。收集除去蛋白的提取液,60 ℃条件下经旋转蒸发浓缩至原体积的 1/4后加入4倍体积95%乙醇,4 ℃过夜后离心获得沉淀,冷冻干燥后获得淡粉色粉末即为树莓粗多糖。
1.3.2 多糖分离纯化 利用DEAE-Sepharose Fast Flow对树莓粗多糖进行极性分离[28]。称取1 g树莓粗多糖溶于蒸馏水配置成100 mg/mL的树莓粗多糖溶液,经DEAE-Sepharose Fast Flow(7.5 cm × 60 cm)柱层析时分别采用蒸馏水以及不同浓度(0.2 mol/L、0.4 mol/L、0.8 mol/L、1.5 mol/L、2.0 mol/L)的氯化钠溶液作为洗脱液,流速为15 mL/min,每个浓度冲洗3~4个柱体积。按5 mL/管收集洗脱液,并采用苯酚硫酸法检测多糖含量[29]。收集洗脱组分,冷冻干燥后配置成100 mg/mL的多糖水溶液。采用配有Sephadex G-200葡聚糖凝胶层析柱(2.6 cm × 60 cm)的多糖凝胶纯化系统进一步纯化,以0.5 mL/min流速的蒸馏水洗脱,结合RI-502示差折光检测器在线检测多糖含量,将收集到的馏分浓缩、冷冻干燥后用于后续研究。
1.4 树莓多糖组分RPP-6结构表征
1.4.1 分子质量测定 采用高效凝胶渗透色谱(High-Performance Gel Permeation Chromatography,HPGPC)法检测树莓多糖组分的纯度并测定其分子质量[30]。将树莓多糖组分配制成5 mg/mL溶液,12 000 r/min离心10 min,经0.22 μm微孔滤膜过滤后使用配有BRT105-104-102串联凝胶柱(8 mm×300 mm)和RI-502示差折光检测器的LC-10A HPLC系统测定RPP-6的分子质量。将柱温维持在40 ℃,以0.6 mL/min的0.05 mol/L氯化钠溶液作为流动相。以不同分子质量的右旋糖酐(5、11.6、23.8、48.6、80.9、148、273、409.8和670 ku)作为标准品绘制标准曲线,并根据校准曲线计算树莓多糖组分的分子质量。
1.4.2 单糖组成分析 采用高效阴离子交换色谱法(High-performance anion exchange chromatography,HPAEC)分析多糖样品的单糖组成[30]。将树莓多糖组分和单糖标准品乙酰化,具体方法如下:取2 mg多糖,加入1 mL 2 mol/L三氟乙酸,120 ℃下水解90 min。使用旋转蒸发仪蒸干后加入2 mL双蒸水,用100 mg硼氢化钠还原,加入冰醋酸中和,旋蒸,110 ℃烘干。再加入1 mL乙酸酐于100 ℃反应1 h,冷却后加入3 mL甲苯,减压浓缩蒸干。重复以上步骤4~5次以除去多余的乙酸酐,获得乙酰化衍生物。使用配有CarboPacTMPA-20分析柱(3 mm × 150 mm)和脉冲电流检测器的Dionex ICS-5000系统测定乙酰化衍生产物。采用等体积的250 mmol/L氢氧化钠溶液洗脱10 min,再用500 mmol/L含有50 mmol/L氢氧化钠的醋酸钠洗脱30 min,流速为0.3 mL/min,洗脱温度为 30 ℃。通过与各标准品的保留时间和峰面积对比最终确定树莓多糖组分的单糖组成。
1.4.3 FT-IR分析 取样品2 mg和溴化钾200 mg,混合后压成粉末,置于FT-IR650傅里叶变换红外光谱仪进行扫描记录,扫描波长为400~ 4 000 cm-1。
1.4.4 甲基化分析 称取2 mg树莓多糖组分,加入1 mL无水二甲基亚砜,快速加入甲基化试剂A液,封闭,经超声溶解后,再加入甲基化试剂B液,在水浴30 ℃的条件下反应60 min,最后加入2 mL超纯水终止甲基化反应。甲基化产物加入1 mL 2 mol/L的三氟乙酸水解90 min,然后采用60 mg硼氢化钠还原水解物8 h,加入冰醋酸中和,旋蒸,101 ℃烘箱烘干,再加入1 mL乙酸酐于100 ℃反应1 h,冷却后加入甲苯减压浓缩蒸干。重复上述步骤4~5次,除去多余的乙酸酐,获得乙酰化产物。将乙酰化产物用3 mL二氯甲烷进行萃取,二氯甲烷层以适量的无水硫酸钠干燥。采用配有RXI-5 SIL MS色谱柱(30 m× 0.25 mm×0.25 μm)的GC-MS测定乙酰化产物。GC-MS条件如下:起始温度为120 ℃,以 3 ℃/min升溫至250 ℃,保持5 min;以氦气为载气,流速为1 mL/min;进样口温度为250 ℃,检测器温度为250 ℃。
1.5 树莓多糖组分RPP-6的体外免疫活性
1.5.1 RAW264.7细胞培养 将RAW264.7巨噬细胞用含15% FBS的RAW264.7细胞专用培养基于37 ℃、5% CO2的三气培养箱中培养,定期更换培养基。
1.5.2 RAW264.7细胞活力 待细胞密度为80%左右时,将RAW264.7细胞以1.0×104 个/孔的浓度接种至96孔板中。在37 ℃、5% CO2三气培养箱中培养12 h,弃去旧培养液,加入不同质量浓度的树莓多糖组分溶液(20、40、80、160 μg/mL)和5 μg/mL的阳性对照脂多糖(Lipopolysacchatide,LPS)溶液,以不含树莓多糖组分和LPS的孔作为空白对照组,每个浓度设置6个复孔,于三气培养箱中培养24 h后每孔加入10 μL CCK-8溶液,37 ℃、5% CO2三气培养箱孵育1 h,使用酶标仪于450 nm处测定吸光值。
1.5.3 RAW264.7细胞吞噬能力鉴定 RAW264.7细胞培养及处理同“1.5.2”,在每孔细胞中加入0.2 μL Latex Beads-Rabbit IgG-FITC Complex,于37 ℃ 5% CO2的三气培养箱中培养4 h后,每孔加入10 μL的台盼蓝溶液(1 ×)固定1~2 min,经缓冲溶液清洗后,使用荧光酶标仪在ex/em 485 nm/535 nm处测定荧光强度,评估RAW264.7细胞的吞噬能力。
1.5.4 NO、TNF-α、IL-6和IL-1β含量测定 RAW264.7细胞培养及处理同“1.5.2”,收集细胞培养上清液。根据NO测定试剂盒和ELISA试剂盒说明书测定RAW264.7细胞上清液中NO、TNF-α、IL-6和IL-1β的含量。
1.6 树莓多糖组分的体外抗氧化活性
1.6.1 DPPH·自由基清除能力测定 配置不同质量浓度的树莓多糖组分样品溶液(5、10、20、40、80、160、320 μg/mL),分别取2 mL置于试管中,随后加入2 mL浓度为0.2 mmol/L的DPPH-乙醇溶液,摇匀,于37 ℃避光反应30 min,在517 nm处测定吸光度,并按照以下公式计算 DPPH·[JP4]清除率[31]。以抗坏血酸(VC)作为阳性对照。
DPPH·清除率=[A0-(A1-A2)]/A0 × 100%
式中:A0为2 mL DPPH-乙醇与2 mL无水乙醇混合溶液的吸光值;A1为2 mL树莓多糖组分样品与2 mL无水乙醇混合溶液的吸光值;A2为2 mL树莓多糖组分样品与2 mL DPPH-乙醇混合溶液的吸光值。
1.6.2 ABTS·+自由基清除能力测定 将5 mL浓度为7 mmol/L的ABTS·+溶液与等体积浓度为2.45 mmol/L过硫化钾溶液混合,4 ℃避光保存16 h,用无水乙醇稀释,使其在734 nm处吸光值为0.70±0.02。取不同浓度的多糖溶液与ABTS·+工作液各1.5 mL,充分混匀后,避光反应6 min后于734 nm处测定吸光度,以VC为阳性对照,计算ABTS·+清除率[32]。
ABTS·+清除率= (A0-A1)/A0×100%
式中:A0为空白(无水乙醇)的吸光值;A1为RPP-6样品的吸光值。
1.7 数据分析
对数据采用IBM SPSS统计软件(第26版)进行统计学分析。试验数据均以“平均值±标准偏差”表示,采用ANOVA单因素方差分析进行组间比较。P<0.05为显著性差异,P<0.01为极显著差异。
2 结果与分析
2.1 多糖的分离与纯化
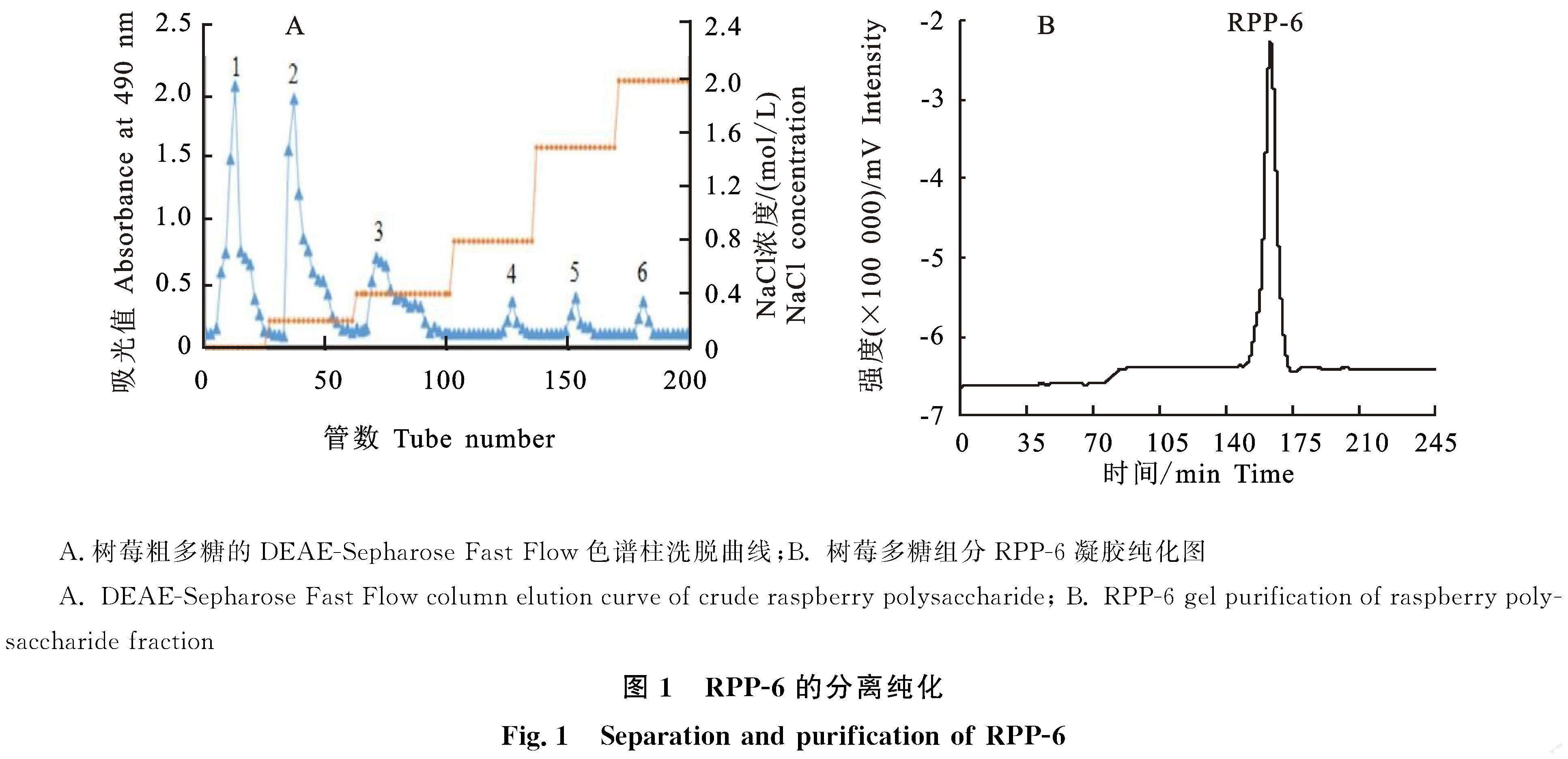
如图1-A所示,在DEAE-Sepharose Fast Flow离子交换层析柱上经不同浓度氯化钠(0 mol/L、0.2 mol/L、0.4 mol/L、0.8 mol/L、1.5 mol/L、2.0 mol/L)溶液洗脱后获得6种组分,分别命名为组分1、组分2、组分3、组分4、组分5和组分6。其中,组分1为中性多糖,组分2~6均为酸性多糖。收集组分6(2.0 mol/L氯化钠洗脱),利用Sephadex G-200葡聚糖凝胶柱进一步纯化。由图1-B可知,经水洗脱后在163.447 min只出现一个对称峰,说明该组分具有较好的分子质量均一性,并命名为RPP-6。
2.2 RPP-6的结构特性分析
2.2.1 RPP-6的分子质量分析
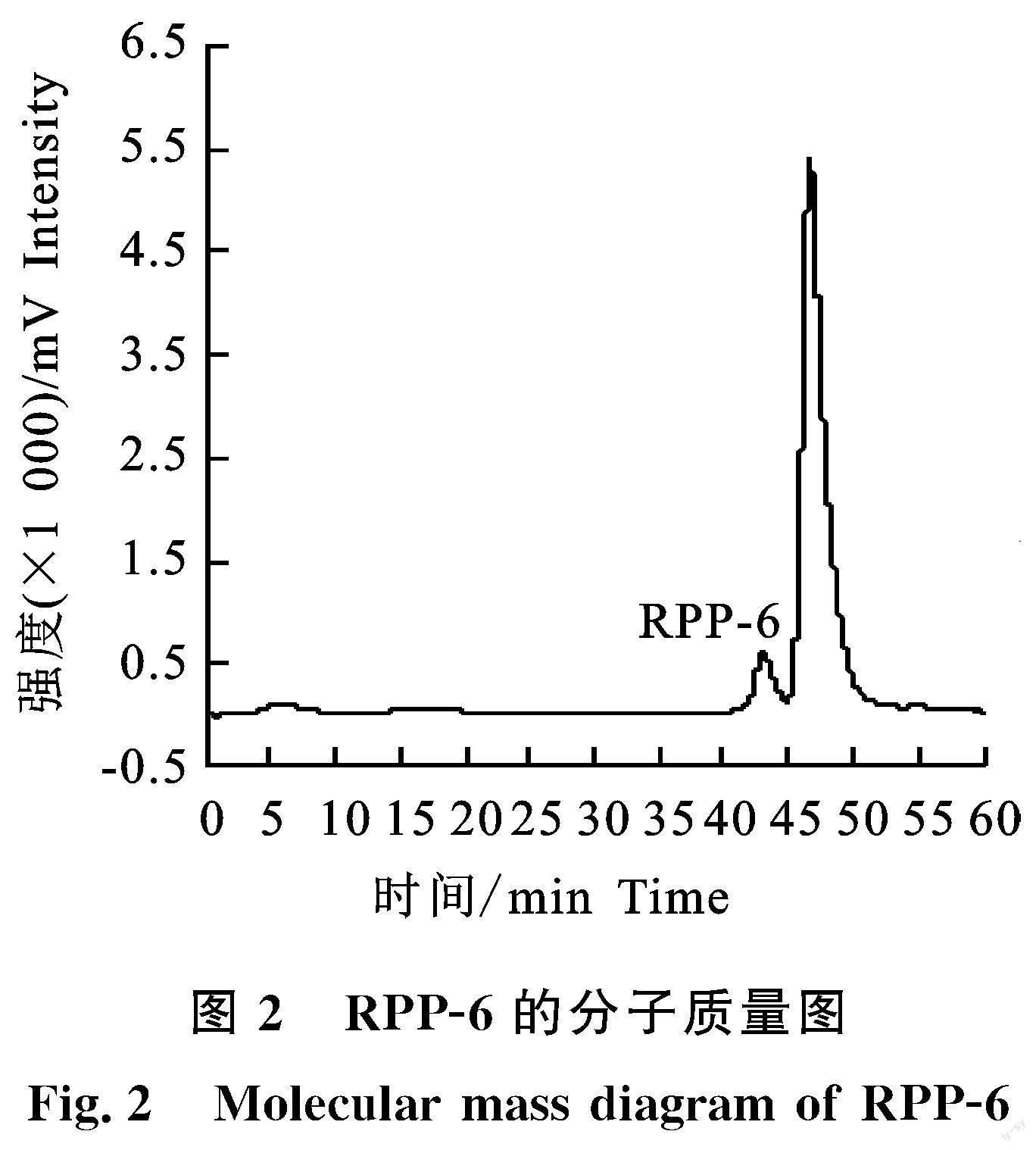
树莓多糖组分RPP-6的HPGPC色谱图如图2所示,由图可知,在保留时间为43.315 min處出现一个对称多糖峰(保留时间为46.708 min处为流动相峰),由此也可以看出RPP-6是分子质量均一的多糖组分。根据标准品校准曲线,得出RPP-6的峰位分子质量为7.645 ku、重均分子质量为7.769 ku、数均分子质量为6.310 ku。
2.2.2 RPP-6的单糖组成分析 利用GC-MS分析各单糖标准品及树莓多糖组分RPP-6的乙酰化衍生物,根据保留时间确定RPP-6的单糖种类,通过峰面积计算得出各单糖的摩尔百分比。由图3可见,RPP-6由阿拉伯糖(Ara)、葡萄糖(Glc)、半乳糖(Gal)、鼠李糖(Rha)和甘露糖(Man)组成,摩尔比为37.8∶30.8∶21.4∶ 6.0∶ 3.9。其中,阿拉伯糖、葡萄糖和半乳糖的含量较高。
2.2.3 RPP-6的红外光谱分析 如图4所示,在红外光谱中吸收带为3 600~3 200 cm-1是-OH的伸缩振动吸收峰,这个区域的吸收峰是糖类的特征峰[33]。具体如下:3 428 cm-1是O-H的伸缩振动吸收峰,是糖类的特征峰[34];在1 633 cm-1处有一个吸收峰,归属于结合水[35];1 413 cm-1有吸收峰,归属于C-O伸缩振动[36];1 143 cm-1处为C-O的伸缩振动峰[37];在871 cm-1处有特征峰,可能为端基差向异构C-H以外的赤道键的C-H变角振动[38]。
2.2.4 RPP-6的甲基化分析 将RPP-6的乙酰化产物经过GC-MS分析,得出如图5所示15个主峰,根据Complex Carbohydrate Structure Database(https://www.ccrc.uga.edu/specdb/ms/pmaa/pframe)数据库分析得出RPP-6中糖残基的15种连接方式,见表1。其中,阿拉伯糖存在5种甲基化产物,即2,3,5-Me3-Araf、2,3,4-Me3-Arap、2,5-Me2-Araf、2,3-Me2-Araf和2,4-Me2-Arap,呋喃型阿拉伯糖占26.98%,吡喃型阿拉伯糖占4.37%。表明RPP-6中阿拉伯糖主要以呋喃环的形式存在,其连接方式以Araf-(1→,→5)-Araf-(1→为主,分别约占20.64%和 5.31%;葡萄糖存在5种甲基化产物,均以吡喃环的形式存在,即2,3,4,6-Me4-Glcp、2,3,6-Me3-Glcp、2,6-Me2-Glcp、4,6-Me2-Glcp和2,3-Me2-Glcp,这些糖残基的连接方式主要为→4,6)-Glcp-(1→、→4)-Glcp-(1→,→3和4)-Glcp-(1→,占比约为 8.59%、4.41%和4.31%;半乳糖存在4种甲基化产物,分别为2,3,4,6-Me4-Galp、2,3,6-Me3-Galp、2,4,6-Me3-Galp和2,4-Me2-Galp,这些糖残基表明RPP-6中半乳糖以吡喃环的形式存在,其连接方式主要由→4)-Galp-(1→和→3,6)-Galp-(1→组成,分别约占24.04%和3.77%;木糖只出现1种以吡喃环的甲基化产物,即2,3-Me2-Xylp,其连接方式为→4)-Xylp-(1→,约占16.92%。以上结果表明,RPP-6是具有多支链结构的杂多糖。
2.3 RPP-6的免疫调节活性
2.3.1 RPP-6对RAW264.7细胞活力的影响 如图6所示,与空白对照组(图中用0 μg/mL表示)相比,RPP-6在20~160 μg/mL极显著增强RAW264.7细胞的细胞活力(P<0.01),且具有明显的剂量依赖性。
2.3.2 RPP-6对RAW264.7细胞吞噬能力的影响 如图7所示,与空白对照组(图中用0 μg/mL表示)相比,经20 μg/mL RPP-6处理后,RAW264.7细胞的吸光值极显著升高(P< 0.01);RPP-6为40~160 μg/mL时,RAW264.7细胞的吸光值显著升高(P<0.05),说明RPP-6能够明显增强RAW264.7细胞的吞噬能力。
2.3.3 RPP-6对RAW264.7细胞产生NO、TNF-α、IL-6以及IL-1β的影响 如图8-A和8-B所示,经20~160 μg/mL的RPP-6处理后,与空白对照组(图中用0 μg/mL表示)相比,RAW264.7细胞中NO和TNF-α的含量均极显著升高(P<0.01),并呈现出明显的剂量依赖性;图8-C结果显示,当RPP-6为40~160 μg/mL时,与空白对照组相比,RAW264.7细胞中IL-6的含量均极显著升高(P<0.01);图8-D所示,RAW264.7细胞经40~160 μg/mL的RPP-6处理后,其IL-1β的含量与空白对照组相比显著升高,当RPP-6为40 μg/mL时,RAW264.7细胞的IL-1β含量极显著升高(P<0.01)。因此,RPP-6可以明显刺激巨噬细胞产生NO,并分泌TNF-α、IL-6以及IL-1β。
2.4 RPP-6的体外抗氧化活性
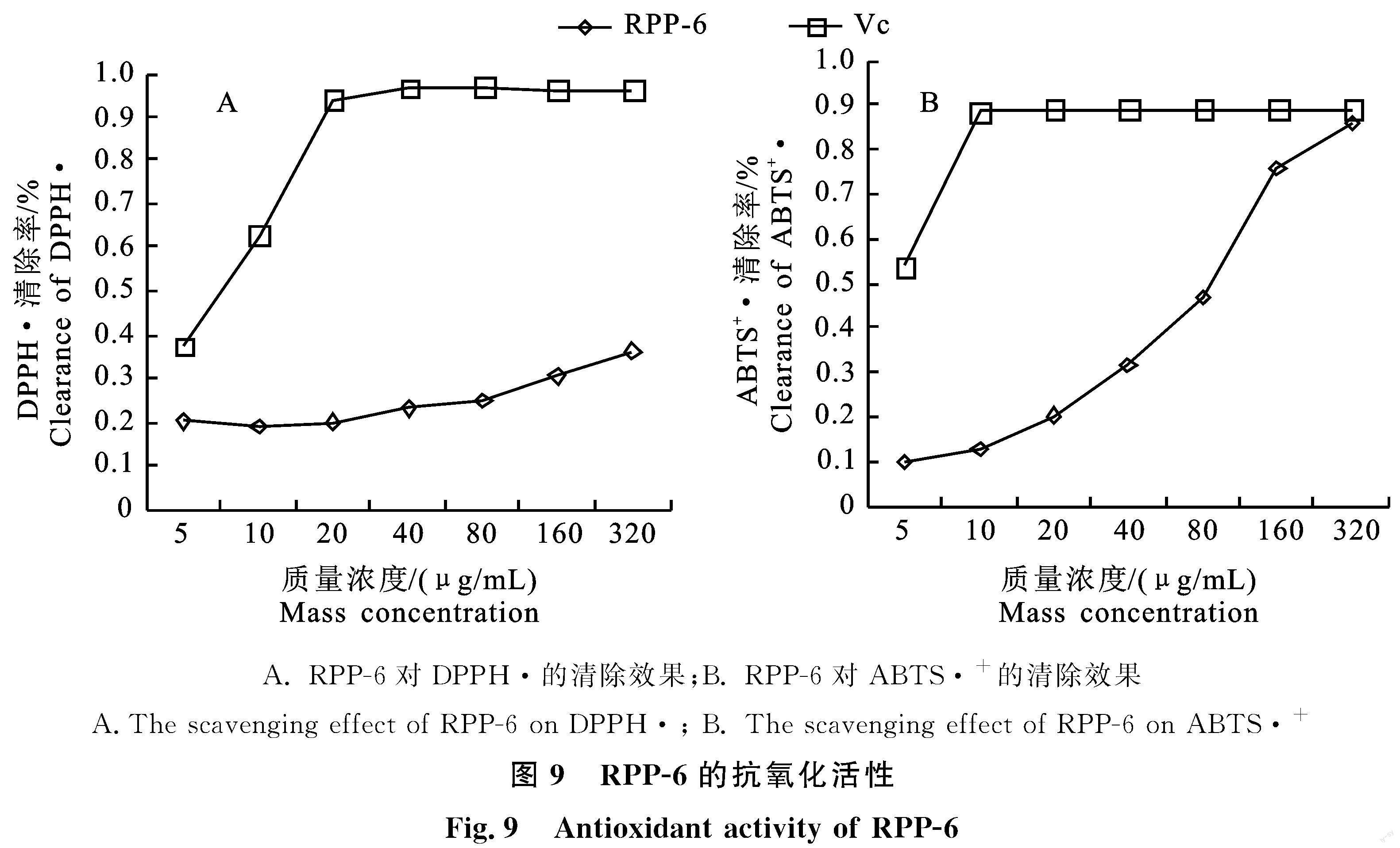
如图9-A所示,阳性对照VC为20~320 μg/mL时对DPPH·清除率均在96%左右。树莓多糖组分RPP-6的质量浓度大于40 μg/mL时,随着其质量浓度升高,DPPH·清除率逐渐增强,当RPP-6为320 μg/mL时,DPPH·清除率为36%。
图9-B结果显示,VC为10~320 μg/mL时ABTS·+清除率均维持在90%左右,RPP-6对ABTS·+的清除能力与其质量浓度呈正相关,随着质量浓度增大,清除自由基能力越强,且当RPP-6为320 μg/mL时,ABTS·+清除率达到86%,与VC在此质量浓度下的清除率接近,说明RPP-6具有较强的清除ABTS·+能力。
3 讨论与结论
本研究对树莓多糖组分RPP-6进行分子质量、单糖组成、傅里叶红外光谱和甲基化分析,其结构特征如下:由阿拉伯糖、葡萄糖、半乳糖、鼠李糖和甘露糖5種单糖组成,摩尔比为37.8∶30.8∶21.4∶6.0∶3.9;峰位分子质量为7.645 ku、重均分子质量为7.769 ku、数均分子质量为 6.310 ku;糖链中共含有15种糖残基的连接方式,其中Araf-(1→、→4,6)-Glcp-(1→、→4)-Galp-(1→和→4)-Xylp-(1→为其主要的单糖连接方式。研究表明,来源于东北农业大学园艺站的树莓果实粗多糖经D4020树脂柱和Sephadex G-100葡聚糖凝胶柱分离纯化后获得多糖组分RCP Ⅱ。RCP Ⅱ的分子质量为3.9 ku,由鼠李糖、阿拉伯糖、木糖、葡萄糖和半乳糖组成,其摩尔比为1∶2.07∶0.72∶0.85∶3.54[25]。Sahragard等[24]从树莓根部提取并分离纯化得到一种杂多糖RAPS-1,由葡萄糖、半乳糖和葡萄糖醛酸组成,摩尔比为6.2∶1.0∶1.2,分子质量为7.9 ku。RAPS-1的主链由→4)-Glcp-(1→构成,分支由α-D-Galp-(1→和α-D-GlcAp构成。Yu等[39]利用D4020柱和Sephadex G-100柱纯化得到的树莓多糖组分RCP-II由半乳糖醛酸、鼠李糖、阿拉伯糖、木糖、葡萄糖和半乳糖组成,摩尔比为 1.00∶0.55∶1.19∶0.52∶0.44∶1.90,分子质量为4.013 ku。本研究采用的树莓冷冻果源自青海湟源,经DEAE-Sepharose Fast Flow和Sephadex G-200凝胶柱分离纯化得到的树莓多糖组分RPP-6的分子质量、单糖组成以及连接方式与上述其他多糖相比存在一定的差异。可见,不同的树莓品种、提取部位、提取方式和条件可能是造成树莓多糖结构差异的主要原因[30, 39-40]。
多糖的生物活性与其结构特征密切相关,如分子质量、单糖组成以及连接方式的特征等[41]。研究发现,无论是低分子质量多糖还是高分子质量多糖均具有不同的免疫调节作用[30]。低分子质量的多糖结构简单,跨膜阻力小,有利于其免疫活性的发挥[42]。相比之下,一些高分子质量的多糖由于存在更多的受体,也显示出较强的免疫调节作用[43]。本研究结果显示,RPP-6的峰位分子质量为7.645 ku、重均分子质量为7.769 ku、数均分子质量为6.310 ku,其分子质量介于低分子质量与高分子质量之间,利于其免疫增强活性的发挥。除分子质量外,单糖组成也是影响多糖免疫活性的重要因素。研究表明,阿拉伯糖、半乳糖、木糖和甘露糖的含量越高,多糖增强巨噬细胞免疫活性的能力越强[44]。例如,牵牛子多糖组分PNP-5能够抑制小鼠脾淋巴细胞增殖能力,具有免疫增强活性,PNP-5主要由鼠李糖、葡萄糖醛酸、木糖、阿拉伯糖、甘露糖和半乳糖构成,其摩尔百分比为32.3%、17.4%、13.7%、13.7%、9.9%和5.3%[45]。单糖组成对抗氧化活性也有一定影响。茯苓多糖由葡萄糖、半乳糖、葡萄糖醛酸组成,其摩尔百分比为99.24%、0.41%和0.35%,其中葡萄糖的含量最高,具有一定的抗氧化活性[46]。RPP-6中阿拉伯糖、葡萄糖和半乳糖含量较高,提示RPP-6可能具有较强的免疫增强活性和抗氧化活性。此外,连接方式也是影响多糖生物活性的因素之一。胀果甘草酸性多糖具有免疫增强活性,其多糖组分Gi P-B1的主要连接方式由1,5-Araf、1,4-GalpA、1-Araf和1,3-Galp构成[47]。孙延平等[45]发现牵牛子多糖组分PNP-5具有显著的抗氧化能力,其糖残基连接方式主要为1,2-Rhap、1,4,6-Manp和1,3,6-Galp。本研究中,RPP-6也存在1,4-Galp、1-Araf、1,5-Araf,1,3,6-Galp和1,3-Galp,说明RPP-6可能具有增强免疫和抗氧化作用。
巨噬细胞是趋化因子、基质金属蛋白酶和其他炎症介质的重要来源,在免疫调节中发挥着吞噬细菌、识别病原体、激活其他免疫细胞等作用[48]。TNF-α、IL-6、IL-1β等细胞因子和NO在炎症反应和免疫反应的调节中也发挥重要作用[49]。TNF-α主要由激活的单核巨噬细胞产生,可以通过激活中心粒细胞和淋巴细胞,促使其他细胞因子的合成和释放,同时,TNF-α还可以诱导巨噬细胞纤维化,促进组织修复[50];IL-1β是由炎症小体介导激活的细胞因子,能够激活中心粒细胞和巨噬细胞吞噬病原体,在免疫反应中至关重要[51];IL-6是由巨噬细胞产生的关键细胞因子之一,与免疫细胞的调节、增殖和分化等密切相关[52];NO是参与免疫反应和炎症反应的重要物质,具有促进巨噬细胞免疫调节活性的作用[53]。研究发现,很多植物多糖是通过影响巨噬细胞的功能来发挥其免疫调节作用[54]。本研究通过巨噬细胞RAW264.7的细胞活力和吞噬能力以及细胞中NO和相关细胞因子的分泌来评估RPP-6的免疫调节活性。结果表明,RPP-6能够明显提高RAW264.7细胞的活力和吞噬能力,并促进细胞中NO和细胞因子TNF-α、IL-6、IL-1β的产生,说明RPP-6具有显著的免疫增强活性。自由基是外部轨道中含有一个或多个不成对电子的化学物质,可以作为分子信号激活有益的应激反应,但过量的自由基会引起组织的氧化损伤和功能障碍[55]。DPPH·和ABTS·+自由基是评估抗氧化活性最常用的指标之一,它们已广泛应用于天然产物的清除活性研究中[32, 56]。体外抗氧化试验结果表明,RPP-6清除DPPH·能力不强,但对ABTS·+清除率高达86%,说明RPP-6可能通过清除ABTS·+发挥其抗氧化活性。
综上所述,树莓多糖组分RPP-6是由阿拉伯糖、葡萄糖、半乳糖、鼠李糖和甘露糖组成的一种多支链的酸性杂多糖,具有显著的免疫增强活性和一定的抗氧化活性,在功能性食品、化妆品、食品添加等方面有广泛的开发前景。
参考文献 Reference:
[1] 周 双,孙兰英,杨 光,等.20个品种树莓果实品质评价[J].食品研究与开发,2022,43(2):171-176.
ZHOU SH,SUN L Y,YANG G,et al.Evaluation of fruit quality of twenty varieties of raspberry[J].Food Research and Development,2022,43(2):171-176.
[2] 黄永桥,高 亮,张群英,等.树莓中氨基酸、矿物元素及维生素含量分析与营养评价[J].食品与发酵工业,2022, 48(15):295-302.
HUANG Y Q,GAO L,ZHANG Q Y,et al.Quantitative analysis and nutritional evaluation of amino acids,mineral elements and vitamins inraspberry[J].Food and Fermentation Industries,2022,48(15):295-302.
[3] 石永芳.覆盆子的营养成分和药理作用的研究进展[J].山东化工,2017,46(6):71-72.
SHI Y F.Raspberry research progress of nutritional ingredients and pharmacological effects[J].Shandong Chemical Industry,2017,46(6):71-72.
[4] 廖天月,詹志来,徐 瑾,等.覆盆子本草考证[J].中国中药杂志,2021,46(10):2607-2616.
LIAO T Y,ZHAN ZH L,XU J,et al.Herbal textual research on Rubi Fructus[J].China Journal of Chinese Materia Medica,2021,46(10):2607-2616.
[5] 尹 蓉,霍辰思,张倩茹,等.树莓的功能性成分及其影响因素[J].中国果菜,2020,40(5):65-70.
YIN R,HUO CH S,ZHANG Q R,et al.Functional components and influencing factors of raspberry[J].China Fruit & Vegetable,2020,40(5):65-70.
[6] 尹 蓉,張倩茹,茹建生,等.红树莓山楂复合乳酸菌发酵饮料的工艺[J].食品工业,2022,43(1):117-121.
YIN R,ZHANG Q R,RU J SH,et al.Process on red raspberry and hawthorn compounded lactobacillus fermented beverage[J].The Food Industry,2022,43(1):117-121.
[7] RATTANAWIWATPONG P,WANITPHAKDEEDECHA R,BUMRUNGPERT A,et al.Anti-aging and brightening effects of a topical treatment containing vitamin C,vitamin E,and raspberry leaf cell culture extract:a split-face,randomized controlled trial[J].Journal of Cosmetic Dermatology,2020,19(3):671-676.
[8] SU X H,DUAN R,SUN Y Y,et al.Cardiovascular effects of ethanol extract of Rubus chingii Hu (Rosaceae) in rats:an in vivo and in vitro approach[J].Journal of Physiology and Pharmacology,2014,65(3):417-24.
[9] HUANG G,MEI X,HU J.The antioxidant activities of natural polysaccharides[J].Current Drug Targets,2017, 18(11):1296-1300.
[10] YANG W,ZHAO P,LI X,et al.The potential roles of natural plant polysaccharides in inflammatory bowel disease:a review[J].Carbohydrate Polymers,2022,277:118821.
[11] LIU C,CUI Y,PI F,et al.Extraction,purification,structural characteristics,biological activities and pharmacological applications of acemannan,a polysaccharide from aloe vera:a review[J].Molecules,2019,24(8):1554.
[12] MU S,YANG W,HUANG G.Antioxidant activities and mechanisms of polysaccharides[J].Chemical Biology & Drug Design,2021,97(3):628-632.
[13] 安 樂,赵秋云,覃裴溪,等.太白蓼多糖的硫酸化修饰及其体外抑菌活性分析[J].西北农业学报,2016,25(10):1541-1547.
AN L,ZHAO Q Y,TAN P X,et al.Sulfate modification of polygonum taipaishanease kung polysaccharide and antibacterial activity of modified products in vitro[J].Acta Agriculturae Boreali-occidentalis Sinica,2016,25(10):1541-1547.
[14] MIAO Y,YING Z,HUA L.Advances in research on immunoregulation of macrophages by plant polysaccharides[J].Frontiers in Immunology,2019,10:145.
[15] 徐光沛,蒋 平,何燕飞,等.构树叶粗多糖对环磷酰胺诱导免疫抑制小鼠免疫功能的影响[J].西北农业学报,2022,37(7):1-8.
XU G P,JIANG P,HE Y F,et al.Effect of crude polysaccharide from broussonetia papyrifera leaves on immune function of immunosuppressed mice induced by cyclophosphamide[J].Acta Agriculturae Boreali-occidentalis Sinica,2022,31(7):1-8.
[16] 刘 倩,郭志廷,张 康,等.黄芪多糖对巨噬细胞天然免疫调节的研究进展[J].中国畜牧兽医,2022,49(5):1746-1756.
LIU Q,GUO ZH T,ZHANG K,et al.Research progress on Astragalus polysaccharide on innate immunalregulation of macrophage[J].China Animal Husbandry &Veterinary Medicine,2022,49(5):1746-1756.
[17] LIU Y,HUANG G.Extraction and derivatisation of active polysaccharides[J].Journal of Enzyme Inhibition and Medicinal Chemistry,2019,34(1):1690-1696.
[18] CHEN F,HUANG G,YANG Z,et al.Antioxidant activity of Momordica charantia polysaccharide and its derivatives[J].International Journal of Biological Macromolecules,2019,138:673-680.
[19] 徐丽萍,吴媛媛,王 鑫,等.响应曲面法优化红树莓多糖提取工艺[J].中国食品添加剂,2017(9):182-187.
XU L P,WU Y Y,WANG X,et al.Optimization of red raspberry polysaccharide extraction process by response surface methodology[J].China Food Additives,2017(9):182-187.
[20] 吴 云,陈 薇,田文慧,等.树莓果肉多糖超声提取工艺优化及其抗疲劳作用[J].天然产物研究与开发,2020,32(12):2081-2093.
WU Y,CHEN W,TIAN W H,et al.Ultrasonic extraction optimization of raspberry (Rubus idaeus L.) pulp polysaccharides and its anti-fatigue activity[J].Natural Product Research and Development,2020,32(12):2081-2093.
[21] BABY B,ANTONY P,VIJAYAN R.Antioxidant and anticancer properties of berries[J].Critical Reviews in Food Science and Nutrition,2018,58(15):2491-2507.
[22] ZHANG T T,LU C L,JIANG J G,et al.Bioactivities and extraction optimization of crude polysaccharides from the fruits and leaves of Rubus chingii Hu[J].Carbohydrate Polymers,2015,130:307-315.
[23] YANG Y J,XU H M,SUO Y R.Raspberry pulp polysaccharides inhibit tumor growth via immunopotentiation and enhance docetaxel chemotherapy against malignant melanoma in vivo[J].Food & Function,2015,6(9):3022-3034.
[24] KONG Y,HU Y,LI J,et al.Anti-inflammatory effect of a novel pectin polysaccharide from Rubus chingii Hu on colitis mice[J].Frontiers in Nutrition,2022,9:868657.
[25] 滕 歆.树莓果实多糖的提取纯化、结构鉴定及生物活性的研究[D].哈尔滨:东北农业大学,2014.
TENG X.Studies on extraction,purification,structure analysis and biological activityof polysaccharides in raspberry fruit[D].Harbin:Northeast Agricultural University,2014.
[26] 杨永晶,韩丽娟,索有瑞.树莓多糖中单糖组成的GC-MS分析[J].分析试验室,2015,34(6):688-691.
YANG Y J,HAN L J,SUO Y R.Analysis the monosaccharide composition in raspberry polysaccharides by gas chromatography mass spectrometry[J].Chinese Journal of Analysis Laboratory,2015,34(6):688-691.
[27] 刘玉佳,孔繁东,刘兆芳,等.桔梗多糖Sevag法除蛋白工艺的研究[J].中国调味品,2014,39(4):5-7.
LIU Y J,KONG F D,LIU ZH F,et al.Research on technology of deproteinization from polysaccharide of Platycodon grandiflorum by Sevagmethod[J].China Condiment,2014,39(4):5-7.
[28] ZHANG X,WANG L,XIE F,et al.A polysaccharide TKP-2-1 from Tamarindus indica L:purification,structural characterization and immunomodulating activity[J].Journal of Functional Foods,2021,78(2):104384.
[29] ZAVREL T,OENOV P,SINETOVA M A,et al.Determination of storage (starch/glycogen) and total saccharides content in algae and cyanobacteria by a phenol-sulfuric acid method[J].Bio-protocol,2018,8(15):e2966.
[30] YANG Y,YIN X,ZHANG D,et al.Isolation,structural characterization and macrophage activation activity of an acidic polysaccharide from raspberry pulp[J].Molecules,2022,27(5):1674.
[31] 张子木,黄秀芳,张 琴,等.壶瓶碎米荠多糖硫酸化结构修饰及抗氧化活性研究[J].中国粮油学报,2021,36(12):28-33.
ZHANG Z M,HUANG X F,ZHANG Q,et al.Sulfated structure modification and antioxidant activity of Cardamine Hupingshanensis polysaccharide[J].Journal of the Chinese Cereals and Oils,2021,36(12):28-33.
[32] 韋 志,阮心眉,戴涛涛,等.碱提砂仁多糖的结构表征及其抗氧化活性研究[J].食品工业科技,2021,42(24):87-93.
WEI ZH,RUAN X M,DAI T T,et al.Structure characterization and antioxidant activity of polysaccharides from amomum villosum extracted with alkaline solution[J].Science and Technology of Food Industry,2021,42(24):87-93.
[33] 高 涛,唐华丽,罗振宇,等.川明参粗多糖初级结构解析及其体外抗氧化活性[J].中国食品学报,2021,21(8):275-282.
GAO T ,TANG H L,LUO ZH Y,et al.Primary structure analysis and antioxidant activity in vitro of crude polysaccharide from Chuanminshen violaceum[J].Journal of Chinese Institute of Food Science and Technology,2021,21(8):275-282.
[34] LIYASKINA E V,RAKOVA N A,KITYKINA A A,et al.Production and сharacterization of the exopolysaccharide from strain Paenibacillus polymyxa 2020[J].PLoS One,2021,16(7):e0253482.
[35] LIU Y,HEE-JIN K.Fourier transform infrared spectroscopy (FT-IR) and simple algorithm analysis for rapid and non-destructive assessment of developmental cotton fibers[J].Sensors,2017,17(7):1469.
[36] AIPIRE A,YUAN P,AIMAIER A,et al.Preparation,characterization,and immuno-enhancing activity of polysaccharides from Glycyrrhiza uralensis[J].Biomolecules,2020,10(1):159.
[37] LI C Y,LIU L,ZHAO Y W,et al.Inhibition of calcium oxalate formation and antioxidant activity of carboxymethylated poria cocos polysaccharides[J].Oxidative Medicine and Cellular Longevity,2021,2021:1-19.
[38] ZHOU Y,QIAN C,YANG D,et al.Purification,structural characterization and immunomodulatory effects of polysaccharides from Amomumvillosum Lour.on RAW 264.7 macrophages[J].Molecules,2021,26(9):2672.
[39] YU Z,LIU L,XU Y,et al.Characterization and biological activities of a novel polysaccharide isolated from raspberry (Rubus idaeus L.) fruits[J].Carbohydrate Polymers,2015,132:180-186.
[40] SAHRAGARD N,JAHANBIN K.Structural elucidation of the main water-soluble polysaccharide from rubus anatolicus roots[J].Carbohydrate Polymers,2017,175:610-617.
[41] XU S Y,HUANG X,KIT-LEONG C.Recent advances in marine algae polysaccharides:isolation,structure,and activities[J].Marine Drugs,2017,15(12):388.
[42] SUN Y,ZHANG Z,CHENG L,et al.Polysaccharides confer benefits in immune regulation and multiple sclerosis by interacting with gut microbiota[J].Food Research International,2021,149:110675.
[43] XIN M,LIANG H,LUO L.Antitumor polysaccharides from mushrooms:a review on the structural characteristics,antitumor mechanisms and immunomodulating activities[J].Carbohydrate Research,2016,424:30-41.
[44] LO T,YI H J,CHAO A,et al.Use of statistical methods to find the polysaccharide structural characteristics and the relationships between monosaccharide composition ratio and macrophage stimulatory activity of regionally different strains of Lentinula edodes[J].Analytica Chimica Acta,2007,584(1):50-56.
[45] 孫延平,王博譞,刘 艳,等.牵牛子多糖PNP-5的结构表征及体外生物活性研究[J].中医药学报,2021,49(8):42-48.
SUN Y P,WANG B X,LIU Y,et al.Structure characterization and in vitro bioactivities of polysaccharide PNP- 5 from pharbitis nil[J].Acta Chinese Medicine and Pharmacology,2021,49(8):42-48.
[46] 王 帥,赵冬雪,韩成凤,等.6种活性多糖的结构、性质及其抗氧化活性的比较研究[J].食品研究与开发,2021,42(16):7-15.
WANG SH,ZHAO D X,HAN CH F,et al.A comparative study on the structure,properties and antioxidant activity of six active polysaccharides[J].Food Research and Development,2021,42(16):7-15.
[47] 陈 橙,帕丽达·阿不力孜,米仁沙·牙库甫,等.胀果甘草酸性多糖的分离纯化、结构分析及免疫活性测定[J].食品安全质量检测学报,2017,8(12):4651-4658.
CHEN CH,PALIDA·ABULIZI,MIRENSHA·YAKUPU,et al.Isolation,purification,structural analysis and immune activity determination of acid polysaccharidesfrom Glycyrrhiza inflata Bat.[J].Journal of Food Safety & Quality,2017,8(12):4651-4658.
[48] WYNN T A,VANNELLA K M.Macrophages in tissue repair,regeneration,and fibrosis[J].Immunity,2016,44(3):450-462.
[49] CHENG X Q,LI H,YUE X L,et al.Macrophage immunomodulatory activity of the polysaccharides from the roots of Bupleurum smithii var.parvifolium[J].Journal of Ethnopharmacology,2010,130(2):363-368.
[50] SHIN M S,PARK S B,SHIN K S.Molecular mechanisms of immunomodulatory activity by polysaccharide isolated from the peels of citrus unshiu[J].International Journal of Biological Macromolecules,2018,112:576-583.
[51] LOPEZ-CASTEJON G,BROUGH.Understanding the mechanism of IL-1β secretion[J].Cytokine & Growth Factor Reviews,2011,22(4):189-195.
[52] RIDKER P M,RANE M.Interleukin-6 signaling and anti-interleukin-6 therapeutics in cardiovascular disease[J].Circulation Research,2021,128(11):1728-1746.
[53] ZHAO X,LI J,LIU Y,et al.Structural characterization and immunomodulatory activity of a water soluble polysaccharide isolated from botrychium ternatum[J].Carbohydrate Polymers,2017,171:136-142.
[54] KOUAKOU K,SCHEPETKIN I A,YAPI A,et al.Immunomodulatory activity of polysaccharides isolated from alchornea cordifolia[J].Journal of Ethnopharmacology,2013,146(1):232-242.
[55] MEO S D,VENDITTI P.Evolution of the knowledge of free radicals and other oxidants[J].Oxidative Medicine and Cellular Longevity,2020,2020(3):1-32.
[56] PAN Y,CHEN Y,LI Q,et al.The synthesis and evaluation of novel hydroxyl substituted chalcone analogs with in vitro anti-free radicals pharmacological activity and in vivo anti-oxidation activity in a free radical-injury alzheimers model[J].Molecules,2013,18(2):1693-1703.
Isolation, Structural Characterization, Immunoregulatory and Antioxidant Activity of Raspberry Polysaccharide RPP-6 in Vitro
Abstract In the present study, the raspberry polysaccharide RPP-6 was isolated from raspberry pulp,and its structural characteristics,immunomodulatory and antioxidant activities were studied in vitro. RPP-6 was isolated and purified by DEAE-Sepharose Fast Flow and Sephadex G-200 chromatography and thestructural characteristics of RPP-6 were studied by high-performance gel permeation chromatography (HPGPC), Fourier-transform infrared spectroscopy (FT-IR), gas chromatography-mass spectroscopy (GC-MS) and methylation. RAW264.7 macrophages and free radical scavenging tests were conducted to evaluate the immunomodulatory and antioxidant activities of RPP-6.The results showed that RPP-6 was composed of arabinose, glucose, galactose, rhamnose and mannose at a molar ratios of 37.8∶30.8∶21.4∶6.0∶3.9,respectively. The peak molecular mass, average molecular mass and number average molecular mass were 7.645 ku,7.769 ku, and 6.310 ku, respectively. RPP-6 was composed of 15 glycosyl linkages patterns, among which Araf-(1→, →4,6)-Glcp-(1→, →4)-Galp-(1→ and →4)-Xylp-(1→ were the main connection modes of sugar residues, accounting for about 20.64%, 8.59%, 24.04%, and 16.92%, respectively. RPP-6 significantly promoted the proliferation and phagocytosis of RAW264.7 cells and increased the release of tumor necrosis factor (TNF)-α, interleukin (IL)-6, IL-1β, and nitric oxide (NO) in RAW264.7 cells. RPP-6 exhibited strong ABTS·+ radical scavenging ability,but exhibited no DPPH· free radical scavenging ability. In conclusion, RPP-6 is a homogeneous acidic heteropolysaccharide with a complex multi-branched structure, and has significant immune-enhancing activity and certain antioxidant activity.
Key words Raspberry polysaccharide; Structural characterization; Immune activity; Antioxidant activity
