鸡传染性喉气管炎病毒微滴式数字PCR定量检测方法的建立
2024-04-11曾婷婷黄娇玲王盛李丹韦悠李小凤任红玉阮志华
曾婷婷 黄娇玲 王盛 李丹 韦悠 李小凤 任红玉 阮志华

摘 要 旨在建立检测鸡传染性喉气管炎病毒(infectious laryngotracheitis virus,ILTV)绝对定量方法。根据已发表的鸡ILTV的TK基因序列,针对其保守区域分别设计1 对特异引物和1 条探针,建立检测鸡ILTV的微滴式数字PCR(droplet digital PCR,ddPCR)方法,并评价其特异性、敏感性和重复性。结果显示,建立方法的最佳引物浓度为 20 μmol/μL,最佳探针浓度为10 μmol/μL,最佳退火温度为56 ℃。特异性检测结果显示,建立的方法只检出ILTV,没有检出其他病原株。敏感性检测结果显示,采用建立的方法定量检出ILTV重组质粒标准品的最低限为4.6 拷贝/μL。对3个连续稀释的pMD18-ILTV重組质粒DNA进行检测,3次重复检测结果的变异系数均小于5%。对83份病鸡喉拭子、肺及脾组织样品进行检测,采用建立的ddPCR检出ILTV阳性样品10份,荧光定量PCR检出ILTV阳性样品9份,ddPCR的阳性检出率(12.05%)高于荧光定量PCR的阳性检出率(10.84%)。结果表明,建立的ddPCR方法定量检测ILTV特异性强、敏感性高、重复性好,为绝对定量检测ILTV提供更好的技术支撑。
关键词 鸡传染性喉气管炎病毒;微滴式数字PCR;定量检测
鸡传染性喉气管炎病毒( infectious laryngotracheitis virus,ILTV)主要感染不同品种的鸡,引起鸡发生上呼吸道疾病,如流鼻涕、咳嗽等,通常会出现呼吸啰音,严重时出现呼吸困难及咳出带血液的渗出物,蛋鸡感染还会引起产蛋下降[1-3]。ILTV一旦感染鸡群,传播速度很快,在很短时间内可导致全部鸡感染。ILTV感染除引起鸡发病外,还可导致鸡特别是雏鸡死亡,病死率10%~70%不等,导致的直接经济损失巨大[4-6]。
近年来,随着鸡场中普遍使用ILTV疫苗进行免疫,鸡群中出现大面积暴发ILTV感染的病例有所降低,但仍有ILTV感染病例的发生,主要以呼吸道症状为主,特征性的症状如咳出带血液的渗出物较少,所引发的呼吸道症状与新城疫、低致病性禽流感、传染性支气管炎等表现的呼吸道症状类似,单凭临床症状很难作出判断,需要进一步借助实验室方法进行确诊。目前实验室常用鉴别诊断ILTV的方法有多种,如普通PCR[7-8]、金标试纸条[9]、荧光定量PCR[10-11]等,这些方法中还没有一种方法能绝对定量检测ILTV,尤其是缺乏针对低拷贝数ILTV(如感染早期)的绝对定量检测方法,因此需要建立一种敏感性好的绝对定量检测ILTV方法。
微滴式数字PCR(droplet digital PCR,ddPCR)是近几年发展起来的一种技术,该方法是将反应液通过油包水方式分为独立的数万个纳米微滴,每个微滴就是一个PCR反应单元,包含一个模板拷贝数,反应结束后读取逐个微滴的信号,根据统计学方法(泊松分布原理)自动统计反应的阳性微滴与阴性微滴的个数,并根据统计数据得出模板的拷贝数(浓度),从而实现对核酸的绝对定量检测。目前该技术在很多领域包括动物疫病病原检测方面已有很多成功应用的案例[12-14]。
本研究以ILTV TK基因序列为靶序列,针对其保守区设计1对引物和1条探针,并在探针的5′端添加FAM荧光基团,在3′端添加 BHQ1淬灭基团。通过优化引物浓度、探针浓度和退火温度等,建立绝对定量检测ILTV的ddPCR方法,为ILTV的定量检测提供技术支持。
1 材料与方法
1.1 材 料
1.1.1 试验用毒株 鸡传染性喉气管炎病毒(ILTV)北京(BJ)株购自中国兽医药品监察所,ILTV K317疫苗株购自广东永顺生物制药有限公司,ILTV CHP50疫苗株购自南京宁成生物科技有限公司。鸡传染性支气管炎病毒(Infectious bronchitis virus,IBV)Mass 41株、鸡新城疫病毒(Newcastle disease virus,NDV)LaSota株、禽呼肠孤病毒(Avian reovirus,ARV)S1133株、H9N2亚型禽流感病毒(H9N2 subtype avian influenza virus,H9N2AIV)066C株由广西兽医研究所兽医生物技术研究室保存[15]。鸡白痢沙门氏菌(Salmonella pullorum,SP)C79-13株和鸡大肠杆菌(Escherichia coli,E.coli)O2株购自中国国家兽医微生物菌株保藏管理中心。禽脑脊髓炎病毒(Avian encephalomyelitis virus,AEV)Van株、禽偏肺病毒(Avian metapneumonia virus,aMPV)MN-10株、鸡滑液囊支原体(Mycoplasma synovial,MS)K1415株、鸡毒支原体(Mycoplasma gallinis,MG)S6株由美国康涅狄格洲州立大学Khan教授惠赠。
1.1.2 主要试剂 Supermix for Probe ddPCR (No dUTP)、droplet generation oil for Probes ddPCR、Droplet Reader Oil、DG8Cartridges、DG8gaskets、Pierceable Foil Heat Seal购自美国Bio-rad公司。EasyPureVirual DNA/RNA Kit、Gel Extration Kit购自北京全式金生物技术有限公司。TIANamp Bacteria DNA kit购自天根生化科技(北京)有限公司。RT-PCR扩增试剂盒、Premix Ex Taq试剂盒、100 bp DNA Ladder、pMD18-T、大肠杆菌DH5α、T4连接试剂盒、凝胶回收试剂盒购自宝生物工程(大连)有限公司。
1.1.3 试验用鸡胚 试验用SPF种蛋购自北京勃林格殷格翰维通公司,SPF鸡胚由广西兽医研究所兽医生物技术研究室孵化至所需日龄。
1.1.4 主要仪器 微滴生成仪(QX200 Droplet generator)、热封仪(PX1)、微滴数字读取仪(QX200 Droplet Reader)、梯度PCR扩增仪(T-100)购自美国Bio-rad公司。荧光PCR仪(quant Studio 5)、分光光度计(Nanodrop 2000)购自美国Thermo Fisher Scientific公司。
1.2 方 法
1.2.1 引物设计与合成 根据已发表的ILTV TK基因(No.S83714.1)保守序列,利用在线https://bioinfo.ut.ee/primer3-0.4.0/软件设计ddPCR的引物和探针,应用BLAST在线比对设计的引物和探针序列,经综合分析后挑选1 对引物和1 条探针,在探针序列的5′端添加FAM荧光基团,3′端添加 BHQ1淬灭基团。引物及探针由生工生物工程(上海)股份有限公司合成并经HPLC纯化,所设计的引物和探针序列见表1。
1.2.2 病毒核酸提取 按EasyPure Virual DNA/RNA试剂盒说明书提取试验用病毒株的DNA/RNA,按TIANamp Bacteria DNA kit 说明书提取MS、MG、SP及E.coli的DNA,提取的DNA/RNA直接用于扩增或于-80 ℃保存,备用。
1.2.3 标准模板的制备 用ILTF/ILTR引物扩增ILTV BJ株的TK基因,扩增产物经电泳后,将含约243 bp的目的片段切下,按凝胶回收试剂盒说明书进行目的片段回收纯化,然后与pMD18-T载体连接并转染到大肠杆菌DH5α中。转染后的质粒DNA经PCR鉴定并送宝生物工程(大连)有限公司进行序列测定,测序正确的质粒DNA用分光光度仪测定浓度,并按公式计算拷贝数=(浓度×阿伏加德罗常数)/(1个碱基对的平均分子质量×总长度),所得的重组质粒DNA即为标准品,小管分装并保存于-80 ℃,备用。
1.2.4 ddPCR反应的建立及优化 20 μL反应体系:2×Supermix 10 μL,5~40 μmol/μL的ILT F/ILT R引物各1 μL,2.5~40 μmol/μL的ILT Pro 1 μL,标准模板2 μL,加灭菌 ddH2O补足至20 μL。微滴生成:在DG8Cartridges的第二排孔分别加入上述反应液20 μL,第三排每孔加入droplet generation oil 70 μL,盖上DG8gasket,置微滴生成仪上自动生成微滴于第一排孔。封膜:吸取生成的微滴至96 孔板内,加铝膜Pierceable Foil Heat Seal置 PX1 热封仪上,180 ℃ 10 s进行封膜。PCR扩增:封膜的96 孔板放入PCR扩增仪上进行扩增,反应程序:95 ℃ 10 min;94 ℃ 30 s,退火温度为50 ℃ ~60 ℃ 1 min (2 ℃/S),共进行40 个循环;98 ℃ 10 min;4 ℃ 结束。数据读取及分析:反应结束后将96孔板置QX200 Droplet Reader上读取信号并进行数据分析。
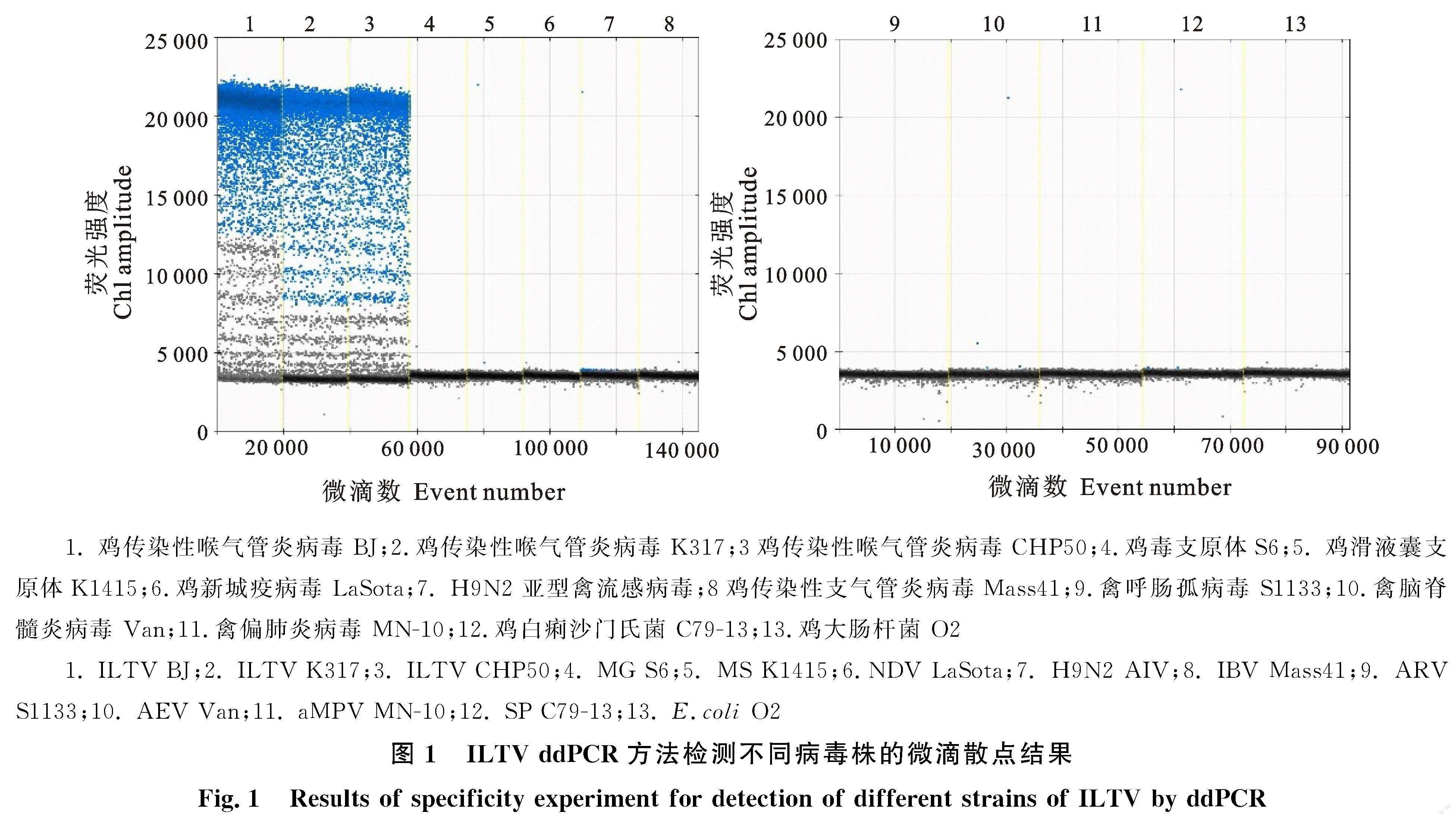
1.2.5 ddPCR特异性测定 将H9N2 AIV、IBV、NDV、aMPV、ARV、AEV的RNA反转录为cDNA,然后分别与ILTV BJ、ILTV K317、ILTV CHP50、MS、MG、SP、E.coli的DNA加入已优化好的ddPCR反应体系中进行特异性检测。
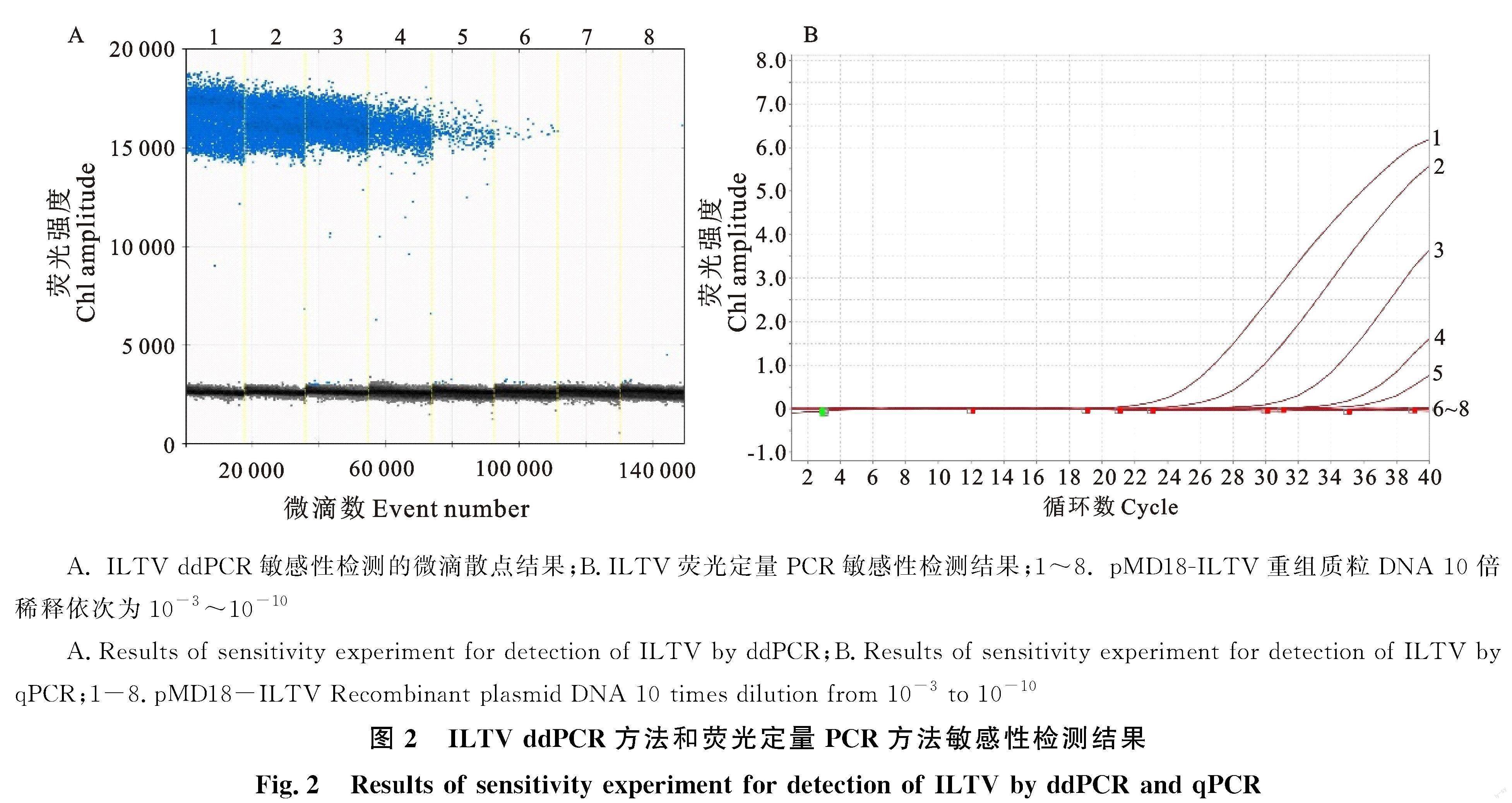
1.2.6 ddPCR灵敏性及重复性测定 测定ILTV重组质粒标准品浓度后,以10倍梯度稀释,为10-3~10-10,每个梯度取2 μL加入已优化好的ddPCR反应体系中,以检测ddPCR方法的敏感性。同时用同样的引物探针以及同一模板浓度进行荧光定量PCR检测,比较两种方法的敏感性。取10-5~10-7 3 个连续稀释的质粒标准品为模板进行3次重复试验,以检测ddPCR方法的重复性。
1.2.7 临床样品检测 将2020年5月至2021年12月采集的83份病鸡喉拭子、肺及脾组织样品,分别取肺及脾组织样品约5 g按1∶8(质量体积比)加入无血清的MDEM培养基进行研磨,喉拭子加入2 mL 无血清的MDEM培养基, -70 ℃反复冻融3 次,4 000 r/min离心5 min,取上清,按Easy Pure Virual DNA/RNA说明书步骤提取样品中的总DNA。用建立的ddPCR方法进行检测,同时按文献[10]中荧光定量PCR方法进行检测,比较两种检测方法的检测效果和符合率。
1.2.8 ILTV分离鉴定验证 对检出为ILTV阳性的样品采用鸡胚分离鉴定作进一步验证,阳性样品经“1.2.7”步骤离心后,取上清液,用0.22 μm的滤膜过滤。取滤液尿囊膜接种9日龄的SPF鸡胚,每胚接0.2 mL,然后置37 ℃恒温箱中培养,收集24~120 h的死胚和活胚的尿囊膜和尿囊液作为1代分离毒。按照同样方法继续传代至第3代,观察尿囊膜及胚体的病变,并取第3代鸡胚分离毒提取的核酸用文献[7]中PCR方法进行检测。
2 结果与分析
2.1 重组质粒标准品的鉴定结果
挑取的重组质粒经PCR鉴定,结果扩增到大小约243 bp的片段,经凝胶回收后送宝生物工程(大连)有限公司进行测序,用MegAlign软件将测定的序列与ILTV TK基因(No.S83714.1)序列进行Clustal W Method分析,发现测定的序列与ILTV TK基因的相应序列完全一致,将获得的重组质粒命名为pMD18-ILTV。用分光光度儀测定重组质粒pMD18-ILTV标准品OD260nm/OD280nm的值为1.95,质量浓度为46.5 mg/L,按公式计算拷贝数为1.44×1010拷贝/μL。
2.2 ddPCR反应条件优化结果
由图1可知,当ILTF/ILTR引物浓度和ILTPro浓度分别为20 μmol/μL和10 μmol/μL时,即ILTF/ILTR终浓度为1 μmol/μL,ILTPro终浓度为0.5 μmol/μL时,阳性微滴信号强,阳性微滴与阴性微滴之间的荧光信号区分明显,此时的引物、探针浓度为最佳反应浓度。采用最佳引物浓度和探针浓度,退火温度分别设为50 ℃、51 ℃、52 ℃、54 ℃、55 ℃、56 ℃、57 ℃、58 ℃、 60 ℃进行ddPCR反应,结果显示退火温度为 56 ℃时,阳性微滴信号(显示为蓝色)和阴性微滴信号(显示为黑色)之间的荧光信号区分明显,扩增获得的阳性微滴数最高,因此确定最佳退火温度为56 ℃。
2.3 优化后的ddPCR反应体系及程序
20 μL反应体系包括2×Supermix 10 μL,20 μmol/μL ILT F/ILTR引物各1 μL,10 μmol/μL ILTPro 1 μL,模板DNA/RNA 2 μL,用ddH2O 补足至20 μL。反应程序:95 ℃ 10 min;94 ℃ 30 s,设置退火温度56 ℃ 1 min (2 ℃/s),40个循环;98 ℃ 10 min;4 ℃结束。
2.4 ddPCR方法特异性测试结果
将H9N2AIV、IBV、NDV、aMPV、ARV、AEV的RNA反转录为cDNA,然后与ILTV BJ、ILTV K317、ILTV CHP50、MS、MG、SP、E.coli的DNA分别作为模板,采用优化的ddPCR反应体系和反应温度进行检测。结果显示,每孔扩增总微滴的生成量均达10 000以上,且较均衡,说明微滴扩增反应成立。出现阳性微滴的毒株有ILTV BJ、ILTV K317、ILTV CHP50,其他毒株无阳性微滴出现(图1)。表明该方法的特异性较强。
2.5 ddPCR方法灵敏性测定结果
由圖2可知,ddPCR方法检测重组质粒标准品的最低检测限为4.6 拷贝/μL(10-8稀释,图2-A),而荧光定量PCR方法最低只检测到10-7稀释的重组质粒标准品(45.4 拷贝/μL,图2-B),没有检出10-8稀释的重组质粒标准品。用4个连续稀释的ILTV重组质粒标准品拷贝数与检测阳性拷贝数的对数值绘制ddPCR检测的绝对定量曲线,结果为线性,线性方程为y=-1.06x+ 8.18,R2值为 0.997 9。结果见图3。
2.6 ddPCR方法重复性测定结果
采用3 组不同拷贝数的重组质粒标准品评估ddPCR方法的重复性,结果发现3组3次重复检测结果的变异系数分别为0.54%、0.53%、 2.53%,重复检测结果的变异系数均小于5%(表2)。表明本方法的重复性良好。
2.7 临床样品的检测结果
对83份病鸡喉拭子、肺及脾组织样品进行检测,ddPCR方法检测结果为ILTV阳性的样品有10份,分别为喉拭子样品6份、肺组织样品3份、脾组织样品1份,检出拷贝数为25.1~2 266拷贝/μL,阳性检出率为12.05%(10/83),73份样品为ILTV阴性。荧光定量PCR检测结果为ILTV阳性的样品有9份,分别来自喉拭子样品6份、肺样品3份,阳性检出率为10.84%(9/83),ddPCR方法检出ILTV的阳性率高于荧光定量PCR方法。部分样品检测结果见图4和表3。
2.8 ILTV分离鉴定验证结果
对ddPCR检测为ILTV阳性的10份样品,其中包含荧光定量PCR检测为阴性的1份脾样品,经尿囊膜接种9日龄SPF鸡胚,并连续传代3代。第3 代24 h至120 h的死胚及活胚经剖检后发现鸡胚尿囊膜变厚,膜上出现病毒痘斑,鸡胚胚体有出血点。提取第3 代分离毒的核酸,经PCR检测鉴定,10份都为ILTV阳性,从而进一步验证ddPCR检测的准确性。
3 讨 论
ILTV可引起鸡发病并导致鸡死亡,严重危害鸡的健康生长。为了有效防控ILTV感染鸡,目前最为有效的方法是采用ILTV疫苗进行预防免疫,可以说疫苗免疫在防控ILTV感染中发挥了关键作用,但是由于不同疫苗产生的保护力不同,在普遍免疫的情况下,鸡群中还时常会出现ILTV感染的情况,其症状与IBV、AIV、NDV等病原引起的呼吸道症状相似,难以区分,确诊需要借助实验室方法。而实验室快速检测鉴别的方法多是采用PCR或荧光定量PCR方法,但这两种方法在病毒载量较低如ILTV感染早期的情况下,第一时间往往检测不到病原,因此需要建立一种针对低病毒载量的检测方法。本研究在ILTV TK基因保守区设计引物,通过对引物浓度及反应条件等进行优化,建立了ILTV ddPCR检测方法,满足了对低拷贝病原检测的需要,且能绝对定量。特异性检测结果显示本方法只检出ILTV,没有检出常见的多种禽病病原且无交叉反应,说明本研究建立的ddPCR方法检测ILTV是特异的。
在建立ddPCR检测方法时,引物和探针浓度以及退火温度是影响ddPCR扩增的关键条件,为了获得更好的扩增效果,必须对所用的引物和探针浓度以及退火温度进行优化。本研究对引物和探针浓度以及退火温度进行优化,发现引物和探针终浓度分别为1 μmol/μL和0.5 μmol/μL,即引物与探针浓度比为2∶1,退火温度为56 ℃时,获得ILTV阳性微滴信号(蓝色)最强,阳性微滴与阴性微滴(黑色)之间区分明显,说明本研究建立的方法获得了最佳扩增效果。
ddPCR方法是在荧光定量PCR的基础上发展而来,且ddPCR方法在定量检测和灵敏性两方面要优于荧光定量PCR方法。在定量检测方面,荧光定量PCR是通过标准曲线及扩增的Ct值来计算出标准品的拷贝数,只能实现相对定量检测。而ddPCR方法则是通过直接计算反应的微滴数来实现对拷贝数的绝对定量检测,且受扩增效率的影响较小[16],检测的结果较准确。在灵敏性检测方面,已有很多报道证明ddPCR方法比荧光定量PCR方法灵敏,如刘洋等[17]和石磊等[18]建立的ddPCR检测方法其灵敏度比荧光定量PCR方法高10倍。本研究经灵敏性检测也证明了ddPCR检测方法比荧光定量PCR方法灵敏性高10倍,且从4个10倍倍比稀释的ILTV重组质粒标准品与测得值的拷贝数对数值之间呈良好的线性关系,进一步说明本研究建立的方法是可靠的。本方法的建立将有助于对低拷贝数如ILTV感染早期的检测诊断,为准确诊断以及有效防控ILTV感染提供技术支撑。
用本研究建立的ddPCR方法對临床采集的样品进行检测,同时采用荧光定量PCR方法进行对比检测,比较两者的符合性。通过对保存的已经确定阴阳性的83份病鸡喉拭子、肺组织及脾组织样品的核酸进行检测,ddPCR方法检出ILTV阳性样品10份,荧光定量PCR方法检出ILTV阳性样品9份。对10份ddPCR检测为ILTV阳性的样品包含1份荧光定量PCR检测为阴性的脾样品采用鸡胚增殖检测验证,经3代鸡胚传代增殖后,剖检发现鸡胚尿囊膜上出现病毒痘斑,鸡胚胚体有出血点。第3代分离毒的核酸经PCR检测10份样品均为ILTV阳性,从而进一步佐证了ddPCR方法的检测灵敏性比荧光定量PCR方法灵敏。鸡胚传代增殖检测虽然能获得较准确的检测结果,但是由于鸡胚传代增殖周期长,对样品要求高,不能及时快速作出判断。在快速检测方法中,能定量检测ILTV的只有荧光定量PCR方法,而本方法的建立,为绝对定量检测ILTV提供一种更加灵敏的方法。
参考文献 Reference:
[1] CRESPO R,WOOLCOCK P R,CHIN R P,et al.Comparison of diagnostics techniques in an outbreak of infectious laryngotracheitis from meat chickens[J].Avian Disease,2007,51(4):858-862.
[2] GOWTHAMAN V,KOUL M,KUMAR S.Avian infectious laryngotracheitis: a neglected poultry health threat in India[J].Vaccine,2016,34(36):4276-4277.
[3] CRAIG M I,ROJAS M F,VAN DER PLOEG C A,et al.Molecular characterization and cluster analysis of field isolates of avian infectious laryngotracheitis virus from Argentina[J].Frontiers in Veterinary Science,2017,4:212-219.
[4] SCHADLER J,SIGRIST B,MEIER S M,et al.Virus-like particles in a new vaccination approach against infectious laryngotracheitis[J].The Journal of General Virology,2019,100(6):1013-1026.
[5] ZHAO Y,KONG C,WANG Y.Multiple comparison analysis of two new genomic sequences of ILTV strains from China with other strains from different geographic regions[J/OL].PLoS One,2015,10(7):e0132747[2015-07-17].https://doi:10.1371/journal.pone.0132747.
[6] YAN Z,LI S,XIE Q.et al.Characterization of field strains of infectious laryngotracheitis virus in China by restriction fragment length polymorphism and sequence analysis[J].Journal of Veterinary Diagnostic Investigation,2016, 28(1):46-49.
[7] 刘加波,谢芝勋,谢志勤,等.应用聚合酶链反应扩增鸡传染性喉气管炎病毒TK基因的研究[J].中国兽医科技,2000,30(4):10-12.
LIU J B,XIE ZH X,XIE ZH Q,et al.Development and application of infectious laryngotracheitis virus by polymerase chain reaction[J].Chinese Journal of Veterinary Science and Technology,2000,30(4):10-12.
[8] HUMBEND J,GARCIA M,RIBLET S M,et al.Detection of infectious laryngotracheitis virus in formalin-fixed,paraffin-embedded tissues by nested polymerase chain reaction[J].Avian Disease,2002,46(1):64-74.
[9] YU J F,LIN Y,CAO Y,et al.Development and application of a colloidal gold test strip for the rapid detection of the infectious laryngotracheitis virus[J].Poultry Science,2020,99(5):2407-2415.
[10] WANG W J,WANG C G,ZHANG Z C,et al.Rapid detection of avian infectious laryngotracheitis virus with real-time fluorescence-based recombinase-aided amplification[J].Poultry Science,2020,99(10):4809-4813.
[11] MAHMOUDIAN A,KIRKPATRICK N C,COPPO M, et al.Development of a SYBR green quantitative polymerase chain reaction assay for rapid detection and quantification of infectious laryngotracheitis virus[J].Avian Pathology,2011,40(3):237-242.
[12] 原 霖,董 浩,倪建強,等.非洲猪瘟病毒微滴数字 PCR 检测方法的建立[J].畜牧与兽医,2019,51(7):81-84.
YUAN L,DONG H,NI J Q,et al.Development of droplet digital PCR for detection of African swine fever virus [J].Animal Husbandry &Veterinary Medicine,2019,51(7):81-84.
[13] PINHEIRO L B,COLEMAN V A,HINDSON C M,et al.Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification[J].Analytical Chemistry,2012,84(2):1003-1011.
[14] 谭建锡,禹思宇,唐连飞,等.H1亚型猪流感病毒微滴数字RT-PCR定量检测方法的建立[J].中国动物检疫,2019,36(11):77-82.
TAN J X,YU S Y,TANG L F,et al.Establishment of a droplet digital RT-PCR method for detection of H1 subtype swine influenza virus[J].China Academic Journal,2019,36(11):77-82.
[15] 谢志勤,谢芝勋,邓显文,等.鸡新城疫病毒、H9亚型禽流感病毒和禽肺炎病毒三重RT-PCR检测方法的建立[J].中国兽医杂志,2017,53(2):6-9,13.
XIE ZH Q,XIE ZH X,DENG X W,et al.Development of a rapid and sensitive test for identification of Newcastle disease,H9 subtype avian influenza virus and avian pneumovirus by triplex RT-PCR[J].Chinese Journal of Veterinary Medicine,2017,53(2):6-9,13.
[16] 郭宏伟,赵绪永,李华玮,等.数字PCR技术在动物疫病诊断中的应用进展[J].动物医学进展,2021,42(2):102-106.
GUO H W,ZHAO X Y,LI H W,et al.Progress on application of digital PCR in animal diagnosis[J].Progress in Veterinary Medicine,2021,42(2):102-106.
[17] 刘 洋,李 翔,原 霖,等.鸭坦布苏病毒微滴式数字RT-PCR定量检测方法的建立与初步应用[J].中国家禽,2021,43(8):25-29.
LIU Y,LI X,YUAN L,et al.Development of droplet digital RT-PCR for the detection of duck tambusu virus[J].China Poultry,2021,43(8):25-29.
[18] 石 磊,温 雯,陈 洵,等.猪链球菌微滴数字PCR定量检测方法的建立[J].现代食品科技,2019,35(1):233-238.
SHI L,WEN W,CHEN X,et al.Development of droplet digital PCR for the detection of streptococcus suis[J].Modern Food Science and Technology, 2019,35(1):233-238.
Establishment of Droplet Digital PCR Quantitative Detection Method for Detection of Infectious Laryngotracheitis Virus
Abstract The aim of present study is to develop and evaluate a droplet digital PCR (ddPCR) for detection of infectious laryngotracheitis virus(ILTV). Specific oligonucleotide primers and probe were designed and synthesized to recognize the genomic sequences of the thymidine kinase (TK) gene of ILTV based on published reference sequences of ILTV. After the reaction conditions were optimized ,the ddPCR was used to detect ILTV with the selected primers and probe. The specificity,sensitivity and reproducibility of ddPCR were subsequently evaluated. The results showed that the optimal concentrations of primers and probe were 20 μmol/μL and 10 μmol/μL,respectively. The annealing temperature was 56 ℃.Only ILTV strains were dectected with the established ddPCR,but other avian pathogens in the specificity tests were not detect . The minimum limit for quantitative detection of pMD18-ILTV recombinant plasmid DNA was 4.6 copies/μL. Three independently repeated experiments showed that the coefficients of variation were all less than 5% for detection of the three serially diluted pMD18-ILTV recombinant plasmid. Eighty three samplessuch as throat swabs,lungs and spleens collected from sick chickens were examined. Ten samples were tested positive for ILTV by ddPCR and the positive detection rate was 12.05%. Nine samples were tested positive for ILTV by fluorescent quantitative PCR and the positive detection rate was 10.84%. The sensitivity of ddPCR for the tested samples was slightly higher compared with that of the fluorescent quantitative PCR. The ddPCR described in this study was highly specific,sensitive and reproducible for detection of ILTV. The established ddPCR in our lab may provide an alternative means for absolute quantitative detection of ILTV.
Key words Infectious laryngotracheitis virus (ILTV); Droplet digital PCR (ddPCR); Quantitative detection
