间作作物种间相互作用对土壤细菌群落的影响
2024-04-11姜琴芳伏云珍李倩马琨
姜琴芳 伏云珍 李倩 马琨

摘 要 为揭示作物种植模式对土壤细菌群落组成及功能的影响机制,利用田间定位试验,基于宏基因测序方法,开展连续单作马铃薯(P)、单作玉米(M)、间作马铃薯(IP)、间作玉米(IM)根际土壤细菌群落组成和功能差异研究,分析土壤细菌群落结构、功能与土壤理化性状、间作作物产量间的相互关系。结果表明:与对应单作处理相比,玉米、马铃薯间作整体上具有产量优势。土壤变形菌门、放线菌门和浮霉菌门为不同处理下细菌群落的优势菌群;属分类水平上链霉菌属、慢生根瘤菌属、鞘脂单胞菌属、伍氏束缚菌属、伯克氏菌属、藤黄色杆菌属为优势菌属。马铃薯单作及间作处理下根际土壤鞘脂单胞菌属相对丰度均极显著高于玉米处理 (P<0.01)。通过KEGG数据库不同功能层的功能预测表明,不同处理得到455个三级功能类别和9 636个四级类别,其中参与C、N循环的通路数最多。相关性分析表明,土壤含水量(SOW)、土壤呼吸强度(RI)和速效磷(AP)对根际土壤细菌群落组成及功能代谢具有积极影响;SOW、RI和AP与功能类别中K01990和K06147均有显著或极显著相关性。连续6 a马铃薯、玉米间作及单作下作物根际土壤细菌群落组成和功能的变化是由作物种间关系变化驱动土壤养分、土壤微生物功能代谢差异影响的。
关键词 马铃薯;玉米;间作;土壤细菌;群落与功能
宁夏南部山区马铃薯种植面积占全区总种植面积的95%以上,具有稳定的经济效益[1]。近年来,重茬种植导致宁夏南部山区马铃薯产量下降的同时也对土壤质量产生了不利影响。间(套)作作为传统农业种植方式一方面能够利用适宜种间相互作用提高作物产量;另一方面能通过作物根系分泌物来改善根际微生物群落结构,促进土壤微生物代谢,使土壤质量趋于健康[2]。细菌作为土壤中最丰富的微生物类群[3],能够参与土壤碳氮循环,促进农田生态系统的可持续性。目前,有关间作系统下土壤细菌群落及功能变化已有研究[4-8]。郑亚强等[4]发现玉米、马铃薯间作下,间作玉米的土壤放线菌数量显著高于单作,间作种植能够增加土壤微生物群落多样性。玉米、豌豆间作能通过提高土壤氮素和水分利用效率,促进根际土壤微生物繁衍来影响土壤中细菌多样性[5]。Deng等[6]研究托雷亚(Torreya)常绿针叶林间作时,发现土壤pH是影响土壤细菌群落和功能的关键因素。姜小凤等[7]研究当归种植模式对土壤细菌群落和功能的影响时发现,土壤呼吸强度和pH对细菌门水平上优势菌群具有积极效应。也有研究报道认为,土壤有机质含量是影响玉米根际土壤微生物代谢功能的重要原因[8]。可见,土壤细菌群落和功能受土壤性质、作物种类以及种植方式等多种因素影响。
根际土壤是植物根部微生物群落的中心,是植物丰富养分的供应源[9],在调节有机物分解和介导养分循环等方面发挥着核心作用[10]。合理间作能通过根际交互作用使根系的分泌功能增强,优化土壤微生物群落结构[11]。已有研究证实,作物间作不仅能增加土壤地上生物多样性和群落组成,还能对地下根际土壤微生物多样性和组成起到调节作用[12]。目前大量研究者主要针对作物间作种植对土壤细菌的群落组成和结构进行研究,缺乏对间作作物对土壤细菌功能的更深入的研究。因此,针对宁夏南部山区马铃薯重茬种植引起土壤质量退化,马铃薯产量和品质下降的问题,在连续定位研究的基础上,采用宏基因组学技术,结合土壤微生物群落组成和功能代谢的差异分析,对连续马铃薯、玉米间作种植下根际土壤微生物进行研究,能进一步揭示间作作物种间相互作用调节对马铃薯重茬种植下土壤质量的影响机制,以期为马铃薯、玉米合理种植及作物布局选择提供理论依据。
1 材料与方法
1.1 试验设计与样品采集
试验地位于宁夏固原市隆德县沙塘镇和平村(106.02°E,35.59°N),海拔1 883 m,属半干旱黄土丘陵地带。土壤类型为黑垆土。试验开始于2014年4月,连续6 a定位试验。采用單因素随机区组设计,3个处理,4次重复,小区面积4 m×4 m。试验设有3个处理:单作玉米(M)、单作马铃薯(P)和间作马铃薯(IP)及间作玉米(IM),玉米品种为‘长城706,马铃薯品种为‘青薯9号,单作玉米采用覆膜种植,幅宽1.0 m,宽行行距 0.6 m,窄行行距0.4 m,株距0.35 m;单作马铃薯平种,幅宽1.0 m,行距0.5 m,株距0.4 m;马铃薯玉米间作种植方式同单作一致,宽行行距 0.6 m,窄行行距0.4 m,行比为3∶2。马铃薯、玉米均于当年4月中旬播种,10月上旬收获。播种前各小区一次性基施磷酸二铵325 kg/hm2,尿素98.44 kg/hm2,全生育期不追肥,在每年作物成熟期,对每个小区进行实收测产,收获后称取玉米和马铃薯鲜质量,换算为667 m2产量。2019年10月,在玉米和马铃薯收获期采集作物根际土壤样品。取土时,先用铁锹和长柄刀在距根部约 15 cm处向下挖20 cm,将根部连土拔起后,用力抖动除去松散的土,将附着在根上的土刷下后作为根际土。土壤样品低温带回实验室后过 1 mm筛,一份自然风干后用于土壤理化性质的测定[13],一份保存于-80 ℃冰箱用于根际土壤DNA提取和宏基因测序分析。
1.2 土地当量关系和种间竞争力的计算
利用土地当量比(LER)[14]和作物种间相互竞争力(Amp)[15]分别表征玉米和马铃薯间作的优势、劣势及相对竞争能力强弱。
LER=(Yim/Ysm)+(Yip/Ysp)
式中:LER为土地当量比,Yim和Yip分别代表间作总面积上玉米和马铃薯的产量(kg/hm2),Ysm和Ysp分别表示单作模式下玉米和马铃薯的产量。当LER>1时,表现出间作优势,当 LER<1时,为间作劣势。
Amp=Yim/(Ysm×Pm)-Yip/(Ysp×Pp)
式中:Amp表示玉米相对于马铃薯的种间竞争能力,Pp和别为间作下马铃薯和玉米所占面积比例。若Amp>0,表示玉米的种间竞争力强于马铃薯;反之,当Amp<0则说明马铃薯的竞争能力强于玉米。
1.3 宏基因测序
按照Fast DNA SPINKit for Soil (MP Biomedicals,Santa Ana,CA,USA)试剂盒说明书提取土壤微生物的全部宏基因组DNA。基于Illumina HiSeq高通量测序平台,采用全基因组鸟枪法(Whole Genome Shotgun,WGS)策略,将宏基因组总DNA随机打断为短片段,并构建合适长度的插入片段文库,对这些文库进行双端(Paired-end,PE)测序。首先微生物总DNA采用OMEGA公司的Soil DNA Kit进行抽提,采用Qubit 4荧光分光光度计检测DNA的浓度,并用 1 μg/mL的琼脂糖凝胶电泳检测DNA的质量。利用Bioruptor机器打断DNA,使其片段化后将带有突出末端的DNA利用End Repair Mix中3′-5′核酸外切酶和聚合酶的共同作用进行修复。将修复后的DNA片段和接头通过“A”“T” 在连接酶的作用下互补配对连接。利用PCR选择性地富集两端连有接头的纯化后的DNA片段,同时扩增DNA文库,并使用2100 Agilent对PCR富集片段进行质量控制。将多样品DNA文库(multiplexed DNA libraries)均一化至 10 nmol/L后等体积混合后稀释至合适的浓度后进行上机测序。
测序得到样本原始数据,经过数据拆分、质量剪切、去除宿主基因组污染等优化处理后,将双端测序数据折叠合并为双端测序数据,通过序列组装、基因预测,获得每个样本中所含的基因,将所有样本的基因整合在一起,构建非冗余基因集,优化序列获得每个基因的丰度信息,将基因与相关数据库(KEGG)等进行比对,获得基因的物种注释信息与功能注释信息。土壤DNA宏基因测序委托南京派森诺基因科技有限公司完成。
1.4 统计分析
采用Excel 2011对数据整理,微生物群落组成的方差显著性检验采用Wilxocon秩和检验(SPSS 22.0)。土壤微生物功能的丰度差异图使用Origin 8.6进行绘图。细菌群落与土壤理化性状间的冗余(RDA)分析采用Canoco 5.0,通过蒙特卡罗检验,确定土壤因子的显著性影响(P< 0.05)。
2 结果与分析
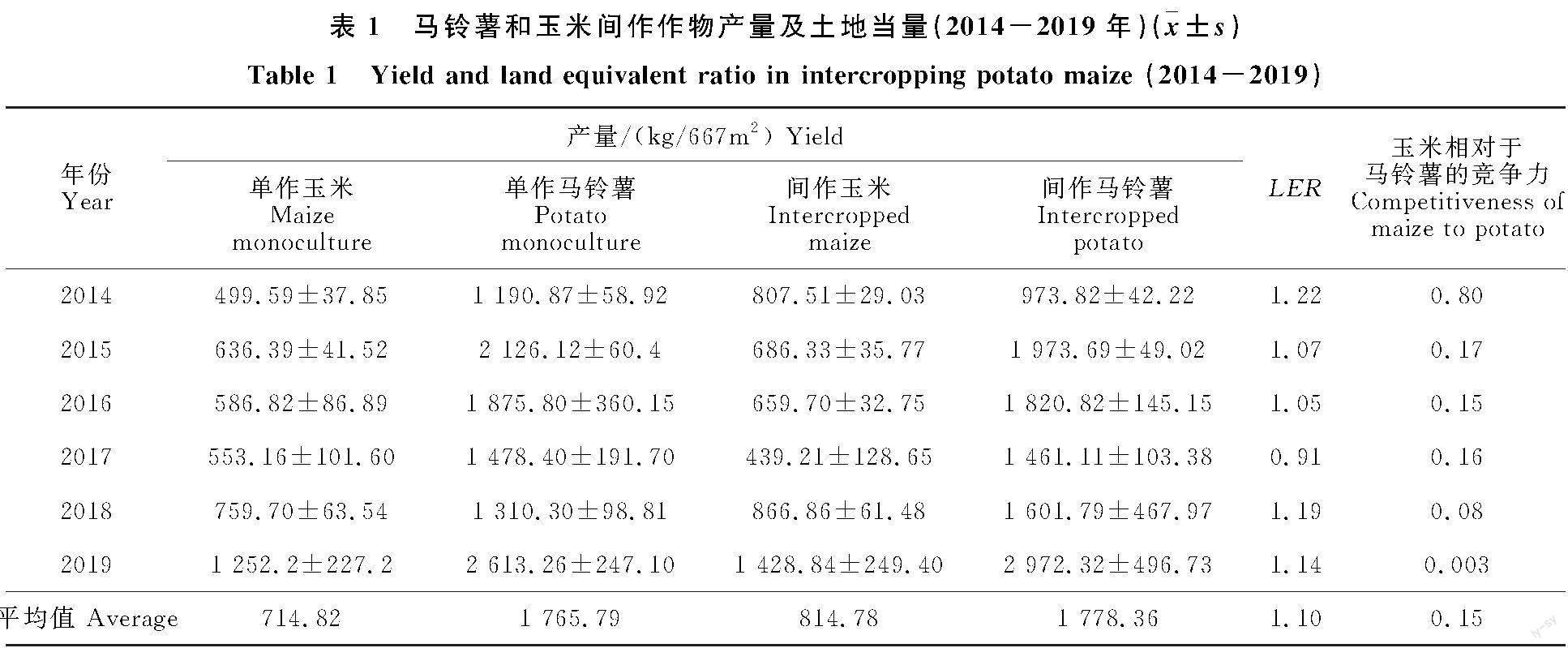
2.1 马铃薯和玉米间作作物产量以及土地当量关系
由表1可见,连续6 a马铃薯玉米间作种植下,整体上,间作种植下玉米产量均高于单作;间作种植下,马铃薯产量均低于单作。马铃薯玉米间作种植下,不同年际间的平均土地当量比大于1,说明玉米、马铃薯间作种植相对于单作具有产量优势;通过比较马铃薯、玉米在两种种植模式下年均产量,进一步说明马铃薯、玉米间作种植可以提高土地利用效率。
此外,随着种植年限的延长(2014-2019),玉米相对于马铃薯的竞争力逐步降低,连续间作6 a后,玉米与马铃薯的竞争关系减弱逐渐转变为均衡状态,但总体上,不同年份间玉米的平均相对竞争力相较于马铃薯仍略高,玉米仍然具有一定的产量优势。[FL)]
2.2 马铃薯和玉米间作对根际土壤细菌群落组成的影响
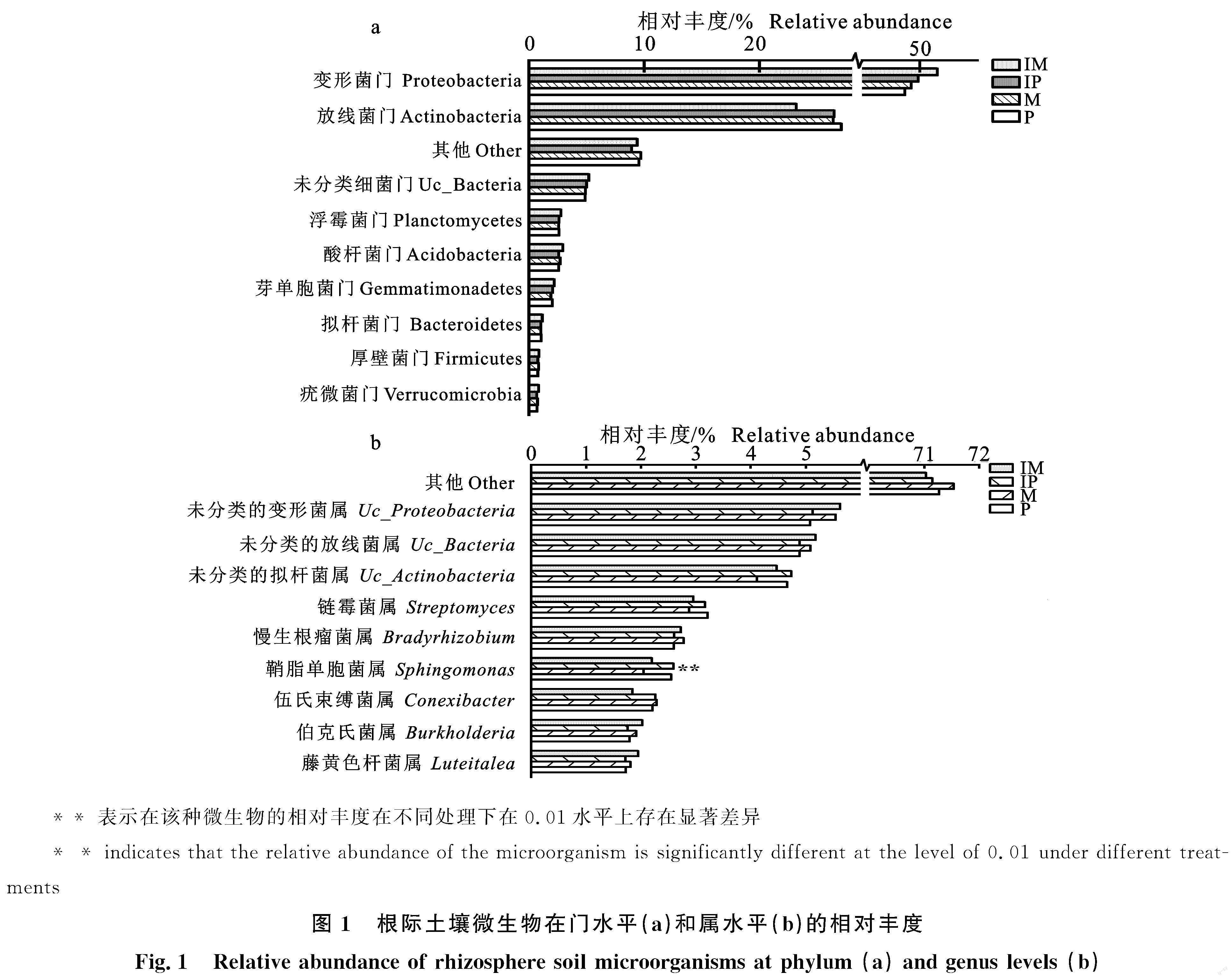
不同处理下,土壤宏基因测序共得到86门、240纲、546目、1 069科、2 641属和10 405種微生物。相对丰度较高的前10门、前10属细菌群落显示(图1),土壤变形菌门(Proteobacteria, 48.70%~51.53%)、放线菌门(Actinobacteria,23.15%~27.75%)、未分类细菌门(uc-Bacteria,4.88%~5.18%)、酸杆菌门(Acidbacteria, 2.58%~2.95%)、浮霉菌门(Planctomycetes, 2.57%~2.76%)、芽单胞菌门(Gemmatimonadetes,1.90%~2.18%)、拟杆菌门(Bacteroides,1.03%~1.15%)、厚壁菌门(Firmicutes, 0.79%~0.86%)、疣微菌门(Verrucomicrobia,0.67%~0.85%)是各处理中根际土壤细菌的优势菌门;间作下马铃薯根际土壤细菌相对丰度有高于其他处理的趋势,但不同处理间均无显著性差异。
属水平上,根际土壤未分类的变形菌属(uc_Proteobacteria,5.08%~5.62%)、未分类的放线菌属(uc_Actinobacteria,4.89%~5.18%)和未分类的拟杆菌属(uc_Bacteria,4.11%~4.73%)为优势属,其余依次是链霉菌属(Streptomyces,2.88%~3.22%)、慢生根瘤菌属(Bradyrhizobium,2.60%~2.78%)、鞘脂单胞菌属(Sphingomonas,2.05%~2.56%)、伍氏束缚菌属(Conexibacter,1.85%~2.29%)、伯克氏菌属(Burkholderiales,1.79%~2.02%)、藤黄色杆菌属(Luteitalea,1.71%~1.95%)。其中鞘脂单胞菌属(Sphingomonas)在不同处理中存在极显著差异(P<0.01),马铃薯根际土壤鞘脂单胞菌属丰度均高于玉米。可见,马铃薯、玉米种植模式的差别,能引起对应作物根际土壤细菌群落结构的变化,作物根际土壤细菌类群相对丰度更容易受到作物类型的影响,对种植方式的差异表现并不敏感。
不同栽培模式下玉米和马铃薯根际土壤微生物功能注释获得455个KEGG 代谢通路(三级分类)和9 637个功能类别(KO:四级分类)。主要的代谢通路(pathways) 为ABC转运蛋白、嘌呤代谢、群体感应和双组分系统,分别占总注释基因的 3.14%、2.72%、2.53%和2.17%。利用聚类热图将相对丰度>1%的代谢通路数进行分析,结果表明(图2):马铃薯根际土壤微生物三级代谢通路主要聚类在脂肪酸降解(fatty acid degradation)、甲烷代谢(methane metabolism)、DNA复制(DNA replication)等;玉米根际土壤微生物聚类在精氨酸生物合成(arginine biosynthesis)、柠檬酸盐循环(citrate cycle)、缬氨酸、亮氨酸和异亮氨酸生物合成(valine,leucine and isoleucine biosynthesis)等。通过对三级代谢通路比较,发现在不同栽培模式下,单作和间作马铃薯根际土壤三级代谢通路中嘌呤代谢(purine metabolism)丰度极显著高于单作和间作玉米(P= 0.001 6),而间作玉米根际土壤苏氨酸代谢丰度(glycine,serine and threonine metabolism)显著低于其他处理(P=0.021)。综上,马铃薯根际土壤微生物更多地参与了N循环相关的代谢过程,且不易受种植模式的影响。
KO水平上各组间相对丰度前50的四级功能层(图3),以PLS-DA偏最小二乘回归模型为基础,根据土壤样本分布和分组信息,对宏基因组的功能和物种数进行判别分析。间作下马铃薯和单作下马铃薯空间重叠在一起,单作马铃薯和间作下的马铃薯根际土壤样本微生物较聚集,组内差异较小,马铃薯间作及单作种植模式KO功能类别无显著差异。单作玉米、间作玉米下根际土壤微生物组内KO功能差异较大,组间差异明显(P<0.05);单作及间作玉米间的土壤微生物群落KO功能存在明显显著差别。说明作物类型是影响细菌功能类别的因素之一,但在不同种植模式下,作物类型差异会产生不同的作用效果。
2.3 土壤微生物群落结构、功能与土壤性状及产量间的相互关系
冗余分析(redundancy analysis,RDA)表明(图4-a),第一、二排序轴分别能够在累积变量83.13%、16.87%上揭示不同栽培方式下土壤理化性质对作物根际土壤细菌优势菌群的影响。大多数基于门水平上细菌相对丰度都与土壤含水量(SOW)和土壤呼吸强度(RI)存在相关性。其中,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroides)、浮霉菌门(Planctomycetes)和芽单胞菌门(Gemmatimonadetes)的相对丰度与土壤水分呈极显著正相关 (P=0.018),与呼吸强度间也存在显著正相关(P=0.003)。可见,连续玉米、马铃薯间作栽培 6 a后,间作栽培作物相互作用影响下的土壤水分和呼吸强度是影响细菌群落变化的驱动因素。
第一、二排序轴分别能够在累积变量 74.02%、25.98%上揭示不同栽培方式下土壤理化性质、作物产量性状与根际土壤细菌KO功能类别(四级代谢通路)间的相关性(图4-b)。马铃薯、玉米间作下,作物产量、作物根际土壤理化性质与K12132(真核样丝氨酸/苏氨酸蛋白激酶)、K03088(RNA聚合酶 -70因子)、K01990(ABC-2型转运系统的ATP结合蛋白)、K02004(未分类的ABC转运系统渗透蛋白)、K02035(肽/镍转运系统底物结合蛋白)、K06147(ATP结合酶)、K01992(ABC-2型转运系统渗透酶蛋白)、K02014(铁复合物外膜受体蛋白)、K03701(外切酶 ABC 亚基A)和K01953(天冬酰胺合酶)这10个功能类别存在相关性。其中,土壤含水量(SOW)对功能类别影响最为广泛,其与大多数功能类别间均极显著相关(P=0.002),说明土壤水分直接参与了微生物的功能代谢过程。其次,土壤呼吸强度与K01992功能类别的具有显著相关性(P=0.014),与速效磷(AP)呈正相关关系的是K06147(P=0.035)。可见,尽管马铃薯、玉米的种间相互作用产生了产量优势,但其对土壤细菌群落组成与功能类别的影响,是由间作栽培管理下土壤水分、土壤呼吸强度及土壤磷素差异引起得。
3 讨 论
3.1 作物种间相互作用对作物产量的影响
作物产量是反映土壤生产力的重要指标,土壤生产力受到土壤养分和作物种间相互作用的影响[16]。研究中马铃薯、玉米间作种植下的土地当量关系和种间竞争力表明,两者具有间作优势,这与刘英超等[17]研究结果一致。马铃薯玉米间作两者生态位存在差异,对养分吸收和光能利用存在互补效应;此外,间作时作物根系交互作用加强也是出现间作产量优势的重要原因[18]。本研究中,随种植年限的增加,玉米相对马铃薯存在种间竞争的主导作用,可能是由于玉米植株高大、根系发达对间作马铃薯在光、气、水等资源的捕获上存在优势[19]。随连续种植模式的延长,交互作用影响下根际土壤微生物之间相互协作作用增强,有助于形成互惠机制[20],马铃薯不再处于生态位劣势。另外,酒娟娟等[21]在研究玉米大豆间作时认为,长期间作种植能够使土壤团聚体保持稳定状态,有益于植物根系和菌丝生长,能够促进作物养分吸收与干物质积累,可能也是间作影响作物产量的重要因素[22]。
3.2 作物种间相互作用对土壤细菌群落结构的影响
土壤细菌作为评价土壤质量的关键生物指标[23],其群落组成变化可直接反映土壤质量,并与作物种类、种植方式、种间关系和土壤性质等条件密切相关[24]。研究中基于门、属水平细菌分类结果表明,间作及单作处理下土壤变形菌门、酸杆菌门和放线菌门是优势菌门,不同处理下基于门水平上优势菌群的相对丰度间无显著差异。这与枸杞间作禾本科作物根际土壤细菌优势菌群结果基本一致[25]。尽管土壤变形菌门等优势细菌门类易受土壤环境或土壤养分(有机质、水分和pH)等因素影响[26],但长期处于相同生长环境中的土壤微生物类群具有相似性,不易受种植模式差异影响[27-28],这可能是不同处理间无显著差异的缘故。
试验中,在属分类水平上除未分类的变形菌属、放线菌属和拟杆菌属外,土壤链霉菌属、慢生根瘤菌属、伍氏束缚菌属、伯克氏菌属、藤黄色桿菌属为优势属,但相对丰度间无显著差异,这与韦持章等[29]利用平板培养计数法对根际土壤微生物多样性的分析结果一致。马铃薯、玉米单作及间作下,马铃薯根际土壤鞘脂单胞菌属的相对丰度均显著高于玉米处理。与马铃薯和玉米根系分泌物差异有关,有研究发现,马铃薯茎基部和根系中检测出的内生菌中鞘脂单胞菌属和嗜麦芽窄食单胞菌[30];在马铃薯生长过程中由茎和根部不断分泌并释放鞘脂单胞菌到土壤,而鞘氨醇单胞菌属的菌株与固氮和脱氮有关,可以维持土壤的氮平衡[31],也能够与植物病原体产生拮抗作用促进植物生长。与马铃薯不同的是,玉米根部内生菌主要分泌肠杆菌属和芽孢杆菌属,参与植株生长过程中糖代谢和能量代谢[32]。可见,导致两者根际微生物结构差异的主要原因是作物根部内生菌的不同,而作物内生菌对根际土壤的影响强于作物种间相互关系。
3.3 作物种间相互作用对土壤微生物功能代谢的影响
有研究认为,农田生态系统中地上作物多样性以及土壤理化性质、作物种间相互作用关系都有可能是驱动地下微生物代谢功能多样性的重要因素[33]。本研究将细菌的变化情况和生物功能相联系,在代谢通路和功能类别水平上微生物预测结果表明:在间作作物根际土壤中,与ABC 转运蛋白、嘌呤代谢和群体感应有关的基因,如 K12132、K03088、K01990 和 K02004占优势。研究证实,ABC转运蛋白主要参与根际与含铁化合物有关的香豆素的分泌,有助于缓解根际土壤中铁缺乏而引起的土壤病态化。Ma等[34]也发现嘌呤代谢和群体感应与土壤中C/N具有显著相关性,两者参与多种代谢过程(蛋白质合成、DNA合成和细胞稳定等),并能够促进作物根系生化反应和氮、磷等营养物质的吸收。这与马铃薯、玉米间作种植下,作物根系有机基质和碳源物质的增加,以及种植前人为输入碳、氮、磷养分有关[35]。试验中,马铃薯根际土壤功能基因在四级代谢水平上表现出在不同模式下聚类在一起,而单作玉米与间作玉米下根际土壤功能基因在四级代谢水平上产生差异。这与冯晓敏等[36]在研究燕麦与大豆、花生间作时发现,与单作燕麦相比,间作燕麦细菌代谢功能较为丰富的结果相似。张开虹等[37]研究烤烟与甘薯、丹参和大豆间作土壤细菌的多样性及其功能的变化时发现与间作因素相比,烤烟的生育期是影响根际群落结构及功能的主要因素,在烤烟不同生育期根系分泌物不同,导致行使不同代谢功能的基因存在差异。说明根际土壤微生物代谢功能会受到作物种类的影响,不易受种植模式以及作物种间相互关系的影响。
3.4 微生物群落和功能代谢与土壤性质间的关系
本试验发现,土壤理化性质对土壤细菌群落组成有显著影响,其中土壤水分、呼吸强度、有机质和土壤pH等因素是影响土壤细菌群落组成的驱动因素。王悦等[38]研究不同种植模式下丹参根际土壤微生物群落结构证实,土壤性质对土壤细菌群落的影响与作物种间相互作用引起的土壤“根际效应”有关;研究发现土壤水分胁迫会影响土壤微生物的分类和功能特性[39],与本研究中土壤水分对ATP结合蛋白(K01990)和ATP结合酶(K06147)具有极显著负相关的结果一致。根据Viruel等[40]的研究可知,农田生态系统通过精耕细作和人为外源水分和养分的输入对土壤微生物进行的生物化学反应具有催化作用,加速了微生物的代谢过程,进而导致与代谢有关的功能基因发生改变。另外,Liu等[41]通过C13标记法,揭示了土壤有机质通过对土壤呼吸的影响,间接对土壤细菌群落结构产生影响。而土壤磷浓度对土壤微生物结构和功能的影响是通过比较低磷和高磷土壤微生物差异而知,土壤磷浓度过低会直接影响具有磷矿化的特定功能细菌生长,导致与磷有关代谢受阻[42]。目前关于环境因子对微生物代谢通路影响的研究还不足,这将会是未来研究的一个方向。
4 结 论
马铃薯、玉米间作种植具有产量优势,能够提高土地利用效率;不同种植年限下,作物种间相互作用关系随种植时间延长其相互竞争作用趋弱,并相对竞争力趋于平衡;间作作物根际土壤有益微生物较对应单作作物根际较为富集;另外,间作种植增加能够参与C、N循环的通路数,对土壤细菌功能代谢具有正向作用。土壤水分、呼吸强度和土壤磷浓度差异是影响细菌群落结构和功能类别的驱动因素。
参考文献 Reference:
[1] 牛秀群,李金花,张俊莲,等.甘肃省干旱灌区连作马铃薯根际土壤中镰刀菌的变化[J].草业学报,2011,20(4):236-243.
NIU X Q,LI J H,ZHANG J L,et al.Changes of Fusarium in rhizosphere soil under potato continuous cropping systems in arid-irrigation area of Gansu province[J].Acta Pratacultural Sinica,2011,20(4):236-243.
[2] 汪春明,马 琨,代晓华,等.间作栽培对连作马铃薯根际土壤微生物区系的影响[J].生态与农村环境学报,2013, 29(6):711-716.
WANG CH M,MA K,DAI X H,et al.Effect of intercropping on soil microflora in rhizosphere soil of potato under continuous cropping [J].Journal of Ecology and Rural Environment,2013,29(6):711-716.
[3] GOVAERTS B,MEZZALAMA M,UNNO Y,et al.Influence of tillage,residue management,and crop rotation on soil microbial biomass and catabolic diversity[J].Applied Soil Ecology,2007,37(1/2):18-30.
[4] 鄭亚强,陈 斌,宋培勇,等.马铃薯与玉米间作体系根际土壤放线菌多样性及拮抗菌株的筛选[J].西北农业学报,2016,25(6):912-920.
ZHEN Y Q,CHEN B,SONG P Y,et al.Diversity of actinomycetes in rhizosphere soil of potato intercropping maize system and antagonistic activity against plant pathogenic fungi [J].Acta Agriculturae Boreali-occidentalis Sinica,2016,25(6):912-920.
[5] 张虎天,尚虎山.菌肥拌种和种植模式对豌豆/玉米根际微生物群落的影响[J].水土保持通报,2015,35(6):168-171.
ZHANG H T,SHANG H SH.Effects of microbial fertilizer seed dressing and cropping patterns on rhizosphericmicroorganisms of pea/maize[J].Bulletin of Soil and Water Conservation,2015,35(6):168-171.
[6] DENG P,FAN W,WANG H,et al.Chinese Torreya agroforestry alters the rhizosphere soil bacterial communities and potential functions[J].Applied Soil Ecology,2022,177:104504.
[7] 姜小凤,郭凤霞,陈 垣,等.种植模式对当归根际细菌群落多样性及代谢通路的影响[J].应用生态学报,2021, 32(12):4254-4262.
JIANG X F,GUO F X,CHENG Y,et al.Effect of cropping patterns onbacterial community diversity and metabolic function in rhizosphere soil of Angelica sinensis[J].Chinese Journal of Applied Ecology,2021,32(12):4254-4262.
[8] 时 鹏,高 强,王淑平,等.玉米连作及其施肥对土壤微生物群落功能多样性的影响[J].生态学报,2010,30(22):6173-6182.
SHI P,GAO Q,WANG SH P,et al.Effects of continuous cropping of corn and fertilization on soil microbial community functional diversity[J].Acta Ecologica Sinica,2010,30(22):6173-6182.
[9] CALLAWAY R M.The detection of neighbors by plants[J].Trends in Ecology & Evolution,2002,17(3):104-105.
[10] LI Q,CHEN J,WU L,et al.Belowground interactions impact the soil bacterial community,soil fertility,and crop yield in maize/peanut intercropping systems[J].International Journal of Molecular Sciences,2018,19(2):622.
[11] 章家恩,高爱霞,徐华勤,等.玉米‖花生间作对土壤微生物和土壤养分状况的影响[J].应用生态学报,2009, 20(7):1597-1602.
ZHANG J E,GAO A X,XU H Q,et al.Effects of maize/peanut intercropping on rhizospheresoil microbes and nutrient contents[J].Chinese Journal of Applied Ecology 2009,20(7):1597-1602.
[12] HAO W,REN L,RAN W,et al.Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f.sp.niveum[J].Plant and Soil,2010, 336(1):485-497.
[13] 鮑士旦.土壤农化分析[M].3版.北京:中国农业出版社2000:25-114.
BAO SH D.Soil Agrochemical Analysis[M].3 edition.Beijing:China Agriculture Press,2000:25-114.
[14] YANG F,LIAO D,WU X,et al.Effect of aboveground and belowground interactions on the intercrop yields in maize-soybean relay intercropping systems[J].Field Crops Research,2017,203:16-23.
[15] LI L,SUN J,ZHANG F,et al.Wheat/maize or wheat/soybean strip intercropping:I.Yield advantage and interspecific interactions on nutrients[J].Field Crops Research,2001,71(2):123-137.
[16] POLY F,RANJARD L,NAZARET S,et al.Comparison of nifH gene pools in soils and soil microenvironments with contrasting properties[J].Applied and Environmental Microbiology,2001,67(5):2255-2262.
[17] 刘英超,汤 利,郑 毅,等.间作玉米马铃薯土壤水氮协同吸收特征研究[J].中国土壤与肥料,2020(4):150-156.
LIU Y CH,TANG L,ZHENG Y,et al.Characteristics of interactive absorption of soil water and N in maize and potato intercropping system [J].Soil and Fertilizer Sciences in China,2020(4):150-156.
[18] WU K,FULLEN M A,AN T,et al.Above-and below-ground interspecific interaction in intercropped maize and potato:A field study using the ‘targettechnique[J].Field Crops Research,2012,139:63-70.
[19] 周 鋒,安曈昕,吴开贤,等.间作群体中玉米对马铃薯生长及竞争力的影响[J].干旱地区农业研究,2015,33(6):105-112.
ZHOU F,AN T X,WU K X,et al.Interspecific competition between maize and potato under intercropping system[J].Agricultural Research in the Arid Areas,2015, 33(6):105-112.
[20] 安曈昕,杨圆满,周 锋,等.间作对玉米马铃薯根系生长与分布的影响[J].云南农业大学学报(自然科学),2018, 33(2):363-370.
AN T X,YANG Y M,ZHOU F,et al.Effect of maize and potato intercropping on their root growth and distribution [J].Journal of Yunnan Agricultural University (Natural Science),2018,33(2):363-370.
[21] 酒娟娟,李永梅,王梦雪,等.玉米大豆间作对坡耕地红壤团聚体分布及稳定性的影响[J].江苏农业科学,2021, 49(22):219-228.
JIU JJ,LI Y M,WANG M X,et al.Impacts of maize- soybean intercropping on distribution and stability of red soil aggregates in slope farmland[J].Jiangsu Agricultural Sciences,2021,49(22):219-228.
[22] JASTROW J D,MILLER R M,LUSSENHOP J.Contributions of interacting biological mechanisms to soil aggregate stabilization in restored prairie[J].Soil Biology and Biochemistry,1998,30(7):905-916.
[23] DORAN J W,ZEISS M R.Soil health and sustainability:managing the biotic component of soil quality[J].Applied Soil Ecology,2000,15(1):3-11.
[24] 林伟伟,李 娜,陈丽珊,等.玉米与大豆种间互作对根际细菌群落结构及多样性的影响[J].中国生态农业学报(中英文),2022,30(1):26-37.
LIN W W,LI N,CHEN L SH,et al.Effects of interspecific maize and soybean interactions on the community structure and diversity of rhizospheric bacteria [J].Chinese Journal of Eco-Agriculture,2022,30(1):26-37.
[25] ZHU L,HE J,TIAN Y,et al.Intercropping wolfberry with gramineae plants improves productivity and soil quality[J].Scientia Horticulturae,2022,292:110632.
[26] CUARTERO J,PASCUAL J A,VIVO J M,et al.A first-year melon/cowpea intercropping system improves soil nutrients and changes the soil microbial community[J].Agriculture,Ecosystems & Environment,2022,328:107856.
[27] 万 盼,胡艳波,张弓乔,等.甘肃小陇山油松与柴胡栽培土壤细菌群落特征[J].生态学报,2018,38(17):6016-6024.
WAN P,HU Y B,ZHANG G Q,et al.Soil bacterial communities under Pinus tabulaeformis Carr.and Bupleurum chinese plantations at Xiaolongshan Mountain of Gansu province[J].Acta Ecologica Sinica,2018,38(17):6016-6024.
[28] WARD N L,CHALLACOMBE J F,JANSSEN P H, et al.Three genomes from the phylum acidobacteria provide insight into the lifestyles of these microorganisms in soils[J].Applied and Environmental Microbiology,2009, 75(7): 2046-2056.
[29] 韋持章,农玉琴,陈远权,等.茶树/大豆间作对根际土壤微生物群落及酶活性的影响[J].西北农业学报,2018, 27(4):537-544.
WEI CH ZH,NONG Y Q,CHEN Y Q,et al.Effects of tea and soybean intercropping on soil microbial community and enzyme activity[J].Acta Agriculturae Boreali-occidentalis Sinica,2018,27(4):537-544.
[30] GARBEVA P,VAN OVERBEEK L S,VAN VUURDE J W L,et al.Analysis of endophytic bacterial communities of potato by plating and denaturing gradient gel electrophoresis (DGGE) of 16S rDNA-based PCR fragments[J].Microbial Ecology,2001,41(4):369-383.
[31] 胡 杰,何晓红,李大平,等.鞘氨醇单胞菌的研究进展[J].应用与环境生物学报,2007(3):431-437.
HU J,HE X H,LI D P,et al.Progress in research of Sphingomonas[J].Chinese Journal of Applied and Environmental Biology,2007 (3):431-437.
[32] WANG CH L,FANG ZH J,XU Y R,et al.Analysis of the effect of it on endophytic bacterial diversity in maize roots based on high-throughput sequencing technology[J].Crops,2018,34(1):160-165.
[33] ZHOU X,GAO D,LIU J,et al.Changes in rhizosphere soil microbial communities in a continuously monocrop Ped cucumber (Cucumis sativus L.) system[J].European Journal of Soil Biology,2014,60:1-8.
[34] MA C,ZENG W,MENG Q,et al.Identification of partial denitrification granulation enhanced by low C/N ratio in the aspect of metabolomics and quorum sensing[J].Chemosphere,2022,286:131895.
[35] 彭钰洁,程 楠,李佳佳,等.氮肥减施对玉米幼苗根系分泌物影响的根际代谢组学分析[J].中国生态农业学报,2018,26(6):807-814.
PENG Y J,CHENG N,LI J J,et al.Effects of nitrogen fertilizer reduction on root exudates of maize seedlings analysis by rhizosphere metabolomics[J].Chinese Journal of Eco-Agriculture,2018,26(6):807-814.
[36] 冯晓敏,杨 永,任长忠,等.燕麦/大豆和燕麦/花生间作对根际土壤固氮细菌多样性与群落结构的影响[J].中国农业大学学报,2016,21(1):22-32.
FENG X M,YANG Y,REN CH ZH,et al.Effects of oat-soybean and oat-groundnut intercropping on the diversity and community composition of soil nitrogen-fixing bacterial in rhizosphere soil [J].Journal of China Agricultural University,2016,21(1):22-32.
[37] 张开虹,桑维钧,何世芳,等.不同作物间作对烤烟根际土壤细菌群落组成及功能的影响[J].贵州农业科学,2020,48(4):80-86
ZHANG K H,SANG W J,HE SH F,et al.Effects of intercropping with different crops on bacterial community composition and function in rhizosphere soil of tobacco [J].Guizhou Agricultural Sciences,2020,48(4):80-86.
[38] 王 悅,杨贝贝,王 浩,等.不同种植模式下丹参根际土壤微生物群落结构变化[J].生态学报,2019,39(13):4832-4843.
WANG Y,YANG B B,WANG H,et al.Variation in microbial community structure in the rhizosphere soil of Salvia miltiorrhiza Bunge under threecropping modes[J].ActaEcologica Sinica,2019,39(13):4832-4843.
[39] ALI A,GHANI M I,ELRYS A S,et al.Different cropping systems regulate the metabolic capabilities and potential ecological functions altered by soil microbiome structure in the plastic shed mono-cropped cucumber rhizosphere[J].Agriculture,Ecosystems & Environment,2021,318:107486.
[40] VIRUEL E,FONTANA C A,PUGLISI E,et al.Land-use change affects the diversity and functionality of soil bacterial communities in semi-arid Chaco region,Argentina[J].Applied Soil Ecology,2022,172:104362.
[41] LIU L,ESTIARTE M,BENGTSON P,et al.Drought legacies on soil respiration and microbial community in a Mediterranean forest soil under different soil moisture and carbon inputs[J].Geoderma,2022,405:115425.
[42] SAMADDAR S,CHATTERJEE P,TRUU J,et al.Long-term phosphorus limitation changes the bacterial community structure and functioning in paddysoils[J].Applied Soil Ecology,2019,134:111-115.
Effects of Intercropping Crop Interactions on Soil Bacterial Community Structure and Function
Abstract This study aimed to investigate the effects of the differential mechanisms of crop planting patterns on the soil bacterial community composition and function.Long-term fixed experiment treatments of monoculture potato (P),monoculture maize (M),and intercropped potato (IP) with maize (IM) were selected,and the rhizosphere soil bacterial communities structure and function differences were studied using metagenome sequencing.The study also examined the relationship among soil bacterial community structure,function ,soil physicochemical properties and the crop yields.The results showed that intercropping maize with potato had a significant advantage in crop yields compared with the monoculture.Proteobacteria,Actinobacteria and Planctomycetes were the dominant phylum under the different treatments,while the Streptomyces,Bradyrhizobium,Sphingomonas,Conexibacter,Burkholderiales and Koserellawere the dominant genus.The relative abundance of Sphingolipidium in patato rhizosphere was significantly higher than maize under the reatment of monculture and intercropping (P<0.01).The functional prediction between different category levels using KEGG database showed that 455 third-level functional level and 9 636 fourth-level functional category were classified,and the metabolic pathways involved in the carbon and nitrogen cycles was the most.Correlation analysis revealed that soil moisture content (SOW),soil respiration intensity (RI) and available phosphorus (AP) positively influenced bacterial community composition and functional metabolism in rhizosphere soil.Positive or negative correlationship with significant or extremely significant difference were observed between the metabolic patharys of K01990 and K06147 in the functional level category and SOW,RI,and AP.This study concluded that bacterial community composition and function in the rhizosphere of intercropped potatoe and maize,and nonoculture maize and potato were drived by differences in soil nutrient and soil microbial function.
Key words Potato;Maize;Intercropping;Soil bacteria;Community and function
