稻米中蛋白体的分离纯化及表征
2024-04-10许子鑫郭玉宝刘昕煜王馨雨
许子鑫,郭玉宝,魏 秦,刘昕煜,王馨雨
(安徽工程大学生物与食品工程学院,芜湖 241000)
我国是世界上稻谷产量较高的国家之一,年产量高达2.12 亿t[1]。2021 年全球约产出5.19 亿t大米[2],预计到2030 年大米产量还会增加40%[3]。淀粉、蛋白质和脂质是稻米的主要化学组分,总质量分数为85% ~90%[4]。精白米中蛋白质质量分数为8%左右,而糙米中蛋白质质量分数为13%左右[5]。蛋白质是稻米中的第二大组分,其对稻米食用品质的形成及储藏期间的品质变化具有明显影响,蛋白质含量对稻米的蒸煮品质与感官特性的影响也尤为重要。
稻米中大部分的储藏蛋白,存在于亚细胞结构蛋白体中,蛋白体直径通常在0.5 ~4.0 μm之间[6]。蛋白体以2 种形式存在,即PB -Ⅰ和PB -Ⅱ[7],除储藏蛋白外还包括少量植酸、植物凝集素、一些酶及无机盐离子如K2+、Mg2+等[6]。PB - I 具有环状结构,呈球形,大小在0.5 ~2.0 μm 之间,主要组成是醇溶蛋白;PB -Ⅱ具有晶体结构,呈圆形、椭圆形或不规则形状,大小在2.5 ~4.0 μm之间,主要组成是谷蛋白和球蛋白。稻米中的蛋白体是由质体、内质网及液泡发育而来,蛋白体的形成和发育受储藏蛋白质组分、植物凝集素及一些细胞器的调控[6]。成熟水稻籽粒中的蛋白体主要存在于3 个区域:胚乳糊粉层、亚糊粉层和胚[6]。胚乳糊粉层的蛋白体和胚中的一些蛋白体含有球状晶体,而亚糊粉层中的蛋白体则不含球状晶体[6]。
蛋白体的分离方法主要有高压均质法[8]和蔗糖密度梯度离心法[9]。高压均质机法是将浸泡过的米粉微细化至低于5 μm,再通过高速离心分离蛋白,此方法要求较高的均质压力(200 ~250 kg/cm2)[8],淀粉颗粒容易破裂,不利于后续蛋白体的纯化。蔗糖密度梯度离心法分离蛋白体,原料是未成熟稻米颖果,是未经烘干的湿基形式,蛋白体与淀粉之间易出现结合黏连,且分离过程会消耗大量蔗糖,分离效率较低,通常在作物生理学中用于研究不同耕作条件下蛋白质对稻米食用品质和营养价值的影响[8-10],但在食品加工领域从成熟的颖果即稻米中分离蛋白体还鲜有报道。
鉴于目前蛋白体分离效率较低且步骤繁琐,研究以富含蛋白体的糙米为原料,建立利用稀碱分离蛋白体的方法,然后采用适当的方法对分离的蛋白体进行纯化,最后对获得的蛋白体形态和结构进行鉴定和表征,为研究蛋白体影响稻米品质的形成提供参考。
1 材料与方法
1.1 材料与试剂
糙米:镇稻88,市售。氢氧化钠、氯化钙均为分析纯。
1.2 仪器与设备
LW200CA 光学显微镜,DM2500LED 荧光显微镜,S -4800SEM 冷场发射扫描电子显微镜,MS -2000 激光粒度分析仪,BIO - RAD 通用电泳仪,D8 FOCUSX-射线衍射仪,IRPretige -21 傅里叶变换红外光谱仪,Thermo Fisher DXRxi 显微拉曼成像光谱仪,JW-3021H 高速离心机,JA -2603N 电子天平,JK-100DB数控超声波清洗器,SHZ-D(Ⅲ)循环水式多用真空泵,LD -T400 高速万能粉碎机,MPLK -707 数显集热式磁力搅拌器,125 μm标准检验筛120目,LGJ-12 真空冷冻干燥机,0.1、5.0 μm尼龙微孔滤膜。
1.3 实验方法
1.3.1 蛋白体分离和纯化方法
蛋白体分离方法:将糙米粉碎,过120目(125 μm)筛,收集筛下物;筛上物继续粉碎,直至全部通过120目筛;将筛下物混合均匀装入自封口袋,存于4 ℃备用。称取5 g 糙米粉于100 mL 三角烧瓶中,按液料比6∶1(mL/g)加入10 mmol/L的NaOH溶液30 mL,用玻璃棒搅拌均匀,于40 ℃下恒温磁力搅拌120 min。然后,在功率100 W、25 ℃下超声30 min。将所得混合物混匀,取少量用于测定蛋白体的体积分数;向其余混合物中加入40 mL 蒸馏水并搅拌均匀,之后在12 000 r/min 下离心20 min,分别收集上清液、沉淀表层黄软物质和下层白色沉淀。上清液中主要是蛋白体,体积分数73.40%,其他为淀粉等杂质;黄软物中蛋白体较少,体积分数仅5.81%,其他主要是淀粉;下层白色沉淀中只有极少夹带蛋白体残留,体积分数仅0.12%。
蛋白体体积分数的测定:取少量超声处理后的含蛋白体混合物,采用激光粒度分析仪测定粒度分布,获得蛋白体的体积分数。测定条件:分散剂为水,仪器转速为1 800 r/min,超声分散,加样使遮光度为10% ~20%之间,每个样品平行测定5次,取平均值。
蛋白体纯化方法:将收集的上清液和黄软物质分别进行处理。上清液(或黄软物质稀释后)先用5 μm尼龙滤膜抽滤,取膜下物;再用0.10 μm尼龙滤膜抽滤,将膜上物转移至离心管中,然后加入30 mL 4.0 mol/L 的CaCl2溶液,在室温下糊化20 min[11]。之后在12 000 r/min下离心20 min,取上清液,再用0.10 μm尼龙滤膜抽滤,将膜上物转移至培养皿中,用2 层保鲜膜密封,置于-18 ℃冷冻24 h 后冻干,称质量后装入自封口袋,存于4 ℃下备用。
1.3.2 蛋白体分离条件优化
1.3.2.1 单因素实验
为了提高蛋白体的分离效率,以蛋白体的体积分数为指标,分别研究碱液浓度、液料比、搅拌时间、超声功率、超声温度和超声时间对蛋白体分离的影响。单因素实验的基本条件为:碱液浓度10 mmol/L、液料比6 mL/g、搅拌时间120 min、超声功率100 W、超声温度25 ℃和超声时间30 min。固定基本条件不变,分别考察碱液浓度(0、5、10、15、20 mmol/L)、液料比(6、8、10、12、14 mL/g)、搅拌时间(30、60、90、120、150 min)、超声功率(60、70、80、90、100 W)、超声温度(25、35、45、55、65 ℃)及超声时间(0、10、20、30、40、50 min)对蛋白体分离的影响。
1.3.2.2 响应面优化
根据单因素实验结果,选择影响较大的4 个单因素,进行三水平四因素Box - Behnken 响应面优化,以蛋白体体积分数为考察指标,进行二次多项式回归拟合及优化分析。实验设计因素及水平见表1。

表1 Box-Behnken实验设计因素水平表
1.3.3 蛋白体表征方法
1.3.3.1 普通光学显微观察
取少许冻干样品于洁净载玻片上,滴加1 滴蒸馏水,浸润后,加盖玻片。将0.1%考马斯亮蓝染液从一侧滴入,用吸水纸从另一侧吸出,使考马斯亮蓝染液充分浸渍样品,染色2 min。用蒸馏水洗去多余考马斯亮蓝染液,反复多次,直至流出水为无色,置于光学显微镜下进行观察。
1.3.3.2 荧光显微形态观察
取少许冻干样品于载玻片上,滴加1 滴蒸馏水,加盖玻片。打开荧光光源,将滤光片调节器调至蓝色荧光位置,利用普通光与荧光在40 倍物镜下进行观察。
1.3.3.3 扫描电镜形态观察
取少许冻干样品,撒在双面导电胶上,粘于样品台,喷金10 nm,在加速电压5 kV下拍照。
1.3.3.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)
采用Laemmli 电泳系统,分离胶质量分数为15%,浓缩胶质量分数为5%[12],蛋白经还原性样品缓冲液(含巯基乙醇和SDS)处理。电泳结束后,用凝胶成像系统拍照。
1.3.3.5 X-射线衍射(XRD)分析
1.3.3.6 傅里叶变换红外光谱(FTIR)分析
红外光谱分析采用溴化钾压片法[13]:将蛋白体样品与干燥的溴化钾按质量比1∶100 混合后研磨至足够细,在压片机上以10 T/cm压片,直至得到的压片为均匀无裂痕且呈半透明状。在红外光谱仪上扫描,波数500 ~4 000 cm-1,分辨率2 cm-1,扫描512次获得叠加谱,实验重复3 次,谱图用Omnic 8.0分析。
1.3.3.7 蛋白体的拉曼光谱分析
蛋白体的拉曼光谱分析参照Guo 等[13]的方法,测定条件:激光波长514.5 nm,功率20 mW,到达样品的光斑直径约1 μm。测前,激光波长在520.7 nm处以单晶硅校正。扫描时间60 s,扫描波数范围200 ~4 000 cm-1,分辨率为2 cm-1,样品扫描速度为120 cm-1/min,每1 cm-1记录数据。50 倍长焦镜头(LMP),在背散射方向收集拉曼信号,至少3 个不同的样品点被测试并记录。所获得数据采用Omnic 8.0 软件进行基线校正、平滑(Nine - point golay -savitzky procedure)。因实际获得的拉曼光谱强度不仅与物质含量有关,还受到激光器强度、拉曼探头与样品相对距离、光纤传输效率、检测器量子效率等其他因素的影响,因此以苯丙氨酸峰为基准进行归一化处理进行强度校正。
1.4 数据处理
蛋白体体积分数以平均值±标准差来表示。数据处理在SPSS 2.0 软件中进行,单因素方差分析采用邓肯多重范围检验,响应面数据处理采用Designexpert 8.0.6 软件,绘图采用OriginPro 9 软件。
2 结果与分析
2.1 蛋白体分离单因素实验
由图1 可知,随着氢氧化钠溶液浓度的增加,蛋白体体积分数先增加后略有降低;当碱液浓度为15 mmol/L时,蛋白体体积分数最大。这可能是氢氧化钠溶液浓度的增加,促进了蛋白体与淀粉颗粒之间的分离,使更多蛋白体成为悬浮状态。随着氢氧化钠溶液浓度继续增加,蛋白体体积分数有所降低,可能是蛋白体在较高浓度的碱液中会逐渐溶解成为蛋白质溶液。选择氢氧化钠溶液浓度为15 mmol/L 较为合适。
苏联的官僚主义是在斯大林时期的政治经济体制条件下形成和滋长起来的。当然不能说所有的各级领导人都变成了墨守成规的官僚主义者,但也应该看到,患有不同程度官僚主义习气的人,却是厚厚的一层。所以,戈尔巴乔夫执政以来,一再抨击官僚主义是有道理的,它确实成了阻碍机制的主要社会力量。
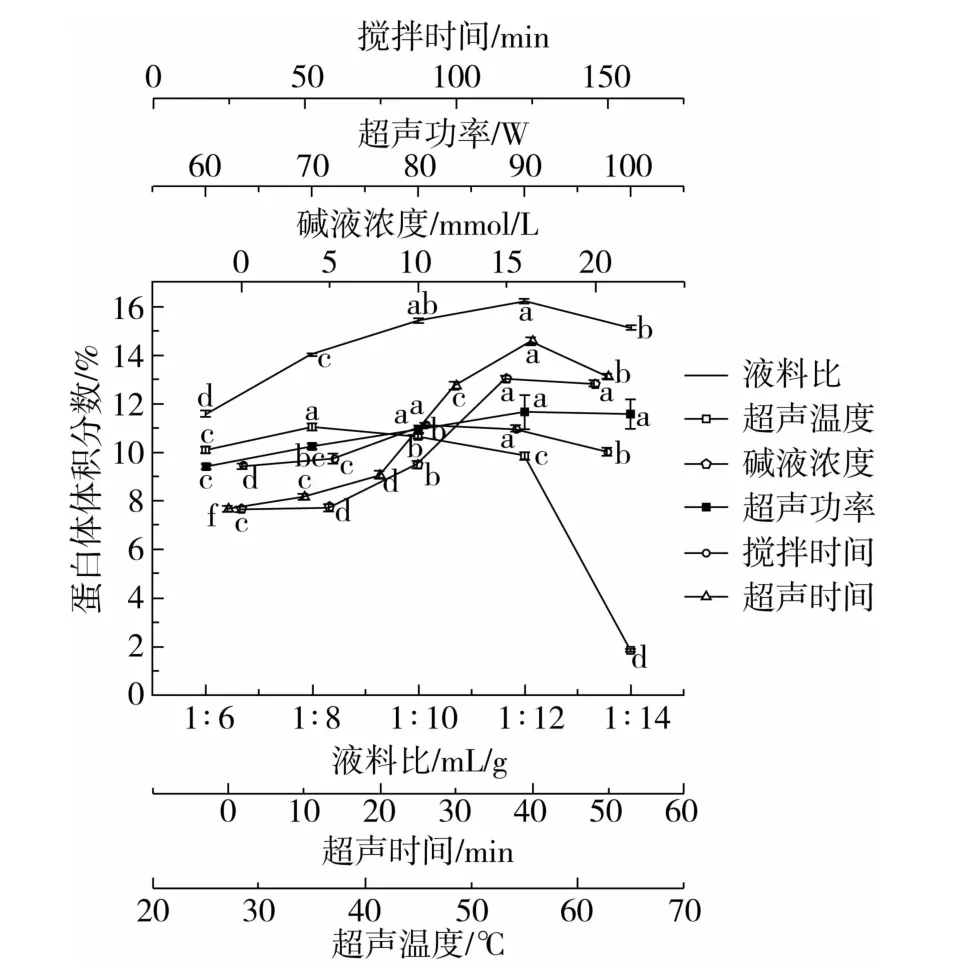
图1 碱液浓度、液料比、搅拌时间、超声功率、超声温度、超声时间对蛋白体体积分数的影响
随着液料比的增大,蛋白体体积分数呈现先增加后下降的趋势;当液料比为12 mL/g 时,蛋白体体积分数最高。这可能是因为当液料比较低时,蛋白体与淀粉分离程度较低;当液料比过大时,分离的蛋白体可能会部分发生溶解,不利于蛋白体的获取。因此选择液料比为12 mL/g较为合适。
随着搅拌时间的增加,蛋白体体积分数先缓慢增加后略有下降。当搅拌时间为90 min 时,蛋白体体积分数最高。这可能是因为,起初随着搅拌时间的增加,有利于蛋白体与淀粉颗粒之间的分离;但搅拌时间过长,蛋白体发生一定程度的溶解,体积分数有所下降,但总体变化幅度不大。因此本因素不进入响应面,选择搅拌时间为90 min。
随着超声功率的增大,蛋白体体积分数呈现逐渐增加的趋势,但超过90 W时基本稳定,90 W时对应的蛋白体体积分数最高。这可能是因为超声功率提高,有助于蛋白体与淀粉颗粒之间的分离;但超声功率过大时,又可能对蛋白体的溶解具有促进作用。因此选择超声功率为90 W较好。
随着超声温度的增加,蛋白体体积分数先缓慢增加,然后逐渐下降,最后急剧下降。当超声温度为35 ℃时,蛋白体体积分数最大。这可能是因为起初超声温度升高,促进了蛋白体与淀粉颗粒间的分离,蛋白体进入碱液的数量增多;但随着超声温度的继续升高,蛋白体的溶解性增加,溶出的蛋白体部分变成溶解状态进入溶液;温度达到65 ℃时,可能因淀粉颗粒在此温度下溶胀较快而包裹了蛋白体,不利于蛋白体与淀粉的分离。除了65 ℃下蛋白体体积分数很低外,其他温度下变化幅度不大,因此该因素不进入响应面,选择超声温度为35 ℃较佳。
随着超声时间的增加,蛋白体的体积分数呈现先缓慢增加后快速增加,最后明显下降的趋势。超声时间在0 ~40 min范围内,超声时间延长促进了蛋白体与淀粉颗粒间的分离;超过40 min后,可能超声促进了溶出蛋白体的溶解。超声时间为40 min 时,蛋白体的体积分数最大。因此超声时间40 min较好。
2.2 蛋白体分离响应面优化
2.2.1 模型的建立与显著性检验
以对蛋白体分离影响较大的因素碱液浓度(A)、液料比(B)、超声功率(C)和超声时间(D)为自变量,以蛋白体体积分数为响应值,进行响应面优化,实验安排与结果见表2。运用Design-Expert软件进行拟合,得到的回归模型方程为:

表2 Box-Behnken实验设计方案及实验结果
Y =19.88 -0.66A +0.086B +0.32C -0.24D -0.013AB-7.50 ×10-3AC +0.40AD +5.00 ×10-3BC +0.02BD-0.048CD-1.74A2-0.99B2-0.47C2-1.11D2
通过比较方程中一次项系数绝对值的大小,可以判断影响因子的主次性。本实验中对蛋白体体积分数的影响从大到小依次为碱液浓度、超声功率、超声时间和液料比,可见碱液浓度对蛋白体分离的影响最大。
由表3 响应面实验结果分析可见,F回归=9.02,P <0.000 1,表明模型极显著;模型相关系数的平方即R2为0.900 2,为0.800 4,回归方程拟合程度良好;失拟项P 值大于0.05,拟合性好,说明该方程能够较好地拟合真实的实验结果。

表3 回归模型方差分析结果
各实验因子对响应值的影响不是线性关系,其中A对Y值影响极显著,C 对Y值影响显著,A2、B2、D2对Y值的影响极显著,C2对Y值的影响显著。
2.2.2 响应面分析
响应面分析可知,所有响应面均呈凸起状,因此响应值均容易取得最大值。当碱液浓度一定时,蛋白体体积分数随着液料比、超声功率及超声时间的增大而先增大后减小;当液料比一定时,蛋白体体积分数随着超声功率及超声时间的增大而先增大后减小;当超声功率一定时,蛋白体体积分数随着超声时间的延长而先增大后减小。因此,在碱液浓度14 mmol/L、液料比12 mL/g、超声功率90 W 及超声时间40 min附近蛋白体体积分数可取得最大值。
2.2.3 最佳分离条件的确定
综合4 个主要因素的影响,并确保各影响因素在设定的优化条件范围内,利用计算机程序采用最速上升法找到使蛋白体体积分数最高的最佳条件组合为:碱液浓度14 mmol/L、液料比12 mL/g、超声功率90 W和超声时间40 min,此条件下蛋白体的体积分数预测值为20.21%。在此最佳条件下分离蛋白体,以验证条件的可靠性,实验平行进行3 次,测定实际的蛋白体体积分数为20.10%,说明所得优化条件有效且可靠。
2.3 光学显微观察
蛋白体的光学显微形态见图2。纯化前上清液中蛋白体呈微球形,且大部分呈聚集态(图2a),分散状的蛋白体数量较少,蛋白体不能被考马斯亮蓝染色,但可见被染成蓝色的絮状物,可能是分离过程中溶出的可溶性蛋白。纯化后上清液中的蛋白体微球状立体感增强,且均为分散状(图2b),彼此不聚集,也不被考马斯亮蓝染色,未见蓝染的絮状物,蛋白体较纯净,说明纯化效果较明显。纯化前黄软物中的蛋白体呈微球形,但可见片状物(图2c),纯化后黄软物中的蛋白体更洁净,片状物消失(图2d)。高压均质法分离后在光镜和扫描电镜下可见蛋白体数量较少;蔗糖密度梯度离心法分离蛋白体在光镜和扫描电镜下可见淀粉杂质较多,且蛋白体与淀粉呈黏连状态,不易分散。而研究所建立的稀碱法得到的蛋白体较纯净,杂质少,纯化后考马斯亮蓝染色未见明显蓝色。

图2 蛋白体的光学显微形态
2.4 荧光显微观察
纯化前,荧光与可见光下蛋白体的位置相对应(图3a和图3c),荧光下显示蓝色的是可见光下的无色微球体,说明蛋白体显示蓝色荧光;而在可见光下观察到的考马斯亮蓝蓝染的絮状可溶性蛋白,在荧光下却为无色,这说明蛋白体确实不能被考马斯亮蓝染色,可能因它的结构较致密。纯化后(图3b 和图3d),考马斯亮蓝着色的絮状物消失,蛋白体呈分散状,显示蓝色荧光,纯化后蛋白体更纯净。黄软物中的蛋白体,纯化前也呈分散状态且有少量片状物存在(图3e和3g),但无絮状物;纯化后片状物消失,蛋白体更洁净(图3f和图3h)。

图3 蛋白体的荧光显微形态
2.5 扫描电镜观察
纯化前上清液中蛋白体大多被连续基质所覆盖,蛋白体暴露不完全(图4a)。纯化后蛋白体呈彼此分离状态(图4b),彼此间无连续基质填充或黏连,且蛋白体形态更加饱满、立体感强,蛋白体多数较完整,有少数蛋白体上有较大孔洞或破裂,但多数蛋白体表面均有数量较多的微坑。纯化前黄软物中蛋白体大多呈分散状态且有少量杂质存在(图4c);而纯化后黄软物中蛋白体形态清晰,蛋白体间无填充物,蛋白体的个体形态与上清液中基本类似(图4d)。

图4 蛋白体的扫描电镜形态
2.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS -PAGE)
蛋白体样品的SDS -PAGE 见图5。结果显示,纯化前上清液和黄软物蛋白体的条带较多,纯化后条带减少,其中黄软物在16 ku 处的条带较模糊,是PB-Ⅰ的多肽组成亚基[12];蛋白体在22、33、57 ku处出现条带,这些条带是PB-Ⅱ的重要组分[12]。由此表明,获得的蛋白体样品中不仅包含PBⅠ,也包含PB-Ⅱ。

图5 蛋白体电泳图
2.7 傅里叶变换红外光谱(FTIR)
蛋白体红外光谱见图6。蛋白体的酰胺A 带吸收峰(氨基的反对称伸缩振动峰)在3 432 cm-1,与淀粉的羟基吸收峰位3 456 cm-1明显不同,且蛋白体纯化后此峰的强度减弱。蛋白体的C—H 伸缩振动峰出现在2 926 cm-1,与淀粉的甲基、亚甲基C—H伸缩振动峰同位,但是前者峰形明显变窄,与淀粉有明显的区别。蛋白体在1 650 cm-1附近出现酰胺Ⅰ带的N—H弯曲振动峰,淀粉在1 650 cm-1附近出现C ═O伸缩振动峰,但蛋白体的峰强度更小。另外,蛋白体在1 000 ~500 cm-1范围内918 cm-1处的指纹峰比淀粉更小。常用酰胺Ⅰ带1 600 ~1 700 cm-1的红外吸收光谱研究蛋白质的二级结构,其特征振动取决于C═ O 与N—H 的氢键性质[14]。纯化前后,蛋白体在酰胺Ⅰ带(1 650 cm-1)和酰胺Ⅱ带(1 464 cm-1,C—N的伸缩振动)的红外吸收光谱不变,但纯化后蛋白体在酰胺Ⅰ带和酰胺Ⅱ带的红外吸收强度有不同程度的减弱。在1 028 cm-1的吸收峰是C═ N共价键的吸收,纯化后蛋白体的吸收强度也减弱。

图6 蛋白体红外光谱
2.8 X-射线衍射(XRD)
蛋白体的X-射线衍射见图7。蛋白体在10.1°和19.9°处的2 个宽衍峰分别对应蛋白体的二级结构α -螺旋和β -折叠[15]。在19.9°处蛋白体和淀粉同时出现了衍射峰,且蛋白体的峰值强度明显低于淀粉,说明蛋白体中蛋白质分子链比淀粉颗粒中淀粉分子链更松散。在15°、17°、18°、23°附近是淀粉的衍射峰,蛋白体在相应位置的衍射峰强度很弱,蛋白体内可能嵌合少量淀粉。

图7 蛋白体XRD衍射图
2.9 拉曼光谱
通过分析拉曼光谱图的频率和强度,可以得出信息以反映蛋白质构象变化。纯化前后蛋白体在波数600 ~1 800 cm-1范围内的拉曼光谱如图8 所示。其中1 200 ~1 350 cm-1称为酰胺Ⅲ带,为N—H 面内弯曲振动和C—N伸缩振动;1 400 ~1 550 cm-1是C—H的伸缩振动区域,即酰胺Ⅱ带;1 600 ~1 700 cm-1是酰胺Ⅰ带,是表征蛋白质二级结构最常用、最可靠的谱带区间,主要是C—O 和C—N 2 种官能团的伸缩振动[16]。由图8 可见,蛋白体在1 650/1 651 cm-1、1 422/1 423 和1 303/1 308 cm-1出现酰胺Ⅰ带、酰胺Ⅱ带和酰胺Ⅲ带峰,而淀粉只在相近的1 459 cm-1和1 340 cm-1处出峰,因此表明所分离的是蛋白体。由表4 可以看出,纯化后上清液和黄软物蛋白体在1 652/1 653 cm-1及1 305/1 304 cm-1处的拉曼光谱强度明显高于纯化前,这2 个峰分别归属于酰胺Ⅰ带和酰胺Ⅲ带。874/878 cm-1为酪氨酸的Fermi共振,纯化后拉曼强度增大,说明蛋白体中酪氨酸残基更加暴露[17]。792/787/784 cm-1为色氨酸吲哚环的拉曼峰位[18]。纯化后蛋白体在420 cm-1处的拉曼强度增强,此峰归属于C—H键,说明经纯化处理后C—H键更加暴露。O—H伸缩峰在3 576/3 678 cm-1,纯化后强度明显减弱,说明分子间结合程度下降。这些拉曼光谱特征说明了纯化后得到的是蛋白体。

图8 蛋白体的拉曼光谱
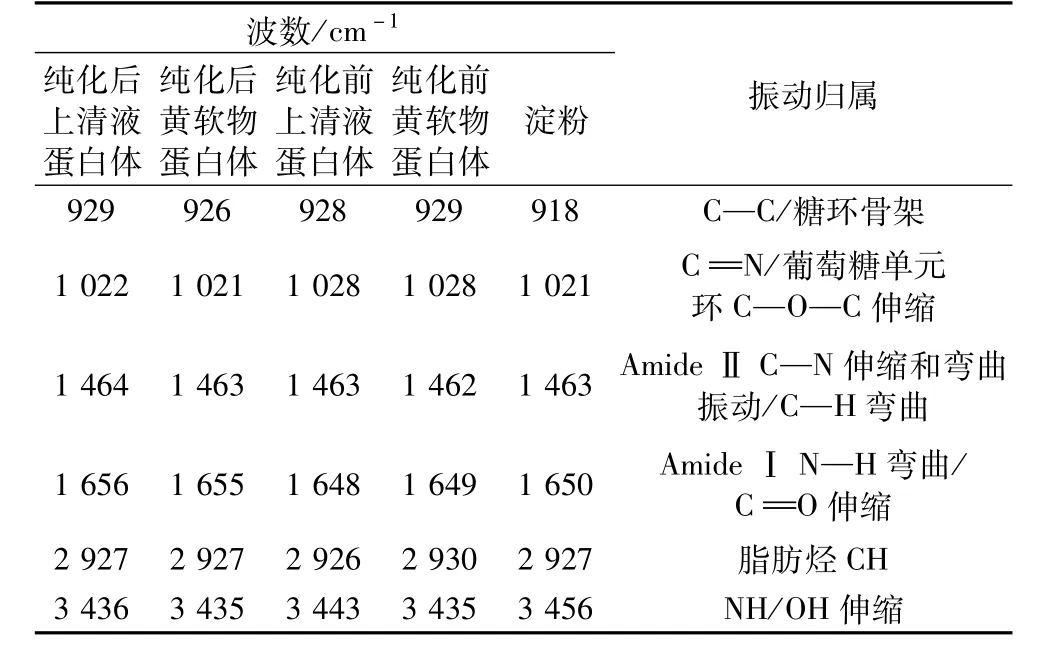
表4 蛋白体红外特征频率及归属

表5 蛋白体拉曼光谱特征峰指认
3 结论
经单因素及响应面实验确定了蛋白体分离的优化条件为:碱液浓度14 mmol/L、液料比12 mL/g、搅拌时间90 min、超声功率90 W、超声温度35 ℃和超声时间40 min,此条件下蛋白体体积分数为20.10%。分离的蛋白体经微孔滤膜和氯化钙纯化后,经光学显微镜、荧光显微镜和扫描电镜、SDS -PAGE电泳、X -射线衍射、红外和拉曼光谱分析表明,所得蛋白体呈微球形,有荧光,由16、22、33、57 ku的亚基组成;X -衍射在19.9°显现出β -折叠的吸收峰峰,红外具有1 464 cm-1和1 534 cm-1的Amide Ⅱ带吸收峰,拉曼在1 303 cm-1和1 651 cm-1具有Amide Ⅲ和Amide Ⅰ带散射峰,均属于蛋白质的特征吸收,表明分离纯化后得到的是蛋白体。因此,以低浓度氢氧化钠溶液从糙米中分离蛋白体是可行的,从而可为稻米中蛋白体的结构和性质及其对稻米食用品质的形成等研究提供方法。
