西藏高原粮油作物曲霉菌污染及菌株产毒力研究
2024-04-10张飞龙
魏 娜,张飞龙
(西藏自治区农牧科学院农业质量标准与检测研究所,拉萨 850032)
曲霉属真菌分布广泛,是常见的食品、粮食、环境污染菌,能在适宜的条件下代谢产生对动物和人类具有致病性的次级代谢产物[1-3]。例如由黄曲霉菌(Aspergillus flavus)和寄生曲霉菌(Aspergillus parasiticus)等产生的次生代谢物黄曲霉毒素(AFB1),具有剧毒和强致癌性,国际癌症研究机构将其列为一级致癌物[4,5];赭曲霉菌(Aspergillus ochraceus)产生的赭曲霉毒素(OTA)具有较强的肾毒性、肝毒性、神经毒性和免疫毒性,能够致癌、致畸、致突变,国际癌症研究机构和世界卫生组织将其列为2B 类致癌物[6,7];杂色曲霉(Aspergillus uersicolor)和构巢曲霉(Aspergillus nidulans)产生的杂色曲霉毒素(ST)基本结构与黄曲霉毒素十分相似,毒性也仅次于黄曲霉毒素,国际癌症研究机构将其归类为2B 类致癌物。为防止真菌毒素对人体的危害,GB 2761—2017《食品安全国家标准食品中真菌毒素限量》规定小麦、大麦、其他谷物及其制品中黄曲霉毒素B1(AFB1)、OTA均不得超过5 μg/kg,花生中AFB1不得超过20 μg/kg。欧盟食品安全局(EFSA)于2013 年6 月7日发布了食品和饲料中的杂色曲霉毒素对公众的健康风险意见[8-10]。
真菌污染是制约粮油产业发展和出口贸易的主要危害因子。目前,国内已有许多学者报道我国粮油作物受黄曲霉毒素、赭曲霉毒素、杂色曲霉毒素等多种曲霉菌毒素污染[11-17]。目前国内外对曲霉属产毒菌分布、产毒能力也做了大量研究。Cotty[18]发现农产品容易被黄曲霉菌侵染产生黄曲霉毒素,产AFB的量和类型是由基质、环境和菌株共同决定的。Cotty等[19]发现黄曲霉菌数量随着地区温度升高而增加,随着纬度升高反而减少,且其产毒能力具有明显的地域差异特征。Daou 等[20]研究表明,真菌产毒力也受气候条件影响。西藏高原具有独特的高原生态类型,对研究曲霉毒菌及其毒素污染发生消长变化规律与预警防控等具有重要意义,但有关研究鲜有报道。因此,实验连续5 年开展西藏地区不同类型作物曲霉菌毒素污染评估,通过对西藏粮油样品中曲霉菌分离、鉴定以及黄曲霉菌株产毒力差异分析研究,探明西藏曲霉菌污染发生与污染分布特征,为西藏粮油作物曲霉毒素污染多维预警与精准防控提供参考。
1 材料与方法
1.1 材料
青稞和小麦样品采集:连续5 年分别从西藏拉萨市、山南市、日喀则市、林芝市、昌都市、阿里地区采集麦类作物样品共计1 131 份,其中2017 年750份,2018 年149 份,2019 年191 份,2020 年150 份,2021 年151 份。
花生样品采集:连续5 年从西藏林芝市采集花生样品共计144 份,其中2017 年24 份,2018 年48份,2019 年24 份,2020 年24 份,2021 年24 份。
1.2 方法
1.2.1 籽粒样品真菌毒素检测方法
青稞、小麦、花生籽粒晾干磨碎后,称取5 g样品(精确到0.02 g),加入10 mL 水充分浸润后,再加入10 mL 的V甲酸∶V乙腈(1∶9)溶液,室温下摇床1 h。加入QuEChERS盐包,5 000 g转速下离心5 min。玻璃纤维纸过滤后吸取1 mL 样品滤液直接加入SPE 小柱,待流干后加入0.5 mL乙腈洗脱,吹干,收集全部流出液。乙腈水溶液(体积比1∶1)定容到1 mL,过0.22 μm有机滤膜后,采用高效液相色谱法测定真菌毒素含量。色谱条件为:色谱柱为Eclipse XDB - C18(5 μm,4.6 mm ×150 mm);柱温为35 ℃;流动相为V甲醇∶V水(40∶60);流速为0.7 mL/min;采用柱后光化学衍生法:光化学衍生器254 nm;以荧光检测器检测,激发波长360 nm,发射波长440 nm,进样量10 μL。
1.2.2 曲霉菌的分离、纯化与鉴定
取10 g样品,加入90 mL灭菌水,在室温用涡旋振荡器振荡30 min,制成0.1 g/mL样品菌悬液;再取0.1 g/mL样品菌悬液加入9 mL无菌水试管中,制备出0.01 g/mL 稀释度的悬浮液。每个稀释度取50 μL菌液,涂布在PDA培养基上[14],霉菌培养箱内28℃培养5 d,每个稀释度重复2 次。经形态学初步观察后进行分离纯化,直至得到单个菌落进行ITS(Internal Transcribed Spacer)分子生物学鉴定。引物序列为ITS1:5’- TCCGTAGGTGAACCTGCGG - 3’,ITS4:5’-TCCTCCGCTTATTGATATGC-3’。
1.2.3 产毒菌株培养与测毒
将鉴定获得的黄曲霉菌株在察氏培养基上培养,在真菌培养箱内28 ℃黑暗培养7 d 后,用含0.1%(体积分数)的吐温无菌水将孢子从培养基上冲洗下来,制备黄曲霉菌孢子液备用。将制备好的黄曲霉分生孢子液在光学显微镜下用血球计数板计数,将孢子液的浓度定为1.5 ×107个/mL。加30 mL沙氏液体培养基于100 mL 锥形瓶中,加入1 mL 孢子液,在摇床内以200 r/min速率28 ℃培养7 d后过滤收集菌丝,装入5 mL 冻存管放置冻干机2 d。冻干后准确称取50 mg菌丝,加入甲醇-乙腈-水溶液(体积比2∶2∶1),放入研磨仪中研磨后,50 ℃超声10 min,离心取上清液,上清液加入甲醇-二氯甲烷-乙酸乙酯溶液(体积比1∶1∶1),再次50 ℃超声10 min后,离心取上清液,过0.22 μm有机滤膜后,采用高效液相色谱法测定真菌毒素含量。色谱条件同1.2.1。
1.2.4 超标率判定
参照GB 2761—2017,青稞和小麦中AFB1、OTA限量值为5. 0 μg/kg。花生中AFB1限量值为20 μg/kg。GB 2761—2017 未规定毒素限量值的,本实验不做判定。
2 结果与分析
2.1 西藏主要农作物曲霉属真菌污染研究
选取204 份样品(135 份青稞,57 份小麦,12 份花生样品),以PDA为分离培养基,通过形态学和分子生物学鉴定,共分离出15 种411 株曲霉菌,其中32 份青稞样品受到曲霉菌污染,样品的感染率为23.70%;9 份小麦样品受曲霉属真菌污染,样品感染率为15.79%;8 份花生样品受曲霉属真菌污染,样品感染率为66.67%。411 株曲霉菌中,6 株菌株未能鉴定到种,其他菌株分别为:A. amstelodami、A. aryzae、A. awamori、A. chevalieri、A. costaricaensis、A. cristatus、A. flavus、A. fumigatus、A. minisclerotigenes、A. nidulans、 A. niger、 A. rugulosus、 A. tubingensis、A. unguis、A. ustus。表1 可见,青稞共中分离到11 种曲霉菌,主要是菌种为A. flavus、A. niger、A. tubingensis;小麦中分离到8 种曲霉菌,其主要菌种为:A. amstelodami、A. niger、A. tubingensis;花生种分离到曲霉菌的仅有A. aryzae、 A. flavus、A. minisclerotigenes 3 种曲霉菌。A. flavus 是青稞、小麦、花生共有的污染菌。青稞、小麦中优势种均为A.niger,分离频度分别为65.33%、31.25%。花生优势种为A. flavus,就花生不同部位而言,分离到的82%黄曲霉菌来自花生壳,18%来自花生仁。

表1 西藏不同农作物曲霉菌种类及百分比
2.2 西藏不同农作物真菌毒素污染研究
由表2 可见,2017—2021 连续5 年对西藏粮油作物(青稞、小麦、花生)中6 种主要真菌毒素污染进行监测,结果表明西藏青稞、小麦、花生真菌毒素污染相对较轻。
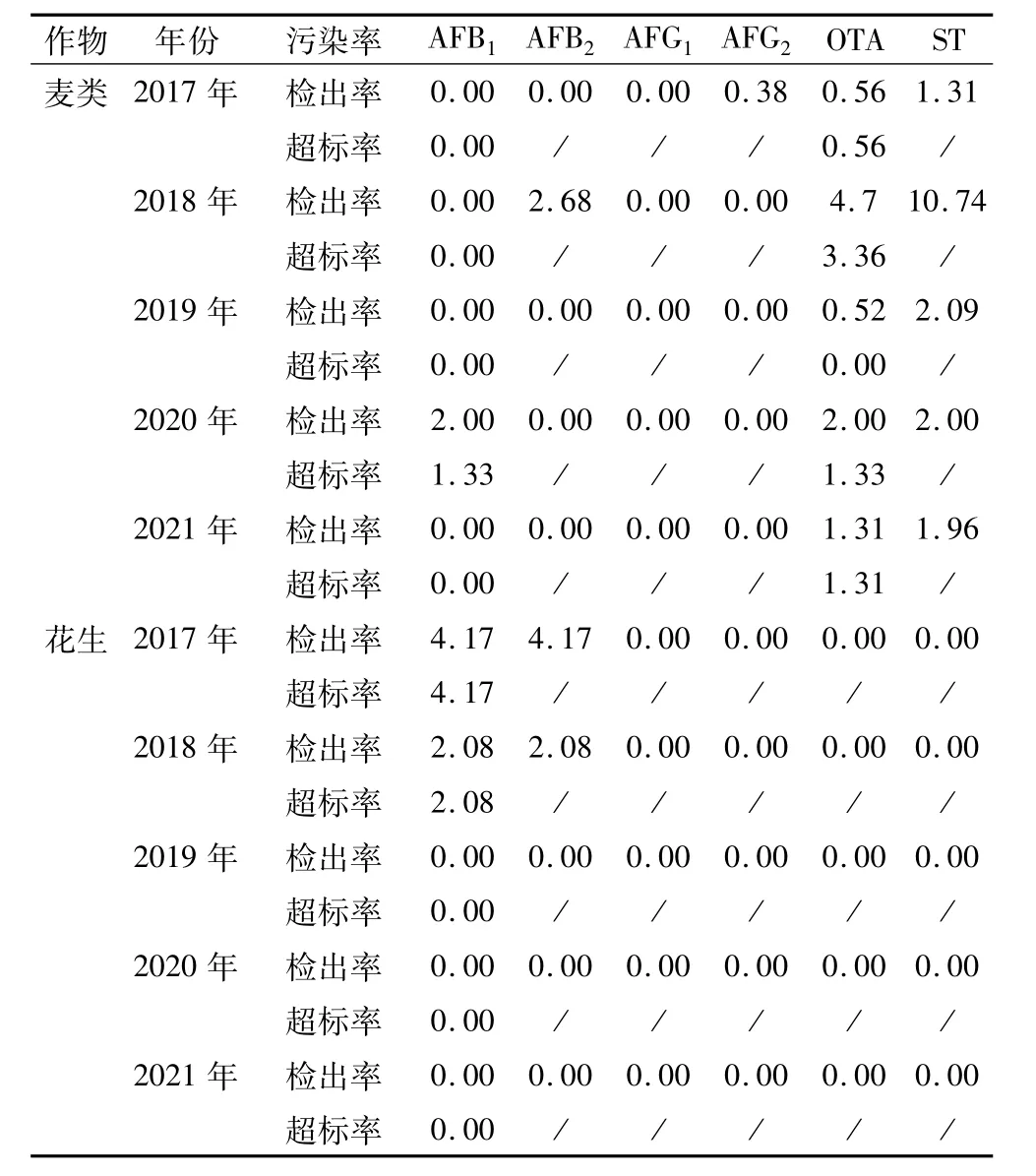
表2 西藏不同作物不同年限真菌毒素污染率/%
污染西藏麦类作物的真菌毒素主要为杂色曲霉毒素,其次为赭曲霉毒素,二者连续5 年均有检出,杂色曲霉毒素检出率范围为1.31% ~10.74%,赭曲霉毒素检出率范围为0.56% ~4.70%,超标率范围为0.00% ~3.36%。麦类作物种4 种黄曲霉毒素污染较轻,仅2017、2018、2020 年有检出,且仅有1 种黄曲霉毒素检出,检出率最高为2.68%,超标率最高为2.01%,AFB1检出量最高为29.67 μg/kg,AFB2检出量最高为23. 10 μg/kg,AFG2检出量最高为43. 16 μg/kg。
花生样品仅有黄曲霉毒素污染,2017 年24 份花生样品中仅有1 份样品黄曲霉毒素有检出,AFB1含量为38.67 μg/kg,AFB2含量为8.77 μg/kg,黄曲霉毒素总含量为47.44 μg/kg,AFB1检出率和超标率均为4.17%;AFG1、AFG2均未检出;2018 年48 份样品中仅有1 份样品黄曲霉毒素有检出,AFB1含量为58.44 μg/kg,AFB2含量为8.69 μg/kg,黄曲霉毒素总含量为67.13 μg/kg,AFB1、AFB2检出率和超标率均2.08%。2019—2021 年24 份样品中AFB1、AFB2、AFG1、AFG2均未检出。
2.3 不同黄曲霉菌株产毒力差异研究
对分离得到的60 余株黄曲霉菌株进行产毒力检测,结果表明,西藏高原不同黄曲霉菌株产AFB1、AFB2、AFG1、AFG2、黄曲霉总量(AFT)含量范围分别为0.0 ~35 050.5 μg/kg、0.0 ~4 232.9 μg/kg、0.0 ~19.2 μg/L、0.0 ~7.7 μg/kg、0.0 ~39 310.3 μg/kg;平均含量分别为3 534.2、447.7、2.2、1.2 μg/kg。其中青稞中黄曲霉菌株产AFB1、AFB2、AFG1、AFG2的平均含量分别为1 531.56、85.38、0.00、0.03 μg/kg;小麦中黄曲霉菌株产AFB1、AFB2、AFG1、AFG2的平均含量分别为6 409.76、426.14、0.00、0.02 μg/kg;花生中黄曲霉菌株产AFB1、AFB2、AFG1、AFG2的平均含量分别为665.92、953.55、4.90、4.49 μg/kg。西藏高原黄曲霉菌株产AFB1和AFB2毒素能力较强,产AFG1和AFG2毒素能力较弱,表3 相关分析表明,西藏菌株产AFB1含量与AFB2显著正相关,相关系数为0.508;产AFG1含量与AFG2显著正相关,相关系数为0.822;B族毒素与G族毒素整体呈负相关。
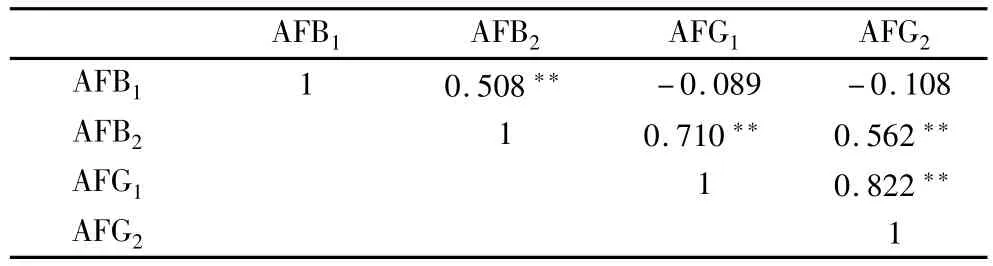
表3 不同类型黄曲霉毒素含量相关性
从麦类作物分离的所有黄曲霉菌株均能产黄曲霉毒素。其中产AFB1黄曲霉菌株数量最多,占总菌株数量98.11%,其次为AFB2菌株,占所有菌株数占总菌株数量的66.04%,产AFG1、AFG2菌株数量最少,分别为33.96%、20.75%。图1 可见,产毒菌株按照检测到的毒素种类分为6 种:只产AFB1,只产AFG1,只有AFB1和AFB2,只产AFB1和AFG1,产AFB1、AFB2、AFG1,产AFB1、AFB2、AFG2,产AFB1、AFG1、AFG2,有AFB1、AFB2、AFG1、AFG2。产毒菌株以产AFB1、AFB2为主,占所有菌株47.17%;其次是只产AFB1、AFG2菌株,占比16.98%;只产AFB1菌株占所有菌株的11.32%;4 种毒素都产的菌株占比为9.43%;其他4 种类型产毒菌株占比为1. 89% ~3.77%。

图1 黄曲霉菌株产毒类型
从花生分离出的所有黄曲霉菌株均能产黄曲霉毒素。其中产AFB1黄曲霉菌株数量最多,占总菌株数量94.44%,其次为产AFG2菌株和AFB2菌株,分别占所有菌株数占总菌株数量的77.78%、72.22%,产AFB2菌株数量最少,为61.11%。图1 可见,产毒菌株按照检测到的毒素种类分为6 种:只有AFB1,只有AFB1和AFG2,只有AFB2、AFG2,有AFB1、AFB2、AFG1,有AFB1、AFB2、AFG2,有AFB1、AFB2、AFG1、AFG2。产毒菌株以产AFB1、AFB2、AFG1、AFG2为主,占所有菌株55.56%;其次是只产AFB1菌株,占比16.67%;只产AFB1和AFG2黄曲霉菌株占所有菌株的11.11%,其他3 种类型产毒菌株各占5.56%。
为进一步研究黄曲霉毒素的产毒能力的大小,本研究根据菌株产黄曲霉毒素含量,将其产毒能力划分为4 个等级:高产毒菌(>1 000 μg/kg)、中产毒菌(100 ~1 000 μg/kg)、低产毒菌(0 ~100 μg/kg)和不产毒菌(ND)。
如表4 所示,麦类作物低产AFT 菌株占32.07%,中产AFT 菌株占33.95%,高产AFT 菌株仅占22.64%。花生低产AFT菌株占44.45%,高产AFT菌株占44.44%,中产AFT 菌株仅占11.12%。虽然麦类作物高产毒菌株比例低于花生,但产毒量5 000 μg/kg的麦类作物占比16. 80%,花生为0.00%。

表4 西藏黄曲霉菌株产毒力分布
3 讨论
本研究发现污染西藏麦类作物的真菌毒素主要为杂色曲霉毒素,其次为赭曲霉毒素,但本研究中并未分离到产杂色曲霉的常见菌株杂色曲霉和构巢曲霉及产赭曲霉毒素的赭曲霉菌株,分离出大量黑曲霉(A.niger),黑曲霉曾作为食品级安全的“微生物细胞工厂”,被美国食品药品监督管理局认定为一般安全可靠无毒的微生物[21-23],但现在越来越多研究表明黑曲霉能够产出对人体有毒害作用的赭曲霉毒素[24-30],西藏粮油作物中赭曲霉毒素污染是否来源A.niger菌株,值得进一步研究。
西藏高原花生产地位于西藏林芝市察隅县,属亚热带河谷气候。冬暖夏热,常年湿润多雨,年平均降雨量为1 000 mm,年平均相对湿度69%,温湿度比较适宜于黄曲霉生长,本研究中也分离到较多的黄曲霉菌,多数来自花生壳,花生壳比花生仁更易感染黄曲霉菌,这可能是因为荚壳是抵御黄曲霉菌侵染的第一道防线[31]。这些黄曲霉菌适宜温湿度黑暗培养环境下,100%黄曲霉菌株都产AFT,且菌株产毒能力相当高,但西藏高原花生样品中黄曲霉毒素污染率较低,仅为0.00% ~4.17%。探究高产毒真菌在西藏高原相对适宜温湿度条件下污染率较低的原因,在温湿度因子研究基础上,进一步增加紫外辐射、光照时间、氧气含量、昼夜温差等高原气候因子研究产毒真菌产毒机制对于推进真菌毒素高效防控具有重要意义。
据报道,黄曲霉只能产生B 族黄曲霉毒素,而不能产生G族黄曲霉毒素[32],但也有研究表明黄曲霉能产生B族和G族毒素[33-35]。朱婷婷等[34]研究结果显示,黄曲霉菌主要以产B 族毒素为主,具有产毒能力的菌株一定会产生危害性极大的AFB1毒素;周飘[35]研究也表明能产G 族毒素的黄曲霉菌株一定能产B族毒素。本研究结果表明西藏高原花生中黄曲霉菌株同样是产B 族毒素能力较强,平均含量比G族毒素含量高100 多倍,但本研究分离到产G 毒素却不产B 毒素这一特殊菌株,在前期研究中也发现仅有AFG2毒素污染,没有其他种类黄曲霉毒素污染的现象[16],高原环境下产毒真菌毒素发生及代谢途径是否与平原环境不一致,高海拔地区产毒真菌代谢合成途径及产物以及产毒菌株基因组学等有待进一步研究。此外,菌株检测到产生不同种类毒素究竟是菌株自身产毒能力的差异还是代谢转化的结果需进一步研究确证。
本研究在检测黄曲霉菌株产毒力时,先采用滤液-孢外产毒法,结果显示26.4%黄曲霉菌株不产毒,为进一步核实又采用菌丝-孢内产毒进行检测,所有菌株都能产毒。可见不同检测方法对菌株产毒力影响很大,不同的培养基由于碳源、氮源及渗透压的不同对菌株的产毒力也有影响[36,37],目前国内仅有NY/T 2311—2013 规范了黄曲霉毒素孢外检测方法,亟需研究制定孢内法测定菌株产毒能力的检测标准,并规范不产毒菌株的定义。
4 结论
对西藏不同类型作物中曲霉属菌污染情况研究表明,204 份样品中,共分离出15 种曲霉菌,青稞样品中曲霉菌污染率为23.70%;小麦样品污染率为15.79%;花生污染率为66.67%。西藏高原不同作物污染优势菌群并不相同。麦类作物青稞、小麦中曲霉属优势种均为A. niger,分离频度高达65.33%,花生优势种为A. flavus。污染西藏麦类作物的真菌毒素主要为杂色曲霉毒素,其次为赭曲霉毒素。分离的所有黄曲霉菌株均能产黄曲霉毒素,其中产AFB1黄曲霉菌株数量最多。
