肝、脾及腰椎R2*值评估慢性肾衰竭患者体内铁含量
2024-04-09马培旗张小艳王仲秋李小伟许星成
李 旭,马培旗,张小艳,王仲秋,李小伟,许星成,张 磊*
[1.蚌埠医科大学附属阜阳医院(阜阳市人民医院)影像中心,2.肾内科,安徽 阜阳 236000]
贫血是慢性肾衰竭(chronic kidney failure,CKD)常见并发症,且风险随CKD进展而增加[1]。补铁治疗中,部分肾性贫血患者可因非绝对缺铁或未严格监测体内铁含量而出现铁过载;体内多余铁主要沉积在肝、脾及腰椎等器官中。骨髓涂片铁染色法[2]是诊断缺铁性贫血的金标准,肝活检是反映非肝硬化背景下体内铁含量的金标准[3];但二者均为侵入性检查,临床应用受限。铁代谢指标检测是临床评估铁含量的最常用方法,具有简单、易行、价格低、可重复检查等优点,但易受炎症、感染及肿瘤等因素影响[4]。MR改良Dixon定量(modified DIXON quantification,mDIXON-quant)序列采用多梯度回波技术得到R2*mapping,其R2*值与铁含量高度相关,已广泛用于评估肝脏铁浓度(liver iron concentration,LIC)及骨髓内铁含量。本研究观察肝、脾及腰椎R2*值用于评估CKD患者体内铁含量的价值。
1 资料与方法
1.1 研究对象 回顾性分析2021年1月—2022年1月52例蚌埠医科大学附属阜阳医院CKD患者,男29例、女23例,年龄23~74岁、平均(42.8±10.0)岁。以转铁蛋白饱和度≤20%为绝对铁缺乏[5],据此将患者分为绝对缺铁组(n=22)和非绝对缺铁组(n=30):绝对缺铁组,男14例、女8例,年龄25~59岁、平均(46.0±9.9)岁;非绝对缺铁组,男16例、女14例,年龄23~74岁、平均(40.6±9.7)岁。纳入标准:①于我院肾内科接受治疗;②实验室检查及影像学资料完整。排除标准:①合并遗传性血色病等铁代谢疾病;②合并慢性肝病;③3个月内接受输血治疗;④合并恶性肿瘤;⑤合并严重感染及营养不良;⑥腰椎骨折病史。本研究经院医学伦理委员会审核通过(2021[55]号),患者均签署知情同意书。
1.2 仪器与方法 采用Philips Ingenia CX 3.0T超导MR扫描仪,8通道腹部专用线圈。嘱患者仰卧,将线圈置于上腹部正中,进行扫描。参数:腹部轴位mDixon-quant,屏气扫描,TR、TE均为系统默认最短,FOV 400 mm×35 mm,分辨率2.5 mm×2.5 mm×6 mm,NEX 1,扫描时间12 s;腰椎矢状位mDixon-quant,TR 8.0 ms,TE 1.45 ms,FOV 156 mm×360 mm,分辨率2 mm×2 mm×6 mm,NEX 1,扫描时间20 s。
1.3 图像处理 采用Philips Intellispace Portal后处理软件,生成R2*伪彩图;于肝门层面避开肝内血管、胆管、胆囊、椎体骨皮质及椎间盘等勾画肝、脾ROI各3个,测量3个ROI R2*值后均取平均值为最终结果(图1A、1B);于L1~L5椎体正中矢状面各放置1个ROI,取5个ROI R2*值的平均值为最终结果(图1C)。
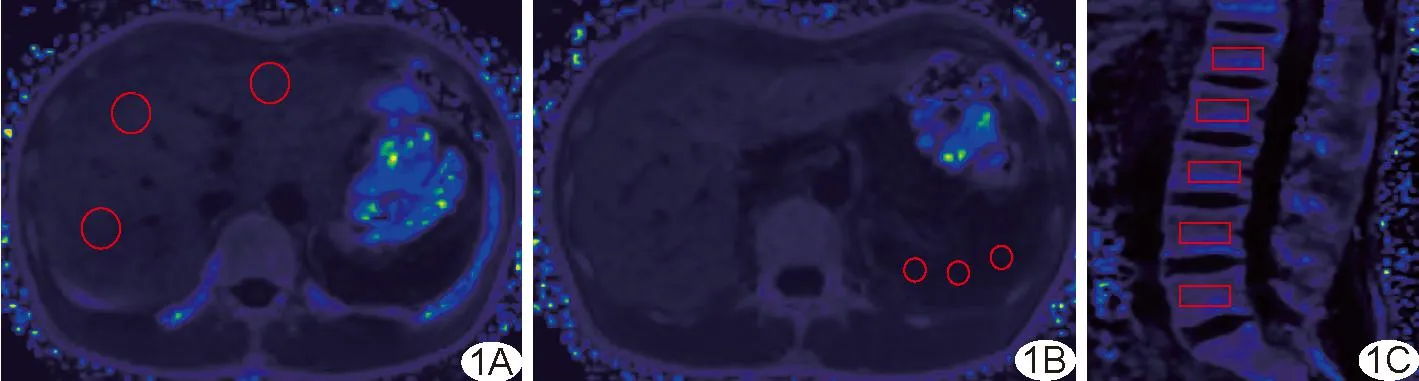
图1 于R2*伪彩图上勾画肝脏ROI(A)、脾脏ROI(B)及腰椎ROI(C)示意图(圆圈及方框均为ROI)
1.4 铁代谢指标检测 于MR检查前、后共24 h内采集空腹血液标本,检测铁代谢指标,包括铁蛋白、不饱和铁结合力、总铁结合力、转铁蛋白、转铁蛋白饱和度及铁元素。
1.5 统计学分析 采用SPSS 26.0统计分析软件。以±s表示符合正态分布计量资料,组间比较采用两独立样t检验。采用Spearman相关分析观察R2*值与铁代谢指标的相关性。行二元logistic回归分析,观察CKD患者绝对缺铁的影响因素。绘制受试者工作特征(receiver operating characteristic,ROC)曲线。P<0.05为差异有统计学意义。
2 结果
绝对缺铁组与非绝对缺铁组转铁蛋白饱和度、脾和腰椎R2*值差异均有统计学意义(P均<0.05)。见表1。
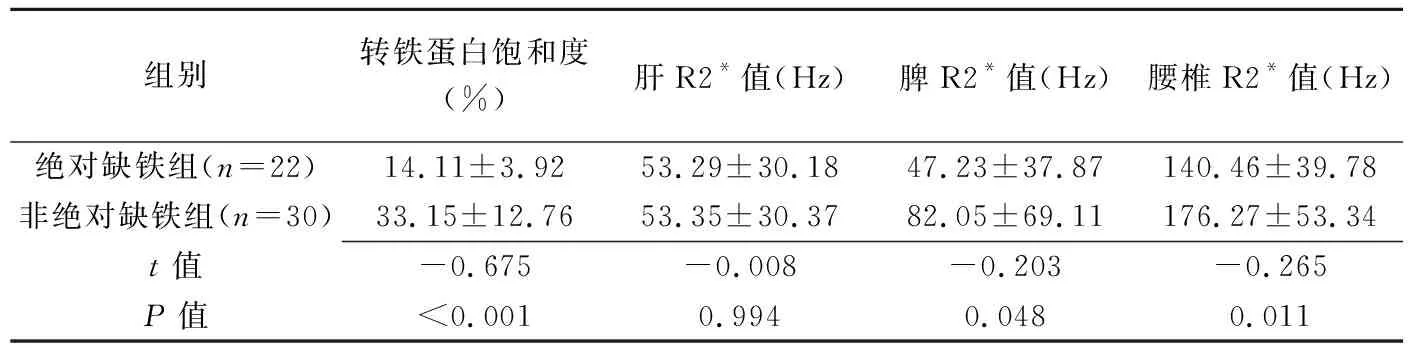
表1 绝对缺铁与非绝对缺铁CKD患者转铁蛋白饱和度及肝、脾、腰椎R2*值比较
CKD患者脾、腰椎R2*值与铁蛋白、转铁蛋白饱和度均呈正相关(P均<0.05),与不饱和铁结合力、总铁结合力及转铁蛋白均呈负相关(P均<0.05)。见表2。

表2 CKD患者肝、脾及腰椎R2*值与铁代谢指标的相关性分析
腰椎R2*值减低是CKD患者绝对缺铁的影响因素(P<0.05,表3)。以腰椎R2*值=134.26 Hz为最佳截断值,其诊断CKD患者绝对缺铁的敏感度为86.70%,特异度为68.20%,曲线下面积(area under the curve,AUC)为0.727。
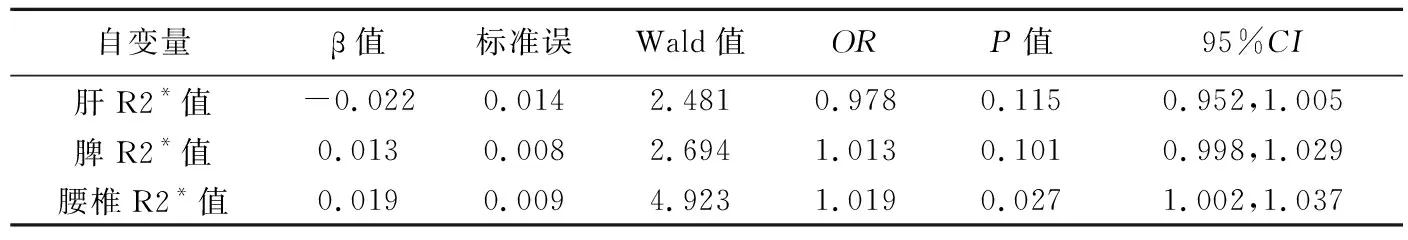
表3 CKD患者绝对缺铁影响因素的logistic回归分析
3 讨论
CKD患者缺铁原因包括失血、肠道铁吸收功能差、红细胞生成刺激剂(erythropoiesis stimulating agent,ESA)治疗导致铁利用增加、机体储存铁部位释放受损[6];其中,失血可由透析时血液滞留、尿毒症性血小板功能障碍等因素引起。纠正CKD患者贫血时,常需反复静脉注射铁剂,从而可导致正铁平衡[7];而人体并无排泄多余铁的生理机制,仅能通过使用螯合剂达到负铁平衡[8]。若体内铁过多而未及时治疗,多余铁则可沉积于组织器官中,引起脂质过氧化,从而损伤细胞,导致癌症及血液病等[9]。因此,持续监测CKD患者体内铁浓度极为重要。
R2*技术是目前无创定量LIC的可靠影像学方法[10-11]。本研究采用mDIXON-quant为多梯度回波技术,通过1次扫描即可得到脂肪分数(fat fraction,FF)图、T2*mapping及R2*mapping;其中,FF图可直接用于测量脂肪含量,T2*值可量化组织内结构及物质代谢变化,R2*值则能反映组织内铁含量;同时,该技术还可有效减少主磁场不均匀性、涡流效应、T1偏差和脂肪共振磁化偏移的影响,具有简便、可重复、采集速度快、水脂分离效果佳等优势[12-13]。
生理情况下,人体内大部分铁储存于肝脏内,因此LIC可反映全身铁代谢情况。然而,本研究结果显示,绝对缺铁组与非绝对缺铁组肝R2*值差异无统计学意义,且肝R2*值与铁代谢指标均无明显相关性;可能由于CKD患者长期处于炎症状态,网状内皮系统中储存铁被限制释放,使其无法被利用[14]。而组间脾和腰椎R2*值差异均有统计学意义,且二者与铁代谢指标具有一定相关性;主要在于脾中的铁主要储存在巨噬细胞中,而巨噬细胞在血浆中释放铁的能力远强于肝细胞,使得长期炎症状态下该机制利用率大大提高[15];而腰椎为造血器官之一,是体内主要铁代谢器官[16],而CKD患者促红细胞生成素减少,红细胞减少,红骨髓转化活跃度增高,导致腰椎R2*值与铁代谢指标关系更为紧密。同时,本研究结果显示腰椎R2*值减低是CKD患者绝对缺铁的影响因素,以134.26 Hz为最佳截断值诊断CKD患者绝对缺铁的敏感度为86.70%,特异度为68.20%,AUC为0.727。
综上所述,腰椎R2*值有助于评估CKD患者体内铁含量。然而,本研究样本量较小,有待未来扩大样本量进行更深入地探索。
利益冲突:全体作者声明无利益冲突。
作者贡献:李旭研究设计和实施、查阅文献、撰写和修改文章;马培旗研究设计、图像处理、数据分析、统计分析;张小艳图像处理、数据分析;王仲秋数据分析、查阅文献;李小伟和许星成数据分析;张磊指导、研究设计、修改和审阅文章、经费支持。
