超声分子影像组学评估前列腺癌前列腺特异膜抗原表达:实验研究
2024-04-09黄钊希黄方易
李 蓉,黄钊希,黄方易,袁 晗,高 泳
(广西医科大学第一附属医院超声科,广西 南宁 530021)
前列腺癌(prostate cancer,PCa)居男性癌症死因第2位[1],其前列腺特异膜抗原(prostate specific membrane antigen,PSMA)表达水平与疾病进展、复发显著相关[2],PSMA表达水平越高,则患者生存期越短。靶向PSMA放射性药物具有广阔应用前景,但筛选最佳收益患者至关重要[3-4]。临床主要通过PSMA-PET诊断PSMA阳性PCa[3],但因价格昂贵、有放射性、检查时间长等而应用受限。影像组学对于评价肿瘤基因表达具有重要价值。既往研究[5-6]基于影像组学预测肿瘤Ki-67、KRAS等基因表达,或利用68镓标记PSMA配体进行PET/MR成像[7]而发现PCa MRI纹理特征与其PSMA表达相关,但鲜见基于超声分子成像构建超声组学模型评估PCa PSMA表达相关研究。本研究建立不同PSMA表达人前列腺肿瘤细胞移植瘤裸鼠模型,观察超声分子影像组学评估其PSMA表达的价值。
1 材料与方法
1.1 制备与检测靶向PSMA超声纳米泡(nanobubble,NB)
1.1.1 制备NB 按比例称取1,2-二棕榈酰-锡-甘油基-3-磷酸胆碱(1,2-dipalmitoyl-sn-glycero-3-phosphocholine,DPPC)、1,2-二棕榈酰-sn-甘油-3-磷酸(1,2-dipalmitoyl-sn-Glycero-3-Phosphate,DPPA)、1,2-二棕榈酰基-sn-丙三基-3-磷酸乙氨醇(1,2-distearoyl-snglycero-3-phosphorylethanolamin,DPPE)及二硬脂酰磷脂酰乙醇胺-聚乙二醇-羧(1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[carboxy(polyethylene glycol)],DSPE-PEG-COOH),与氯仿混合并充分溶解,置于加热板上制成薄膜小瓶。加入Pluronic 124和甘油,65℃水浴后混合均匀;注入全氟丙烷气体后高速振荡60 s,4℃倒置分层2 h,抽取下层清液,即NB。按比例加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(N-(3-dimethylaminopropyl)-N'-ethyl-carbodiimide,EDC)、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)、PSMA多肽(序列为CQKHHNYLC,携FITC荧光基团,由多个氨基酸合成),加入磷酸盐缓冲液(phosphate buffer solution,PBS)离心清洗3次,以去除未结合的PSMA多肽,制得靶向PSMA超声NB(PSMA-NB),置于4℃条件下避光保存。
1.1.2 检测PSMA-NB表征 取适量上述样品,以预冷PBS稀释至1∶1 000倍;采用马尔文纳米粒度电位仪,参数设置为T=25℃、laser wavelengh=660 nm、angle=90°,检测其平均粒径及Zeta电位。
1.1.3 体外PSMA-NB超声造影(contrast-enhanced ultrasound,CEUS) 取适量上述样品,以预冷PBS稀释至1∶100倍。采用GE Logiq E9超声仪、9L-D探头行体外CEUS,频率7 MHz,机械指数0.11,动态范围54 dB,增益3 dB,观察PSMA-NB用于体外成像的效果。
1.2 动物实验
1.2.1 实验材料 19只4~5周龄BALB/C-nu雄性裸鼠由广西医科大学实验动物中心提供;人前列腺癌22RV1细胞株、PC-3细胞株购自北京协和细胞资源中心。本研究通过广西医科大学动物伦理委员会批准(202203767)。
1.2.2 构建人前列腺肿瘤细胞移植瘤裸鼠模型 以含10%胎牛血清的RPMI-1640培养基培养人前列腺癌细胞系22RV1细胞(PSMA表达阳性),以含10%胎牛血清的F-12K培养基培养人前列腺癌细胞系PC-3细胞(PSMA表达阴性)[8]。取对数生长期细胞,按1×107个细胞/只将22RV1细胞接种于9只裸鼠背部右侧皮下(阳性组),将PC-3细胞以5×106个细胞/只接种于10只裸鼠背部右侧皮下(阴性组)。
1.2.3 靶向PSMA超声分子成像 待移植瘤最大径达约1.0 cm时以3%戊巴比妥钠腹腔注射麻醉荷瘤裸鼠,以GE Logiq E9超声仪、9L-D探头,选取移植瘤最大切面,先行常规成像,再于经尾静脉注射200 μl PSMA-NB后行CEUS,参数同前。
1.2.4 肿瘤组织学分析 造影结束后取出肿瘤组织并制备切片标本,采用Hoechst 33342荧光染料避光染色5 min,以抗荧光衰减剂封片;以正置荧光显微镜于200倍下观察PSMA-NB与22RV1、PC-3肿瘤组织结合情况。
1.3 影像组学分析
1.3.1 分割图像及提取特征 将超声分子成像动态视频分割为静态图片(每秒1帧),由2名具有10年以上工作经验的超声科医师采用ITK-SNAP 3.8.0软件共同勾画肿瘤ROI(图1),以Python软件Pyradiomics包提取影像组学特征,包括形状、一阶特征、梯度特征、灰度共生矩阵(gray level co-occurrence matrix,GLCM)、灰度游程矩阵(gray level run length matrix,GLRLM)、灰度尺寸区域矩阵(gray level size zone matrix,GLSZM)、邻域灰度差分矩阵(neighbourhood gray tone difference matrix,NGTDM)、灰度相关矩阵(gray-level dependence matrix,GLDM)及小波变化等。

图1 勾画人前列腺癌22RV1细胞裸鼠皮下移植瘤ROI示意图 A.灰阶声像图; B.CEUS图; C.移植瘤ROI(红色区域)
1.3.2 选择特征与构建模型 将提取特征行加权平均及Z-score标准化处理。随机选取64幅CEUS图,计算其影像组学特征的组内相关系数(intra-class correlation coefficient,ICC),针对ICC>0.75者行独立样本t检验,保留差异有统计学意义(P<0.05)特征,以Pearson相关性分析进行降维,设阈值为0.9。
按7∶3比例将裸鼠随机分为训练集(n=13,包括阳性5只、阴性8只)与测试集(n=6,包括阳性4只、阴性2只)。采用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)筛选关键特征,再通过多层感知机(multilayer perceptron,MLP)构建影像组学模型,以5折交叉验证检验其稳定性。
1.4 统计学分析 采用Python 3.7统计分析软件,绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC),评价影像组学模型诊断PSMA阳性PCa的效能。
2 结果
2.1 PSMA-NB表征检测 PSMA-NB平均粒径为(392.2±31.56)nm,Zeta电位为(-29.3±0.95)mV,见图2。
2.2 体外PSMA-NB CEUS PSMA-NB呈点状均匀细腻强回声,PBS显示为无回声的液性暗区。PSMA-NB用于体外成像效果理想。见图3。
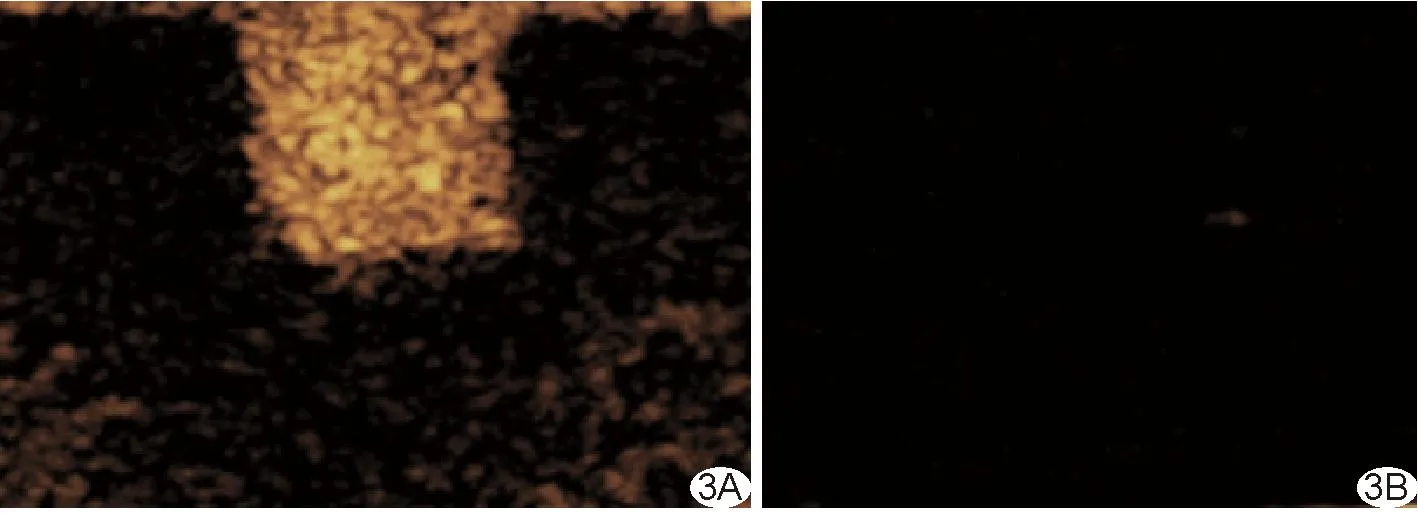
图3 体外PSMA-NB CEUS图 A.显示PSMA-NB; B.显示PBS
2.3 组织学分析 荧光显微镜下PSMA-NB呈绿色荧光(FITC荧光基团),22RV1、PC-3肿瘤组织细胞核呈蓝色荧光(Hoechst 33342染色);大量PSMA-NB分布于PSMA表达阳性的22RV1细胞周围(图4A),而PSMA表达阴性PC-3细胞周围未见明显PSMA-NB绿色荧光分布(图4B)。
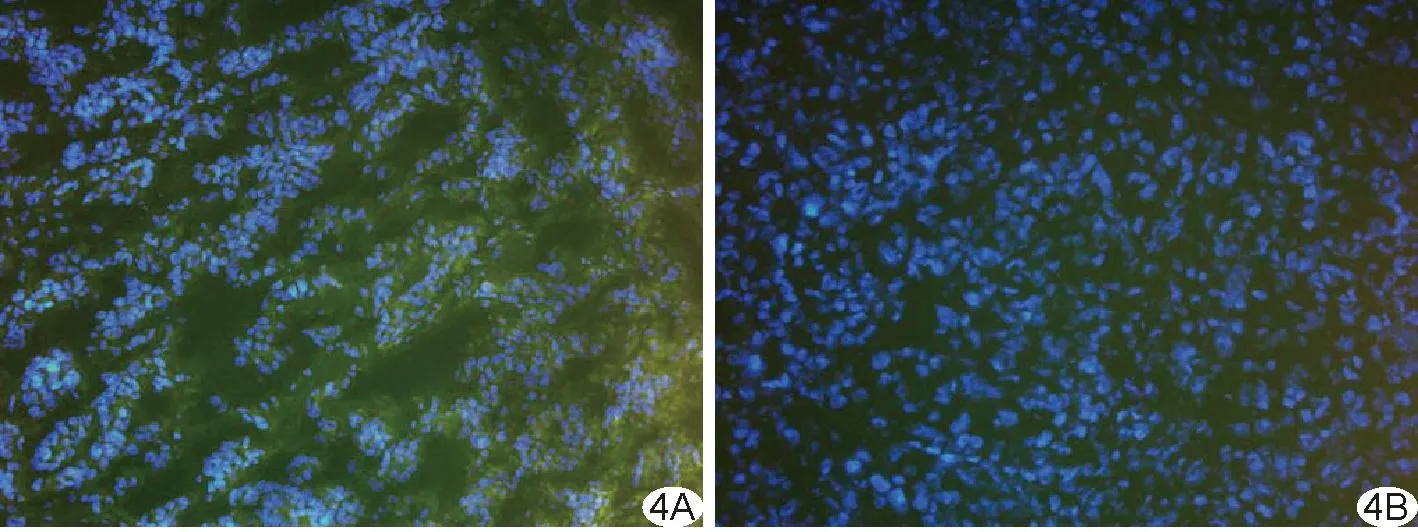
图4 荷瘤裸鼠肿瘤组织PSMA-NB分布荧光合成图(×200) A.PSMA表达阳性; B.PSMA表达阴性
2.4 影像组学特征筛选及模型建立 共分割694幅声像图并提取1 561个超声纹理特征,根据ICC>0.75初步选出1 173个纹理特征。基于训练集,经过单因素分析、Pearson相关性分析及LASSO回归特征降维,最终筛选出3个与PSMA阳性表达相关的影像组学特征,包括1个GLSZM特征exponential_glszm_ZoneVariance及2个GLDM特征,即wavelet_HHH_gldm_SmallDependenceLowGrayLevelEmphasis与logarithm_gldm_DependenceVariance;以之构建的超声分子影像组学模型诊断训练集、测试集PSMA表达阳性PCa的敏感度分别为60.00%、50.00%,特异度均为100%,准确率分别为84.60%、66.70%,AUC分别为0.950、0.875,见图5。
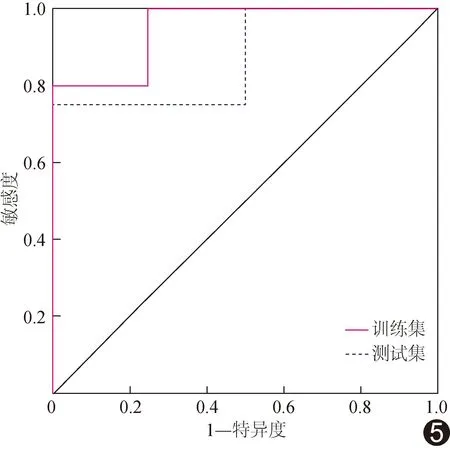
图5 超声组学模型诊断PSMA阳性PCa的ROC曲线
3 讨论
超声分子成像通过将靶向配体(抗体、肽等)连接至超声造影剂表面、使之选择性地与靶位点受体结合并积累而实现靶位点特异性成像。纳米级造影剂可穿越肿瘤血管内皮间隙而进入肿瘤实质组织。本研究所制备的PSMA-NB可特异性识别并较长时间聚集于PSMA表达阳性PCa细胞周围,故支持PSMA靶点特异性成像。
分析超声分子图像时需要手动勾画ROI,存在主观依赖性[9]。影像组学可从医学图像中提取高通量特征并加以分析,以反映组织潜在的病理生理学特征,具有评价肿瘤基因表达潜力[10]。本研究基于靶向PSMA超声分子成像提取其动态图像纹理特征,最终筛选出3个与PSMA阳性表达相关的影像组学特征。其中的exponential_glszm_ZoneVariance是经图像强度指数预处理后提取的特征,可识别肿瘤内不同区域之间的信号强度差异以反映其异质性[11],或可用于观察肿瘤内成分差异[12],PSMA表达水平不同使肿瘤及其微环境变得更加复杂,不断演化最终导致肿瘤呈现异质性;logarithm_gldm_DependenceVariance是经图像强度值对数预处理后提取的特征,其值越高代表依赖性差异越大,图像纹理越不均匀[13];wavelet_HHH_gldm_SmallDependenceLowGrayLevelEmphasis则反映图像的灰度分布特征,参数值越高代表灰度不均匀度越高[14]、纹理越粗糙。既往研究[15]表明,PSMA高表达可增强肿瘤内皮细胞血管生成活性,使肿瘤血管生成增加,导致图像纹理增粗、灰度更不均匀。基于超声分子影像提取组学特征不仅能反映肿瘤内异质性,还可显示微血管灌注特征,获得更多肿瘤信息。本研究基于以上特征构建的超声分子影像组学模型评估训练集和测试集PCa PSMA表达的AUC分别为0.950、0.875,提示其具有较高效能。
综上所述,基于靶向PSMA的超声分子影像组学模型可用于评估PCa裸鼠PSMA表达。
利益冲突:全体作者声明无利益冲突。
作者贡献:李蓉研究设计和实施、撰写和修改文章;黄钊希图像分析、图像处理;黄方易数据分析、统计分析;袁晗查阅文献;高泳指导、审阅文章、经费支持。
