K-W-L教学策略指导下的无机化学实验教学*
——以物质性质的五个实验为例
2024-04-09禹国俊翁哲慧李艳妮杨艳华
禹国俊,翁哲慧,李艳妮,杨艳华**
(1.昆明学院 化学化工学院,云南 昆明 650214;2.温州大学 化学与材料工程学院,浙江 温州 325000)
1986年,美国路易斯大学Ogle教授基于建构主义理论,以问题为中心提出了Step K-What I know(学生已有认知)、Step W-What do I want to learn(学生想学的知识)和Step L-What I learned(学生学到的知识)为步骤的K-W-L教学策略[1],并在1987年奠定了该策略的基础研究步骤[2]。该策略是在学生已有认知基础上,充分遵循学习者主动探究未知领域知识的学习过程(包括思考、阅读、讨论及收集资料等),并在新的教学情境中,构建旧知与新知间的联系,对激发学生学习动力和提升自主学习能力有积极意义[3-4]。
大学化学实验教学是在规范学生操作技能的基础上,让学生真正参与到实验过程中,体验探究过程的乐趣,并加深对理论知识的理解。其中,部分实验属于拓展内容,在新情境下学生表现出对知识掌握不牢,知识迁移能力不足的问题。在前期探索开放式实验教学的基础上[5-12],对拓展性实验使用K-W-L教学策略,采用合理的问题设计,让学生从科学性和学科性角度对新的情境素材进行分析,通过查阅资料、主动探索、积极尝试,使学生融入实验教学中,让实验教学活跃起来[13-14]。本文以实验教学中探究物质性质的5个拓展实验为例[15],探索K-W-L教学策略在无机化学实验教学中的应用。
1 KClO3的氧化性
【实验内容】分别取半勺KClO3固体和硫粉,混合均匀后用纸包住,放于地上铁锤击打,观察现象并解释原因。
[K环节]KClO3中的Cl显+5价,S显0价,两者可发生氧化还原反应:KClO3作氧化剂,生成还原产物O2;S作还原剂,生成氧化产物SO2。而O2可与S反应生成SO2而被消耗,因此,KClO3与S反应生成KCl和SO2。
K环节主要是探寻学生对此实验内容的认识及与此内容相关的已有知识。在新的情境下,根据已有认知作为较为合理的推测。
[W环节]以熟悉KClO3的制备为例O2,反应需有催化剂且加热才能进行。查阅资料可知,鞭炮的原理为:
据此推测此反应与鞭炮的原理类似。但具体生成物有哪些?铁锤击打的作用是什么?KClO3与S在点燃和击打条件下的生成物是否一致?
W环节主要是激发学生思考,进而实现自主学习,让学生带着问题进行有目的的实验探索,构建旧知与新知间的联系。
【实验现象】实验现象如图1所示。铁锤击打后发出响亮的炮炸声,闻到有刺激性气味的气体。一种现象为:滤纸瞬间燃烧,并产生少量的白烟;另一种现象为:滤纸没有燃烧,产生大量的白烟。根据鞭炮原理推测,白色的烟为爆炸产生的固体小颗粒KCl,刺激性气味气体为SO2。点燃和击打条件下的生成物应该不一样。

图1 KClO3和S混合后击打的实验现象
[L环节]以鞭炮原理为例进行分析,虽然鞭炮爆炸是放热反应,但需要提供能量以达到反应所需的活化能,反应才可进行。鞭炮外围包裹的纸层比实验情境中的更加严密,而铁锤击打也是外界提供能力的一种形式,因此,此情境下的反应可以发生。中学采用KClO3制备O2使用MnO2作为催化剂,是通过降低反应活化能,起到加快反应速率的目的。因此,将加热换为锤击以提供反应所需能量,在无MnO2下,也能产生O2。
L环节主要是教师需对学生在探究活动中所获取的信息进行总结归纳,引导学生得出实验结论,并对实验操作和结论进行评价。进而实现知识的正向迁移,让学生获得新的知识且加深对新知的理解。
注意:此反应有一定危险性,取用的KClO3固体和硫粉的量要少,混合均匀时使用塑料药匙。铁锤击打时对准固体混合物多的部分,力度要大。由于取用的KClO3固体和硫粉没有定量,观测到两种实验现象。
按K-W-L教学策略设计的KClO3氧化性实验,让学生体会到了除光照、点燃和加热外,通过外界机械力提供化学反应能量的方式,一方面,强化了安全意识、增强了实验趣味性;另一方面,拓展了学科视野,培养实事求是的科学精神。
2 白磷的性质
【实验内容】取麦粒大小的白磷,并用滤纸吸干表面,放入装有 1 mL 二硫化碳的坩埚中,轻轻摇动使其溶解。用坩埚钳夹住一条滤纸,浸入白磷溶解的二硫化碳溶液中。在空气中摇动滤纸,观察现象并解释原因。
[K环节]初中化学使用红磷(元素符号P)燃烧生成P2O5探索空气的组成。在后续学习中使用白磷和红磷分别与氧气的反应,探索燃烧的三要素为:可燃物、与空气(氧气)充分接触、温度达到着火点。并已知白磷的着火点比红磷低、且两者为同素异形体。
[W环节]磷的元素用P表示,白磷和红磷的分子结构是否一样?白磷燃烧是否也生成P2O5?为什么可以用CS2溶解白磷?查阅资料可知,白磷用符号P4表示,易溶于CS2等非极性溶剂中。白磷易燃,但初中化学在“燃烧与灭火”课题中,多以教学视频或教师主讲等形式开展演示实验,学生无亲身感受。
【实验现象】实验现象如图2所示。挥动浸泡过CS2溶解的白磷溶液纸条,由于CS2挥发性较好,挥发完全后,留在纸条上的白磷自燃。

图2 浸润过含有白磷的CS2溶液的滤纸在空气中燃烧
[L环节]白磷用符号P4表示,空间结构呈正四面体,非极性物质,因此,可溶于非极性溶剂。燃烧生成的氧化物主要为P4O10和P4O6,与P4分子的空间结构呈正四面体有关,如图3所示。P4中的P—P键有张力,氧原子可嵌入P—P键间形成P4O6。若氧原子中处于p轨道的电子对进入磷原子空的d轨道中形成d-p π配位键,即可形成P6O10[16]。
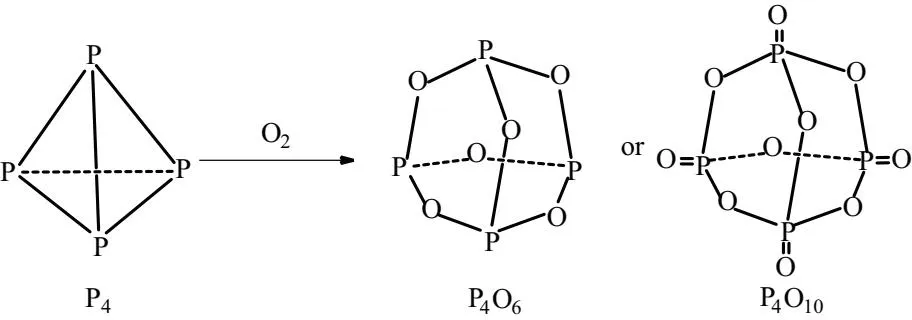
图3 白磷P4与P4O10和P4O6的空间结构
【实验原理】白磷与氧气反应生成P4O10或P4O6。
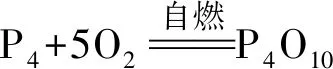
注意:CS2易挥发且有毒,取用时不要过多,溶解白磷时速度要快。白磷易自燃,取用时速度要快,此实验可小组合作完成,需在实验室通风橱或风机下完成。
按K-W-L教学策略设计的探究白磷自燃实验,拓展了磷元素知识体系。通过教师释疑和学生操作相结合,让学生深刻体会物质结构与性质的关系。
3 铅丹(Pb3O4)的组成
【实验内容】取少量Pb3O4固体与 6 mol/L HNO3(质量分数约为68%)混合并不断搅拌,观察固体颜色的变化,并与Pb3O4的颜色进行比较(见图4)。过滤,固液分离后,滤液放入试管①中,并加入少量K2CrO4溶液,观察现象并解释原因。固体放入试管②中,并加入 2 mL 3 mol/L 的H2SO4溶液和2滴 0.1 mol/L 的MnSO4溶液,微热,静置澄清后,观察溶液颜色变化并解释原因。

图4 铅丹的组成实验步骤及现象
[K环节]提及Pb3O4,首先想到的是Fe3O4。中学化学提及黑色的Fe3O4中含有Fe2+和Fe3+,橘红色的Pb3O4之前未接触过,对其组成和性质不了解。
[W环节]查阅资料可知,铅丹是古代常用语炼制丹药的一种物质,且有毒。例如,明代李时珍《本草纲目》记载了铅丹的炒制方法及其功效;南宋陆游《梅花》中写道“雾雨更知仙骨别,铅丹那悟色尘空”;北宋苏澈《奉使契丹二十八首 神水馆寄子瞻兄四绝(十)》中写道“莫倚皂貂欺朔雪,更催灵火煮铅丹”中,都对铅丹的作用及其蕴含的意境进行了描述。那么,铅丹的组成是什么?
此环节主要通过含有铅丹的古诗词及文献记录,感受古人对铅丹的认识,激发学生学习兴趣,通过探究铅丹的组成,更加科学的认识铅丹的作用。
【实验现象】实验现象如图4所示,Pb3O4与浓HNO3反应后,橘红色固体变成黑色。固液分离后,盛有滤液的试管①中加入K2CrO4溶液后,有黄色沉淀生成。盛有固体的试管②中加入H2SO4溶液后固体不溶解,再加入MnSO4溶液后,水浴加热,黑色固体消失,溶液变粉紫色。
[L环节]经过分析,黑色固体应为PbO2,试管①中的黄色沉淀为PbCrO4。试管②溶液变澄清,应是酸性条件下,PbO2与MnSO4发生氧化还原反应。
【实验原理】Pb3O4+4HNO3(浓)=2Pb(NO3)2+2H2O+PbO2(黑色)
试管①:Pb2++CrO42-=PbCrO4↓(黄色)
试管②: 5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O
因此,根据Pb3O4与浓HNO3的化学反应方程式推断,铅丹(Pb3O4)的组成是2PbO·PbO2。
【课外拓展】设计实验内容,验证Fe3O4的组成。
【方法导引】[K环节]高中化学学过使用KSCN溶液鉴别检验Fe3+的存在:SCN-与Fe3+反应,不与Fe2+反应。
[W环节]KSCN溶液不能用于同时含有Fe3+和Fe2+的溶液。用什么试剂可以鉴别同一溶液中,含有Fe3+和Fe2+呢?
[L环节]取适量Fe3O4固体于试管中,加入盐酸使其溶解(这时的试管溶液中含有Fe3+和Fe2+,溶液呈黄色):Fe3O4+8H+=Fe2++2Fe3++4H2O。
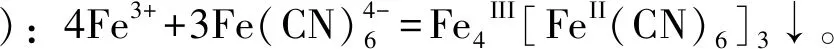
方法②:在试管中加入少量蒸馏水,然后加入NH4F溶液(F-与Fe3+反应生成无色的[FeF5(H2O)]2-):Fe3++5F-+H2O=[FeF5(H2O)]2-,黄色溶液逐渐变为浅绿色(Fe2+在水溶液中的颜色)。
方法③:试管溶液一份为二,其中一支试管加入KSCN溶液,溶液变红,说明有Fe3+的存在;另一支试管中加入铁氰化钾溶液,溶液变蓝,说明有Fe2+的存在。
按K-W-L教学策略设计的探究铅丹组成实验,不仅将人文知识与化学知识进行了融合,而且可以培养学生科学的学科思维,从铅丹的组成中理性看待古人对炼丹的痴迷、药理学功效和赋予的理想意境。此外,通过课外拓展,进一步培养学生的探究意识和创新意识。
4 Al与O2的反应
【实验内容】取一片砂纸打磨过的洁净铝片,表面滴加2滴 0.5 mol/L 的HgCl2溶液。当HgCl2溶液覆盖的铝片区域颜色由银白色转变成灰色时,用棉花将溶液擦干。观察铝片表面的变化并解释原因。
[K环节]Al与O2在高温条件下发生反应,生成Al2O3。Al在空气中时,表面生成致密氧化膜,不能进一步反应,且可在冷的浓硝酸和浓硫酸中发生钝化。
[W环节]HgCl2在这里的作用可能是降低反应活化能,起到催化剂的作用。
[L环节]Hg的金属活动性排在Al的后面,因此,单质Al可从Hg的化合物中置换单质Hg。在HgCl2溶液与Al片的界面间有单质微量的Hg产生,以活泼金属Al为负极、惰性金属Hg为正极、HgCl2为电解液,组成原电池,加快了Al的氧化,此时,Al片表面的银白色转变成灰色。擦去HgCl2溶液后,生成的Al2O3与空气接触后,受潮,变成蓬松状。
【实验原理】Al与O2反应生成生成Al2O3。
HgCl2属于危险化学品,有剧毒,此实验不宜在实验教学中开展,此实验以讲解的形式进行。一方面,在已熟知的知识点上进行面的拓展;另一方面,开拓学生学科思维,培养学生科学精神。
5 锌钡白的制备
【实验内容】在试管中加入 1 mL 0.2 mol/L 的BaS溶液,然后交替加入 0.2 mol/L 的ZnSO4溶液和 0.2 mol/L 的BaS溶液,并不断搅拌。维持溶液pH为8 ~ 9,静置后,倾析法分离固体。
[W环节]生成的ZnS和BaSO4都为白色沉淀,不易区分,锌钡白到底是哪种沉淀?
【实验现象】实验现象如图5所示(试管中产生白色沉淀)。

图5 锌钡白实验现象
[L环节]生成的两种白色沉淀ZnS和BaSO4混合在一起,以ZnS·BaSO4的形式出现。此复盐俗称立德粉,可用于油漆、油墨和橡胶等的着色,是一种性能优良的白色颜料。
【实验原理】ZnSO4(aq)+BaS(aq)=ZnS·BaSO4↓
此实验内容相对简单,但在K-W-L策略的教学环境下,不仅可以培养学生学以致用的意识,而且还可以增强学生的学科认同感。
综上所述,K-W-L教学策略在5个实验中的应用设计如表1所示。K-W-L教学策略应用在实验教学中的拓展实验时,通过合理的问题设计与教师引导,在规范实验操作的基础上,实现了旧知与新知的过渡,符合“最近发展区”和“先行组织者”理论。在新的素材情境下,实现了学生自主学习与探究学习相结合,有利于增加学生的认知内容。K-W-L教学策略的实施,不仅有利于培养学生问题意识和探究意识,而且对培养学生科学实验思维和研究能力有积极的促进作用。

表1 K-W-L教学策略在5个实验中的应用举例
6 展望
K-W-L教学策略在发展学生元认知、构建学科思维、突出学生的主体地位和教师主导作用方面,有积极的促进作用[2]。通过选取合适的教学内容,根据实际情况适当调整K-W-L策略,在探索物质基本性质和掌握实验操作的基础上,使学生更好的参与到教学过程中,提升无机化学实验的课堂教学质量。
