手持技术在化学反应速率教学中的实践*
2024-04-09于法锋汤希雁刘志平
葛 静,于法锋,汤希雁,刘志平**
(1.南宁市第十四中学,广西 南宁 530021;2.南宁市第三中学,广西 南宁 530021;3.南宁师范大学,广西 南宁 530001)
手持技术,即在手上就可以完成操作的技术,主要由传感器、数据采集器和配套软件等实验技术系统组成。手持技术相关仪器可以定量收集和提取实验数据,通过传感器采集数据后,计算机进行数据显示、数据分析、数据存储,并以图形图像方式呈现实验的动态变化过程,体现了现代化技术与化学学科的充分融合[1]。手持技术能够广泛地应用于化学实验中,主要表现为三个特点:改进传统化学实验、辅助传统化学实验和创新实验。在化学实验中采用手持技术可以充分利用它的优点,展示实时的实验数据,揭示反应动态变化过程,提高学生对化学核心知识的理解与认知。
1 手持技术融入课堂教学的重要性
1)化抽象为具体,增强实验结果的直观性
在化学课堂中使用手持技术辅助教学,能将抽象化的知识点进行形象化,增强实验结果的直观性,培养了广大学生独立地分析实践问题和解决实际问题的能力,减少学生的学习障碍。
2)化被动为主动,促进探究活动的实践性
在新课程改革形势下,倡导教学活动开展多元化的实践探究活动,而手持技术便于操作,为学生进行实验探究提供强大的技术支持。小组内可自行设计实践方案,化被动学习为主动认知。
3)化记忆为理解,促进学生认知的理解性
手持技术能实时获取实验数据,行成动态的变化曲线,有利于学生认识化学反应的规律与实质,增强和提高学生对化学知识的理解,避免传统的灌输性记忆式学习。
4)化传统为现代,增强实验装置的科技性
手持技术通过简单的传感器实时获取常规实验难以收集的数据,不仅提高了化学实验的趣味性,也增强了化学创造的科技感。
2 手持技术在化学反应速率教学中的案例实践
温度、压强、催化剂等因素对化学反应速率的影响较为抽象,因此采用案例探究来驱动教学任务,通过方案设计、实验探究、数据收集、分析归纳等环节来开展本节课的教学活动,有利于学生深入理解外界因素是如何影响化学反应速率的。
2.1 探究浓度对反应速率的影响
以硫代硫酸钠与稀硫酸的反应为案例,控制相同浓度的稀硫酸与不同浓度的硫代硫酸钠之间的反应,利用色度传感器采集数据,观察透光率随时间的变化曲线图[2]。
[实验仪器]比色皿、色度传感器、数据采集器
[实验药品]Na2S2O3溶液 (0.2 mol/L、0.1 mol/L、0.05 mol/L)、1.0 mol/L 稀硫酸,见表1。

表1 实验药品

[实验内容]用移液管根据表1的药品比例向比色皿中加入先后加入 2 mL 浓度为 0.2 mol/L Na2S2O3溶液、2 mL 浓度为0.1 mol/L Na2S2O3溶液、2 mL 浓度为0.05 mol/L Na2S2O3溶液,连接好仪器,然后迅速倒入 1 mL 稀硫酸溶液,马上放进色度传感器,通过数据采集器记录透光率随时间变化的数据(图1)。
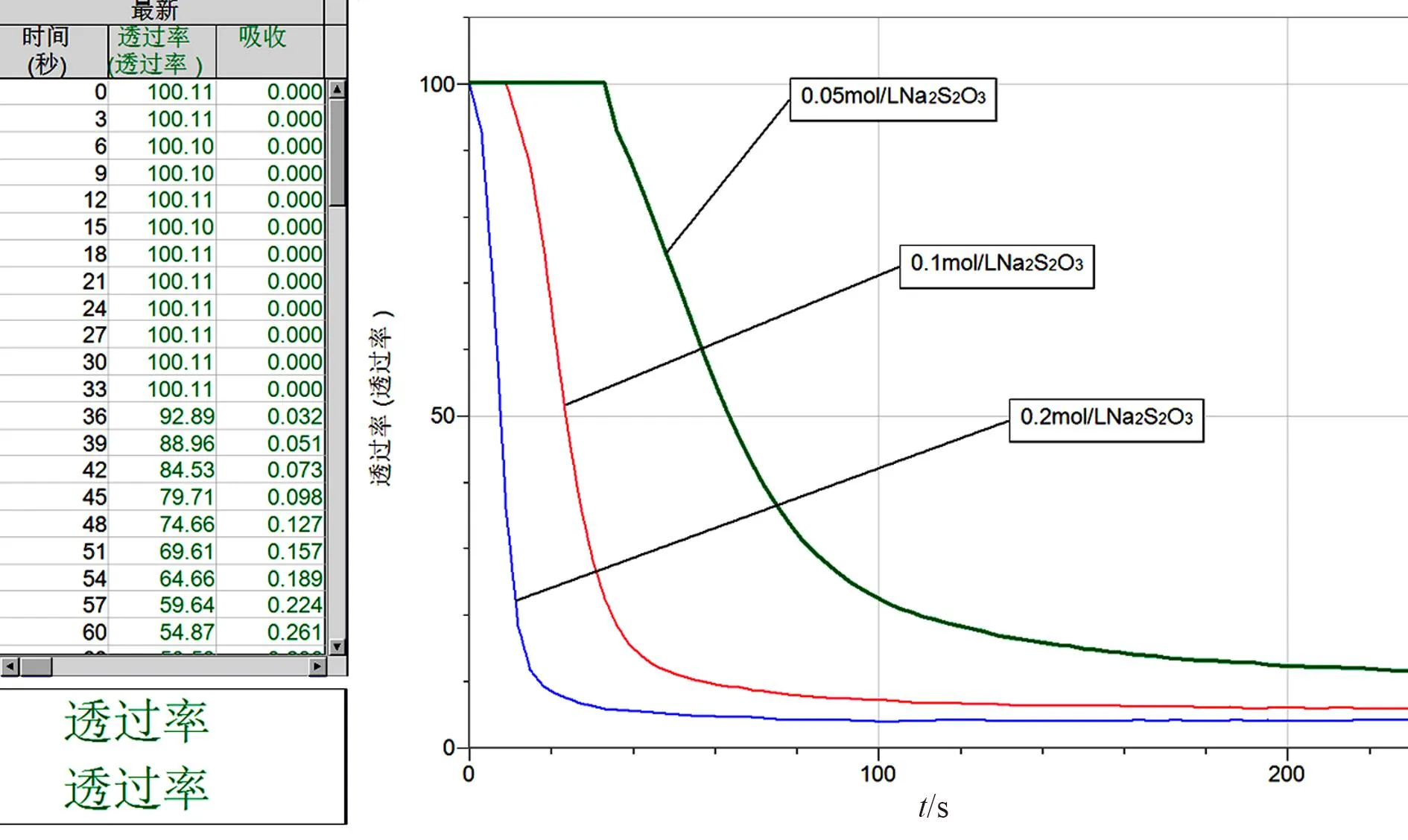
图1 透过率随时间的变化曲线图
[学生观察与讨论]图1显示出在单位时间内硫代硫酸钠的浓度越高,透过率越低,说明生成黄色的硫单质的量越多,时间与透光率形成的曲线斜率就越大。当其它条件不变时,增加反应物的浓度,可以增大反应的速率。由此可以推出反应物的浓度越高,化学反应速率越快,也说明反应物浓度越大对化学反应速率的影响也越大。
[讨论分析]增大反应物浓度,活化分子增多,反应速率加快。
[归纳总结]在其他外界条件下不变的情况下,活化的分子在各种反应物的分子中占有一定的百分比,当反应物浓度有所增加时,单位体积内的活化分子浓度就会有所增加,单位体积内的有效碰撞速率也就会随之增加,化学反应速率也就会随之加快。
2.2 探究压强对反应速率的影响
以二氧化碳与水反应生成碳酸的可逆反应为案例,对比测量单位时间内生成碳酸的快慢,解释压强对化学反应速率的影响。
[实验仪器]电脑,数据采集器,二氧化碳传感,pH值传感器等。
[实验药品]二氧化碳气体、蒸馏水
[实验内容]向装有 20 mL 蒸馏水的三颈烧瓶注入 20 mL CO2气体,通过pH值传感器采集pH值随时间的变化。同样,将 40 mL 二氧化碳注入含有 20 mL 蒸馏水的三颈烧瓶中,同样记录pH值度随时间的变化(图2)。
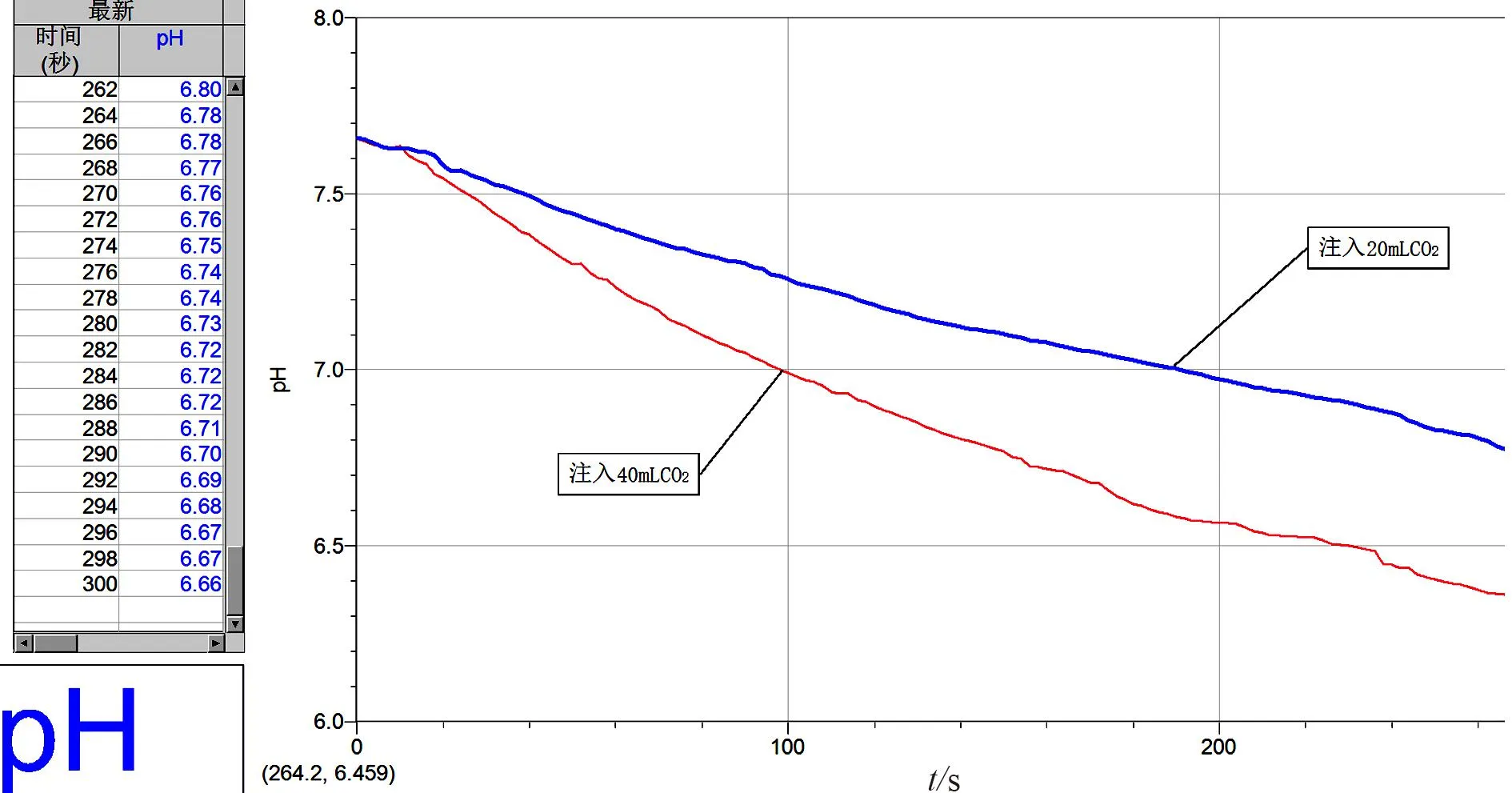
图2 pH值随时间变化曲线图
[学生观察并讨论]通过观察pH值随时间的变化曲线可以知道,在单位时间(0~100 s)内,注入 40 mL CO2气体的pH值比注入 20 mL CO2气体的pH值下降更快,说明注入 40 mL 二氧化碳与水生成的碳酸更多,也就是说增大体系的压强可以加快化学反应速率。
[教师引导分析]请同学们试着分析对于有气体参加的化学反应,增大气体的体积会加快反应速率?同学们可以结合有效碰撞理论进行分析。
[讨论分析]对于有气体参加的反应,在其它条件不变的情况下,气体的体积与其所受的压强成正比。这意味着如果气体压力增加两倍,体积会减少一半,单位体积内的分子会增加两倍,不同物质的浓度会增加,有效碰撞的次数增加,化学反应的速度也会加快。
[归纳总结]在其他条件不变情况下,增大压强,相当于增大单位体积的各组分的浓度,单位体积内所含活化分子数目增多,有效碰撞地几率也会增大,所以反应速率也就会增大。相反,压强下降,气体体积膨胀,气体浓度下降,反应速度下降。所以增大压强的实质其实是通过增加气体反应物的浓度来增加反应速率。
2.3 探究温度对反应速率的影响
以H2O2分解释放氧气为案例,利用手持技术记录在不同温度下H2O2分解时动态测量气体压力随时间的变化,精确实时的显示出温度对化学反应速率的影响的变化曲线。
[实验准备]实验仪器:气压传感器、温度计、数据采集器
[实验药品]30%H2O2
[实验原理与设计]利用手持技术设计过氧化氢分解产生氧气的实验,控制其它条件不变的情况下,改变反应体系的温度,通过气压传感器测量产生气体的压强,观察不同温度下,化学反应速率的快慢。
[实验步骤]将恒温槽里的水温调节控制在 20 ℃ 和 60 ℃,按照实验装置图连接好装置,用量筒量取2份 5 mL 30%的过氧化氢溶液倒入2支相同规格的试管中,分别采集同浓度不同温度下温度随时间的变化量,待数据稳定后停止采集(图3)。
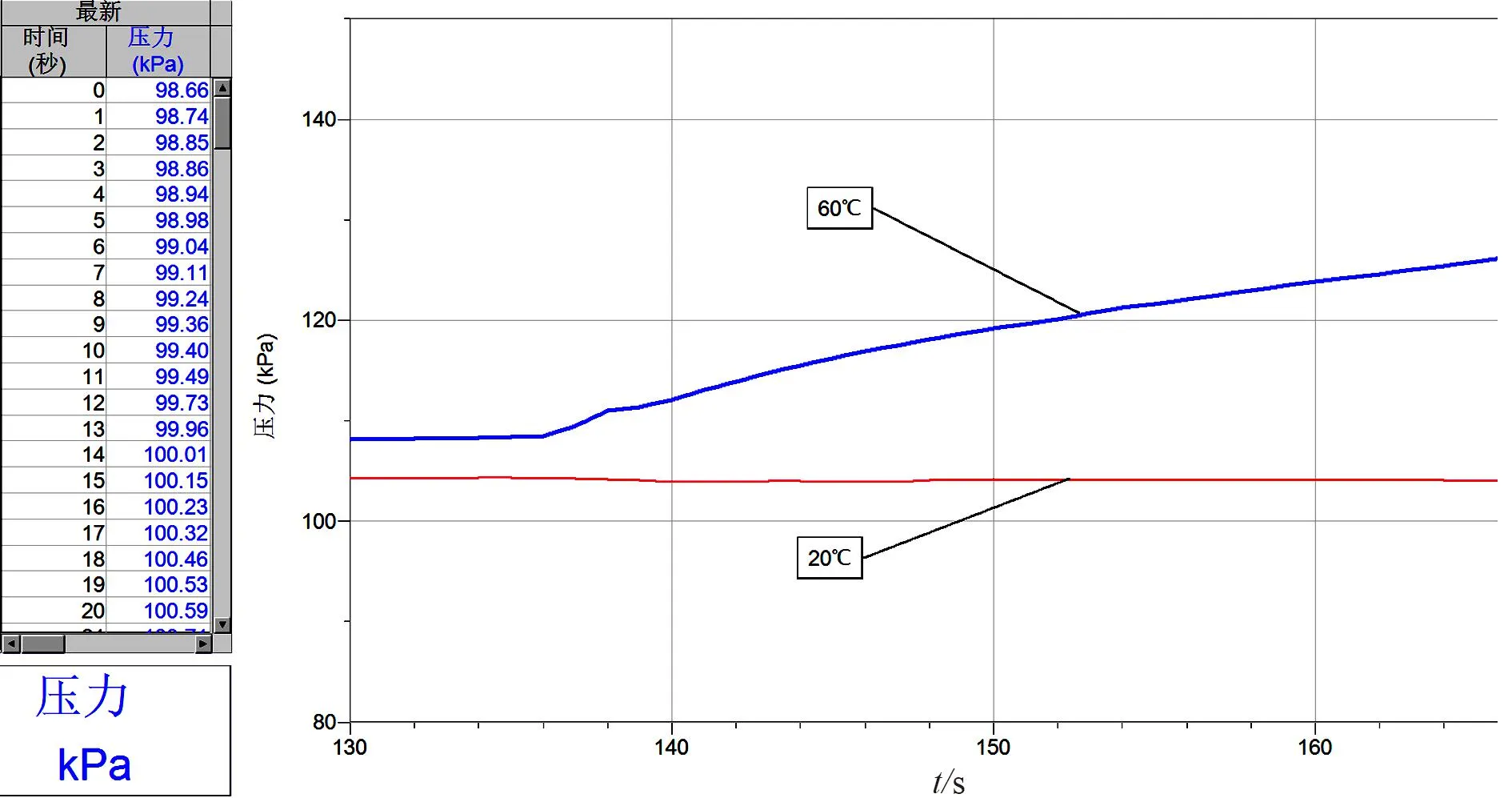
图3 气压随时间变化曲线图(温度)
[实验数据记录与分析]
[学生观察与讨论]图3显示出在 20 ℃ 下H2O2分解特别的缓慢几乎不分解,在单位时间内 60 ℃ 下H2O2分解比在 20 ℃ 下分解产生的O2更多,所以气体压力增大得更快,60 ℃ 下压力与时间的曲线斜率比 20 ℃ 下压力与时间的曲线斜率更大,说明温度越高H2O2的分解产生的O2越多,化学反应速率越快。
[归纳总结]在其它条件不变的情况下,升高温度,活性分子数量增加,活性分子百分比增加,有碰撞频率增加,反应速度加快。
2.4 探究催化剂对反应速率的影响
以H2O2分解反应为案例,利用手持技术记录在同一浓度的H2O2溶液下加入催化剂MnO2的气压随时间的变化,精确实时的显示出温度和催化剂对化学反应速率的影响的变化曲线。
[实验准备]实验仪器:气压传感器、温度计、数据采集器
[实验药品]30%H2O2、MnO2
[提出问题]加入催化剂对化学反应速率的影响是加快还是减慢?
[实验内容]先用量筒量取2份 5 mL 30%的过氧化氢溶液倒入2支规格相同的试管中。先用气压传感器采集没有加入二氧化锰试管的数据,再采集加入二氧化锰试管的数据,对比两个实验的差异(图4)。
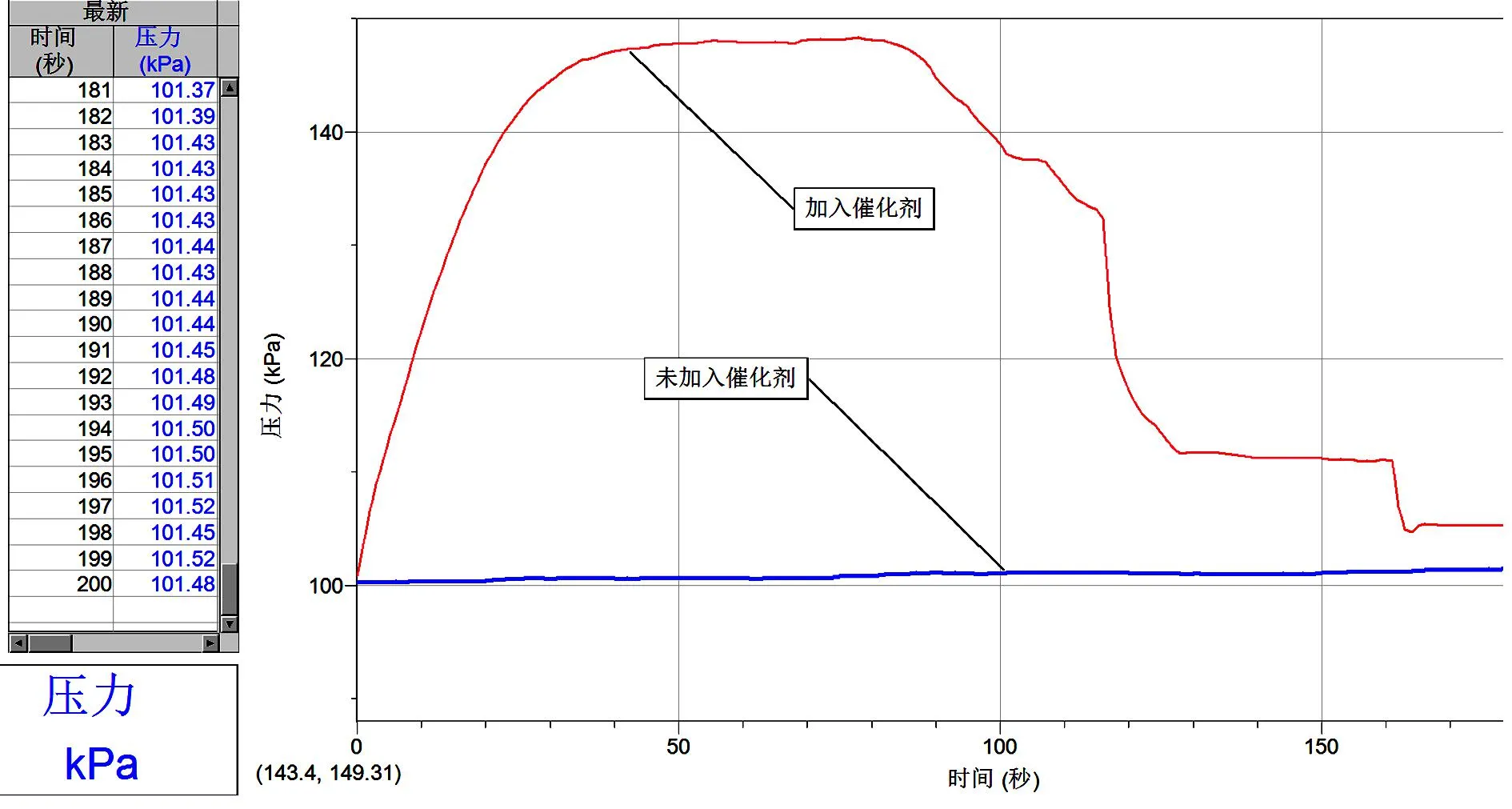
图4 气压随时间变化曲线(催化剂)
[实验数据记录与分析]
[学生观察与讨论]图4显示出添加催化剂能加速H2O2分解,在单位时间(0~50 s)内,向过氧化氢溶液添加催化剂产生的氧气量比未添加催化剂时产生的氧气量多得多,所以气体压力增加得更快,这表明在化学反应中加入催化剂会加快化学反应的速率。
[归纳总结]在其它条件不变的情况下,使用催化剂就会改变反应途径,降低反应的活化能,增大活化分子的百分比,增加了有效碰撞的频率,加快了化学速率。
3 实践反思
采用手持技术作为一种强大科技化探究工具,具有便携、直观、灵活等特点,在教育现代化及数字化教学中具有积极作用。
运用手持技术使难以观察到的实验现象变得直观化,也有可能将微小的实验现象进行放大,把实验现象呈现给所有学生,使全体学生都能体验通过实验获取化学知识的学习[3]。此外,手持技术能实时精准的反映动态变化,学生可以通过数据曲线明确一个化学反应的反应速率并不是均匀变化的,加深对速率图像的理解。将手持技术广泛应用于课堂和教学中的实践,能够充分激发和培养学生的自主学习兴趣,同时提高学生在实践中的操作技巧,对学生信息收集、获取、加工等方面的综合素养。
