自动电位滴定仪标定硫氰酸钠标准溶液
2024-04-09卢会珍杜建侠
卢会珍,杜建侠,李 红
(湖北三峡实验室,湖北 宜昌 443000)
硫氰酸钠是一种重要的化学试剂,遇酸产生有毒气体,其水溶液一般情况下呈现中性,与银盐或铜盐作用生成白色的硫氰化银沉淀或黑色的硫氰化铜沉淀。化工分析中硫氰酸钠标准溶液主要用于测定氯乙酸等产品中游离氯的含量。
传统的硫氰酸钠标准溶液的标定方法,一般采用如下的两种方式。
1)佛尔哈德(Volhard)直接滴定法。在酸性介质中,以铁铵矾为指示剂,用NaSCN标准溶液滴定,达化学计量点时,微过量的SCN-与指示剂Fe3+生成了FeSCN2+红色配离子,则指示滴定终点到达,停止滴定。
2)按照GB/T601—2016规定,先称取 0.6 g 于干燥器中干燥至恒重的硝酸银基准试剂,溶于 90 mL 纯水中,加入 10 mL 淀粉及 10 mL 硝酸水溶液,以217型双盐桥饱和甘汞电极作参比电极,以及用216型银电极做指示电极,用预先配制的硫氰酸钠标准溶液进行滴定实验。
以上两种滴定方法不同程度的存在使用化学试剂繁多,所使用的化学试剂对环境有所污染,同时两种方法操作耗时长,结果受滴定条件的影响波动较大,反应产生的硫氰化银白色沉淀极易吸附在电极上面,导致在滴定过程中电位值很难稳定,因此需要寻求一种方便快捷准确的滴定方法。本文探讨了采用瑞士万通916Ti-Touch型号的自动电位滴定仪进行硫氰酸钠标准溶液的标定,过程简单,操作方便,电位值稳定速度快,可以考虑用于取代手动标定过程。
1 实验原理
硫氰酸钠标准溶液的滴定原理主要是:1)用已标定的AgNO3溶液,以硫酸铁铵[铁铵矾NH4Fe(SO4)2]做指示剂,在酸性溶液中用NaSCN标准溶液滴定,达到化学计量点时,微过量SCN-与Fe3+生成FeSCN2+红色配离子,指示终点达到[1]。


2)电位测定方法是依据滴定的过程中电极电位的突跃,取代常规滴定实验中指示剂颜色的变化来确定终点。进行电位滴定操作时,在被测标准溶液中放入一个参比电极和一个指示电极,即可以组成一个工作电池。随着滴定剂的缓慢加入,工作电池中发生化学反应,被测离子的浓度不断变化,因而指示电极的电位值也会相应地发生变化;在化学计量点附近离子浓度发生突跃,引起指示电极电位发生突跃,因此测量工作电池电动势也会发生变化,最终可以确定滴定终点[1]。
2 实验方法
2.1 传统标定方法
传统硫氰酸钠标液的配制和标定按照国标GB/T601—2016规定执行,需要两名人员进行试验,即:一人四平行、两人八平行滴定。实验所用基准为在硫酸干燥器里干燥的硝酸银基准品,准确称取 0.6 g,精确至 0.1 mg,用待标定的硫氰酸钠标液进行滴定。手动滴定时,此实验使用的是以216型银电极作指示电极,217型双盐桥饱和甘汞电极作参比电极,按照GB/T9725—2007中6.2.2的规定计算V,按下列公式进行计算得出硫氰酸钠浓度。
式中:m为硝酸银样品质量,g;V为硫氰酸钠溶液滴定体积,mL;M为硝酸银的摩尔质量,g/mol。[M(AgNO3)=169.87]。
2.2 自动电位滴定仪实验步骤
本实验采用瑞士万通916Ti-Touch自动电位滴定仪进行标定实验,在标定过程中,先在滴定瓶中加入约 500 mL 待标定的硫氰酸钠标液,然后再用烧杯准确称取 0.6 g 干燥后的硝酸银,溶于 90 mL 的水中,加 10 mL 淀粉溶液和 10 mL 硝酸溶液,将电极放入烧杯中测定其电位,开启搅拌模式,搅拌均匀,开始滴定。预加一定体积的硫氰酸钠标液于硝酸银中反应,再缓慢滴定至终点,通过仪器直接计算出结果,不需要人员手动滴定和计算,方便快捷,提高效率[2]。
2.3 实验结果
2.3.1 滴定方式对滴定结果的影响
对批号为22B-141的硫氰酸钠标准溶液的标定数据见表1、表2。
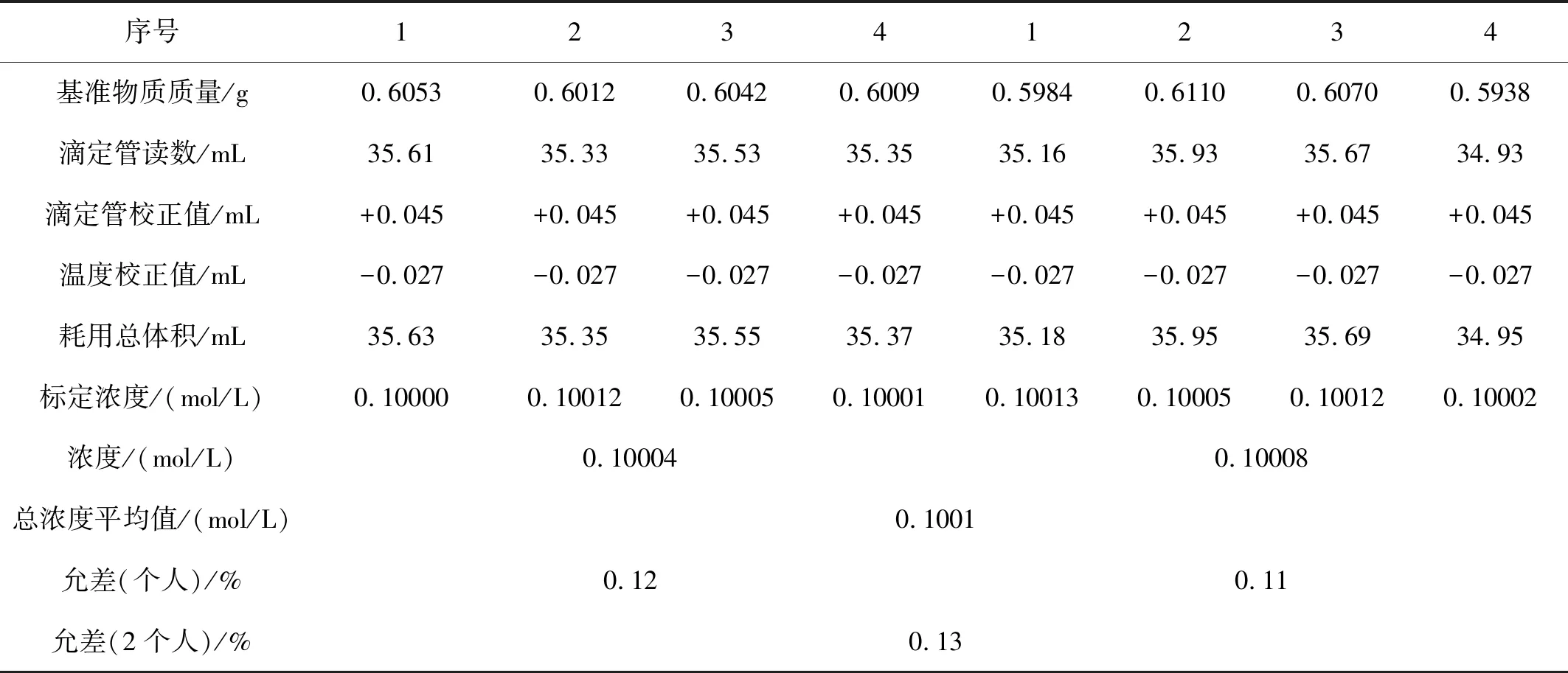
表1 按照GB/T601-2016手动滴定的结果
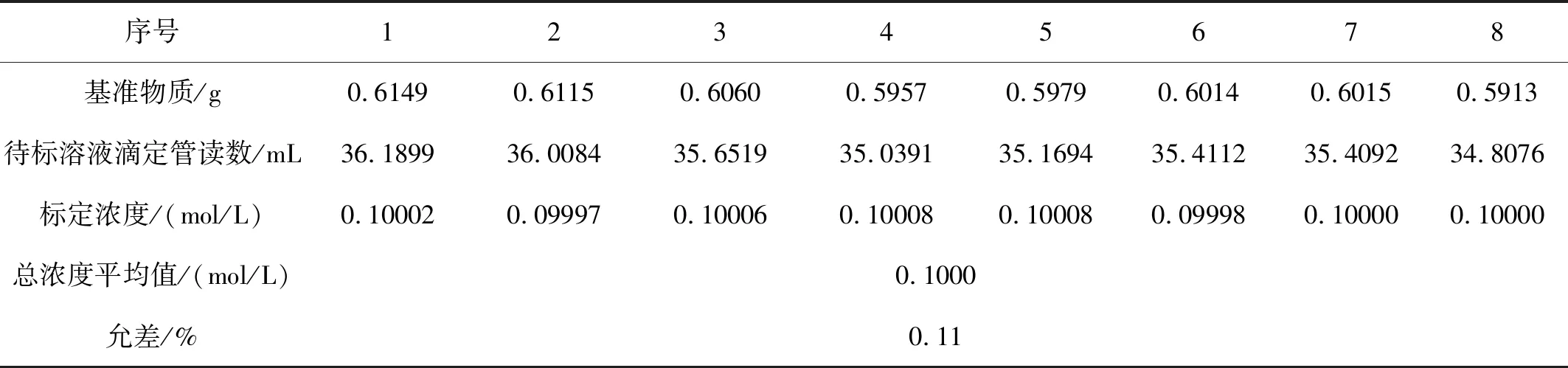
表2 采用916Ti-Touch自动滴定仪滴定的结果
滴定管合格证编号YJY-DG-0731;温度计检定合格证编号YJY-200708;两人允差≤0.18%;标定溶液的温度:t=23.7 ℃
标定溶液的温度:t=23.5 ℃
表1数据是按照GB/T601—2016操作规程以216型银电极做指示电极,217型双盐桥饱和和甘汞电极作参比电极,对批号为20B-141的硫氰酸钠标准溶液进行手动滴定的结果。其中,个人误差分别为0.12%和0.11%,两人误差为0.13%,满足标准规定误差值,结果可取。但是此方法标定耗时将近 6 h,在标定过程中产生大量的AgSCN沉淀容易吸附在电极上面,造成电位值稳定时间过长,并且对结果稳定性也会造成影响。
从表1、2中看出,表1中浓度最大值与表2中浓度最小值允差为0.16%,在允差范围内,说明用自动滴定仪的方法标定结果可取。同时,从表2中看出,自动滴定仪滴定的允许误差小于手动滴定结果的允许误差,其相对标准偏差为0.041%,准确性和精密度也高于手动滴定的结果。此滴定方法由于采用自动搅拌的模式,搅拌力度大于人工手摇的力度,能够使包裹的沉淀在溶液中快速分散开来,电极的指示能够快速识别,电位值稳定时间缩短,滴定8平行的时间仅为 1 h,远远小于手动滴定的滴定时间,节约了更多时间,提高了效率。在此滴定过程中,自动滴定仪克服了传统的滴定法滴定终点不稳定的缺点,仪器自动计算得出结果,省去了繁琐的计算过程,节省时间,提高工作效率。
2.3.2 滴定温度对滴定结果的影响
在常规滴定操作中,需要考虑温度对标准溶液的影响,即:在滴定过程中要不停地用温度计来测量标准溶液的温度,带入计算温度不同而产生的体积校正值[3],由于常规滴定时间过长,每组标定时溶液温度因环境变化而相差1~2 ℃。而采用自动滴定仪滴定,需要把标准溶液加入到 1 L 的试剂瓶中,密封状态下滴定,因此,标液的温度受环境影响变化较小,温度不同所带来的体积影响较小,可以忽略不记,所以从温度方面考虑,也可以采用自动滴定的方式进行标定。
3 结论
与传统的滴定方法相比,自动滴定仪的标定方法,能够实现标准溶液浓度的标定以及滴定结果计算自动化的全过程[4],减小了人工标定过程中由人员因素产生的滴定终点和滴定管读数等引起的误差,滴定结果的准确性和精密度也高于常规的滴定方法。采用仪器滴定的优点操作简单、用时少、且仪器易于维护[5-6],可以一个人快速完成标定工作。根据本实验室对多批硫氰酸钠标准的标定数据可以得出,自动电位滴定仪可以应用于此准液的标定,在以后的工作中可以考虑推广到标液室使用,既方便快捷,又提高工作效率。
