IgA肾病患者肾小球系膜组织P21、P27、PCNA表达与肾病预后不良的关系分析
2024-04-09廖敏宋勇波魏卓刘小兵程魁范哲奇双松涛祝存海
廖敏 宋勇波 魏卓 刘小兵 程魁 范哲奇 双松涛 祝存海
(孝感市中心医院泌尿外科,武汉科技大学附属孝感医院,孝感 432100)
免疫球蛋白A(immunoglobulin A,IgA)肾病是以肾小球系膜区IgA沉积为特征的慢性肾病,发病率占原发性肾小球疾病的20%~45%[1]。IgA肾病呈慢性进展性,目前尚无特异性治疗方法,临床常根据患者临床表现和肾脏病变程度给予长疗程多药联合治疗,以修复肾脏损伤、抑制肾脏异常免疫反应从而延缓病情发展,但仍有部分患者最终进展为终末期肾病,威胁其生命健康[2]。因此,探讨影响IgA肾病患者预后不良的影响因素对预防该病进展、改善预后有重要意义。肾小球系膜细胞过度增殖、细胞外基质过度沉积是导致肾小球疾病进展的核心病理环节[3],而P21、P27是与细胞增殖密切相关的细胞周期调控因子,能抑制G1期和S期的细胞周期素与细胞周期激酶(cyclin dependent kinase,CDK)结合,抑制细胞增殖,增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)是脱氧核糖核酸(DNA)多聚酶的一种辅助蛋白,能够反映细胞增殖活性,既往研究发现P21、P27、PCNA在肾病中表达异常,参与了肾系膜细胞的增殖过程[4-5]。但以上指标在IgA肾病患者中的表达及其与肾脏预后不良的关系尚不明确。鉴于此,本研究采用免疫组化法检测IgA肾病患者肾小球系膜组织P21、P27、PCNA的表达,并探讨其与肾脏预后不良的关系,旨在为其临床治疗提供参考。
1 资料与方法
1.1 一般资料 纳入标准:均行肾穿刺活检,且病理结果证实为IgA肾病;年龄≥18岁;均对本研究知情并签署同意书。排除标准:乙肝病毒、过敏性紫癜、系统性红斑狼疮相关性肾炎等继发性IgA肾病;有肾移植史的患者;肾穿刺活检标本镜下肾小球数<8个;合并糖尿病肾病、膜性肾病、间质性肾炎等肾病患者;其他合并糖尿病、心脑血管疾病、血液系统疾病及恶性肿瘤患者。按纳入、排除标准选取2017年4月至2019年8月孝感市中心医院收治的145例IgA肾病患者作为研究对象,其中男83例,女62例;年龄21~60岁,平均(39.54±7.78)岁;病理表现:系膜细胞增生74例、毛细血管内皮细胞增生7例、节段性肾小球硬化86例、肾小管萎缩29例、新月体54例。
1.2 方法
1.2.1 治疗与随访 依据《原发性IgA肾病诊治循证指南(2016)》[6],针对患者病情和肾脏病变程度进行治疗,合并持续性肉眼血尿(持续2~4周及以上)患者给予甲泼尼龙冲击治疗,15~30 mg/(kg·d),3~5 d为1个疗程,治疗1~2个疗程;合并蛋白尿患者结合肾脏病理结果给予血管紧张素转化酶抑制剂(ace inhibitors,ACEI)、血管紧张素受体拮抗剂(angiotensin-receptor blockade,ARB)、免疫抑制剂治疗;新月体形成患者给予激素联合环磷酰胺治疗6个月,前3~5 d给予甲泼尼龙15~30 mg/(kg·d)冲击治疗,后续口服泼尼松15~30 mg/(kg·d),同时环磷酰胺每月0.5 g/m2冲击治疗;另针对合并高血压、高血脂、凝血异常等患者给予降压(当肾功能正常或轻微受损时给予ACEI/ARB降压,当肾功能受损严重、Scr>440 μmol/L时给予钙拮抗剂降压)、调脂、抗凝等治疗。
以病理确诊日期为随访起点,所有患者均随访24个月,将肾小球滤过率(estimated glomerular filtration rate,eGFR)较基线值下降超过50%或进展至终末期[eGFR<15 ml/min·(1.73 m2)]的患者归为预后不良组,其余患者归为预后良好组,其中eGFR=186×Scr-1.154×年龄-0.203×(0.742女性)。
1.2.2 临床指标检测 收集所有患者年龄、性别、病理表现、血压及24 h尿蛋白、血肌酐(serum creatinine,Scr)、白蛋白(albumin,ALB)、尿酸(uric acid,UA)、胆固醇(TC)、三酰甘油(triacylglycerol,TG)等实验室指标,所有临床指标均为肾活检前最后一次晨起空腹检测结果。
1.2.3 肾小球阳性和阴性细胞检测 收集所有患者肾穿刺活检组织,采用甲醛-醋酸-乙醇固定液固定,经脱水、透明、石蜡包埋制成石蜡切片。切片经烘烤、脱蜡水化后用3%过氧化氢(H2O2)室温孵育10 min灭活H2O2酶活性。磷酸盐缓冲液(PBS)清洗3次,P21、P27组织切片微波进行抗原修复(PCNA无须进行);滴加牛血清蛋白进行封闭,室温孵育20 min后用PBS清洗;滴加适当比例稀释的一抗试剂,室温孵育1 h,PBS清洗3次;滴加二抗,室温孵育10 min,PBS清洗3次;再滴加链亲和素-过氧化物酶复合物,室温孵育10 min,PBS清洗3次后用二氨基联苯胺显色,待显色后用苏木素复染,冲洗后用盐酸乙醇分色,脱水透明后封片。结果判读:在高倍镜(×200倍)下阅片,核显示黄色或棕褐色为阳性,蓝色为阴性,计数每个肾小球阳性和阴性细胞,阳性率(%)=阳性核数/(阴性核数+阳性核数)×100%,取所有肾小球的平均值作为该切片的表达指标。
1.3 统计学分析 采用SPSS25.0软件分析数据,计量资料若符合正态分布以±s描述,采用t检验;计量资料若不符合正态分布则采用M(Q1,Q3)描述,采用Mann-Whitney U检验;计数资料以“%”描述,采用χ2检验;并采用Logistic多元回归分析IgA肾病患者预后不良的影响因素。P<0.05表示差异有统计学意义。
2 结果
2.1 IgA肾病患者肾小球系膜组织P21、P27、PCNA的表达 IgA肾病患者肾小球系膜组织P21、P27、PCNA阳性细胞表达率分别为(38.69±6.83)%、(55.94±8.08)%、(33.47±5.72)%,见图1。
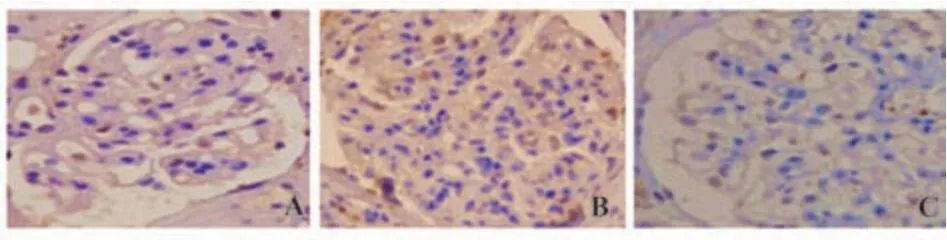
图1 IgA肾病患者肾小球系膜组织P21、P27、PCNA表达Fig.1 Expressions of P21, P27 and PCNA in glomerular mesangial tissue of patients with IgA nephropathy
2.2 IgA肾病患者预后不良情况及不同预后患者肾小球系膜组织P21、P27、PCNA的表达 随访结束时,145例IgA患者中预后不良者25例,预后良好者120例,预后不良发生率为17.24%(25/145)。预后不良组肾小球系膜组织P21、PCNA阳性细胞表达率均高于预后良好组(P<0.05),P27阳性细胞表达率低于预后良好组(P<0.05),见表1、图2。
表1 不同预后患者肾小球系膜组织P21、P27、PCNA的表达(±s,%)Tab.1 Expressions of P21, P27 and PCNA in glomerular mesangial tissue of patients with different prognosis (±s,%)
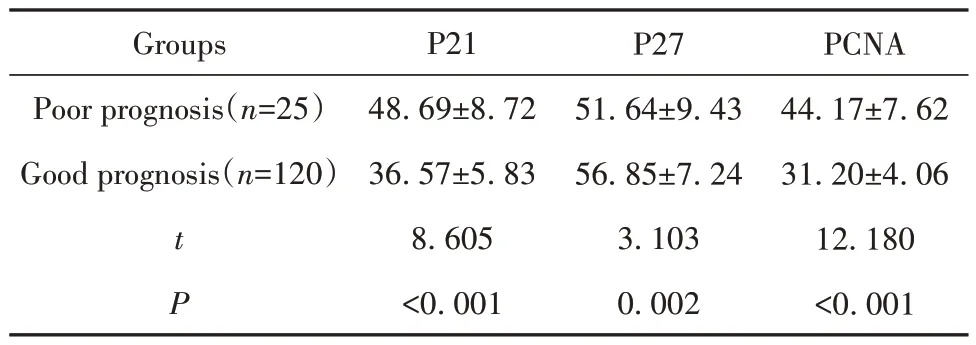
表1 不同预后患者肾小球系膜组织P21、P27、PCNA的表达(±s,%)Tab.1 Expressions of P21, P27 and PCNA in glomerular mesangial tissue of patients with different prognosis (±s,%)
Groups Poor prognosis(n=25)Good prognosis(n=120)t P P21 48.69±8.72 36.57±5.83 8.605<0.001 P27 51.64±9.43 56.85±7.24 3.103 0.002 PCNA 44.17±7.62 31.20±4.06 12.180<0.001

图2 肾小球系膜组织P21、P27、PCNA表达Fig.2 Expression of P21, P27 and PCNA in glomerular mesangial tissue
2.3 IgA肾病不同预后患者一般资料比较 预后不良组舒张压、24 h蛋白尿、节段性肾小球硬化占比、肾小管萎缩/间质纤维化占比、新月体占比均高于预后良好组(P<0.05),见表2。
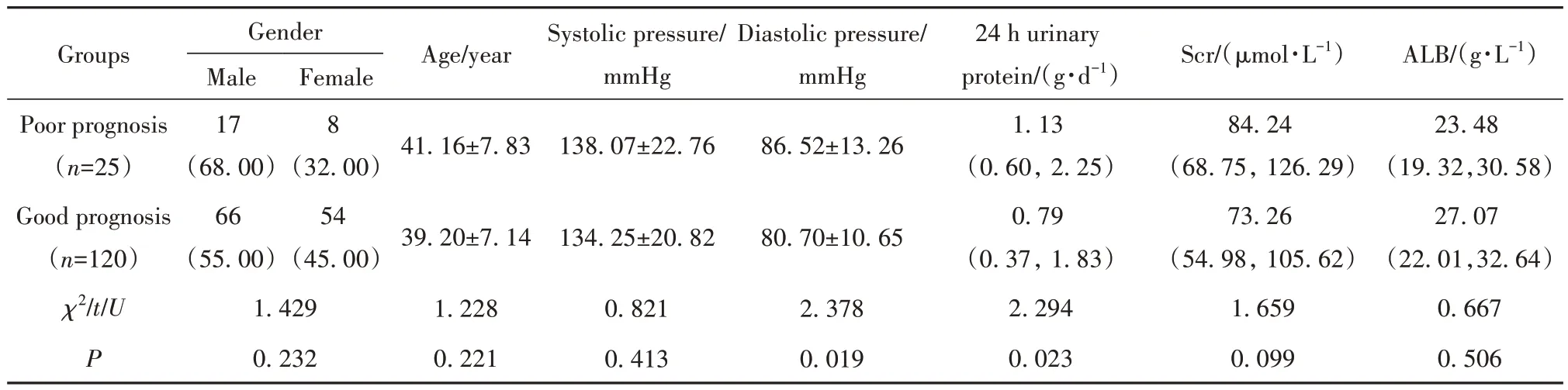
表2 IgA肾病不同预后患者一般资料比较Tab.2 Comparison of prognosis of patients with IgA nephropathy
2.4 IgA肾病患者预后不良的影响因素 经Logistic多元回归分析,舒张压升高、24 h蛋白尿增多、系膜细胞增生、节段性肾小球硬化、肾小管萎缩/间质纤维化、新月体与P21、PCNA阳性表达率升高、P27阳性细胞表达率降低均是影响IgA肾病患者预后不良的危险因素(P<0.05),见表3。

表3 Logistic多元回归分析Tab.3 Logistic multiple regression analysis
3 讨论
IgA肾病发病机制尚未完全明确,近年来研究发现IgA1对肾小球系膜细胞具有亲和力,能够特异性结合诱导细胞增殖,引发肾小球炎症反应进而损伤肾小球[7]。有研究显示约1/3的IgA肾病患者肾损伤呈进行性加重,最终导致预后不良[8]。本研究145例IgA肾病患者仅随访24个月预后不良发生率高达17.24%,证实了IgA肾病预后不良的高风险,故亟须探讨影响IgA肾病预后不良的因素以指导临床干预,改善预后。
本研究结果显示,IgA肾病患者肾小球系膜组织P21、P27、PCNA阳性细胞表达率分别为(38.69±6.83)%、(55.94±8.08)%、(33.47±5.72)%,提示P21、P27、PCNA可能在IgA肾病的发生发展中发挥一定作用。IgA肾病以IgA免疫复合物沉积于系膜区,诱发肾小球系膜细胞增生及系膜基质堆积为主要特征,肾小球系膜的增生与系膜细胞过度增殖有关,而细胞增殖必须经历完整的细胞周期,受细胞周期调控因子的调控[9]。PCNA是在细胞增殖中呈阶段性表达的一种蛋白,与DNA聚合酶结合引导DNA复制,可有效反映细胞的增殖活性,既往研究报道IgA肾病小鼠PCNA水平相较健康对照组升高,且此类小鼠系膜细胞增殖增强,提示PCNA可能与肾系膜细胞增殖关系密切[10]。P21、P27是细胞周期蛋白依赖性激酶抑制剂(cyclin dependent kinase inhibitor,CKI)家族中的成员,能够抑制多数细胞周期素和CDK复合物,使细胞不能通过G1期到S期之间的检验点,停滞在G1期;另外,P21可与PCNA结合抑制DNA复制,进而抑制细胞增殖[11-12]。正常情况下P21处于低表达水平,P27处于高表达水平来抑制细胞增殖,而在肾小球系膜组织中P21表达上调、P27表达下调则提示抑制肾系膜细胞增殖能力减弱,进而参与IgA肾病的发生。此外,本研究结果显示IgA肾病预后不良组肾小球系膜组织P21、PCNA阳性细胞表达率均高于预后良好组,P27阳性细胞表达率低于预后良好组,经多因素分析显示其均是IgA肾病预后不良的危险因素。肾小球系膜细胞增殖是IgA肾病的重要病理机制,也是病情进展的重要原因。PCNA是细胞增殖活性的指标,而P27是抑制细胞增殖的因子,PCNA表达增加,P27表达减少说明肾小球系膜细胞增殖增多,促进IgA肾病进展。P21可与CDK复合物结合抑制细胞增殖,但P21参与足细胞的损伤,当足细胞在增殖表型状态下P21可从复合物中分离,变为游离状态[13],因此在肾小球硬化过程中随着足细胞增生,P21同样作为抑制细胞增殖的因子表达增加。另外焦素敏等[14]发现P21表达水平与肾小球硬化呈正相关,进一步证实了P21表达增加与IgA肾病进展相关,是导致其预后不良的危险因素。且目前已有动物实验通过在肾炎小鼠中调控P21、P27的表达来抑制细胞增殖来干预肾病进展,改善预后[15]。本研究结果还显示,舒张压升高、24 h蛋白尿增多、系膜细胞增生、节段性肾小球硬化、肾小管萎缩/间质纤维化、新月体均是影响IgA肾病预后不良的危险因素,与既往研究报道一致[16-18]。
综上,P21、P27、PCNA在IgA肾病肾小球系膜组织中均存在阳性细胞表达,预后不良患者P21、PCNA阳性细胞表达率高于预后良好者,P27阳性细胞表达率低于预后良好者,且均是IgA肾病患者预后不良的危险因素。
