基于IL-6/JAK2/STAT3信号通路探讨灰树花提取物对溃疡性结肠炎大鼠结肠组织炎症反应的影响
2024-04-09金雪马贤德赵卓徐铭王建光杜晗关洪全韩晓伟辽宁中医药大学沈阳110847
金雪 马贤德 赵卓 徐铭 王建光 杜晗 关洪全 韩晓伟 (辽宁中医药大学,沈阳 110847)
溃疡性结肠炎(ulcerative colitis,UC)是一种好发于结肠的自身免疫性疾病,其特点为反复发作的黏膜粘连性炎症[1]。我国UC的患病率已高达11.6/100 000,若UC患者不能得到及时有效的治疗,其患结、直肠癌的风险将大大增加,严重威胁患者生命健康[2-3]。目前普遍认为UC的致病因素与自身免疫系统异常、炎症相关因子高表达以及肠道微生物群间的平衡紊乱等有关。西医治疗UC的常用药物有柳氮磺吡啶、氨基水杨酸盐类药物、免疫调节剂等。尽管上述药物被国际社会所普遍认可,但这些药物对机体产生的副作用与不良反应通常较大。调查显示,几乎50%UC患者都经历过皮质类固醇相关的不良事件,如痤疮、失眠、情绪障碍、葡萄糖不耐受和消化不良等,长期用药也会提高UC患者罹患慢性疾病或造成肝毒性的风险[4]。有限的临床治疗效果与多发的副作用及不良反应正促使人们努力开发新的治疗手段与药物。
灰树花(Grifola frondosa)属真菌科,为一种药食两用菌,作为中药材的一种,灰树花性平味甘,具有很好的补脾生肌、扶正祛邪之功效,可有效治疗临床以正气不足、脾阳虚衰、外邪入侵等为主要病机的疾病,且其具有明显的改善机体免疫功能、抑制肿瘤生长等作用[5-7]。灰树花中所含的天然化合物还可消除全身炎症反应[8],同西药相比,灰树花药性具有更加温和、无毒副作用,可从改善患者自身免疫力这一根本方向入手达到治疗目的,这些为临床使用灰树花治疗UC提供了依据与可能。白细胞介素6(interleukin-6,IL-6)/蛋白酪氨酸激酶2(Janus kinase 2,JAK2)/信号转导和激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路是参与体内炎症反应的重要通路,且对机体免疫调节发挥关键作用[9-10]。近年有研究表明,IL-6/JAK2/STAT3通路相关因子在UC患者体内表达明显上调,证实此通路与UC发病存在密切联系[11]。但目前鲜有文献报道灰树花提取物对UC大鼠炎症反应影响的具体作用机制,本研究以IL-6/JAK2/STAT3信号通路为切入点,探究灰树花提取物治疗UC的分子机制,旨在为临床治疗UC提供可靠的理论和实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8周龄雄性SPF级SD大鼠共40只,体质量200~240 g,购于辽宁长生生物技术股份有限公司,动物合格证号:SCXK(辽)2020-0001,本研究经辽宁中医药大学实验动物伦理委员会审查批准,伦理审查编号:21000042022086。动物饲养条件:温度20~25 ℃,相对湿度50%~60%。
1.1.2 实验试剂与仪器 灰树花提取物(浙江方格药业有限公司);柳氮磺吡啶(上海信谊天平药业有限公司,批号:09220802);葡聚糖酸钠盐(DSS)(美仑云细胞生物科技有限公司,批号:O1031C);HE染色试剂盒(碧云天生物科技有限公司,批号:C0105S);IL-6抗体、JAK2抗体(碧云天生物科技有限公司,批号:AF7236、AF1489);STAT3抗体、p-STAT3抗体(艾博抗贸易有限公司,批号:ab30647、ab267373);IL-6R、MPO抗体(武汉赛维尔生物科技有限公司,批号:GB11117-100、GB111237-100);ELISA试剂盒(安迪华泰生物科技有限公司,批号:AD202304)。RM2016型病理切片机(上海徕卡仪器有限公司);KD-P型组织摊片机(浙江省金华市科迪仪器设备有限公司);MV-100型涡旋混匀仪(武汉赛维尔生物科技有限公司);Power Pac 1645050型电泳仪(美国Bio-Rad公司);1704150型转膜仪(美国Bio-Rad公司);Tanon-5200型显影仪(上海天能科技有限公司)。
1.2 方法
1.2.1 动物分组 将40只大鼠随机分为5组,即空白对照组、UC模型组、灰树花治疗组、西药治疗组、联合治疗组,每组8只。
1.2.2 造模方法 采用3%DSS水溶液自由饮用法建立UC大鼠模型[12]。将DSS溶于蒸馏水,配制成3%DSS水溶液,实验第1天开始,除空白对照组外,其余4组大鼠每日均给予足量的3%DSS水溶液自由饮用,连续7 d。空白对照组大鼠给予等量纯净水自由饮用。造模期间持续观察并记录各组大鼠一般状态及体质量、粪便性状等变化情况。造模结束后,使用粪便隐血试剂盒分别检测各组大鼠便隐血情况。若大鼠出现精神萎靡、体质量降低、黏液脓
血便等表现,且便隐血试验呈阳性,则每组随机取1只大鼠处死,观察结肠组织病理改变,如有糜烂、溃疡、炎症细胞浸润等病理学变化,表明造模成功。
1.2.3 给药方法 实验第8天(造模成功后)起,依据人与大鼠等效给药剂量比值计算大鼠灌胃剂量[13],灰树花治疗组给予灰树花提取物10 mg/(kg·d),西药治疗组给予柳氮磺吡啶0.3 g/(kg·d),联合治疗组同时给予灰树花提取物10 mg/(kg·d)和柳氮磺吡啶0.3 g/(kg·d),连续14 d。空白对照组和UC模型组灌胃等量生理盐水。
1.2.4 取材方法 药物治疗14 d后所有大鼠禁食24 h,实验第22天,使用1%戊巴比妥麻醉大鼠,取腹主动脉血,3 500 r/min 离心15 min,收集上清;处死大鼠后,取结肠组织分别置于液氮及4%多聚甲醛溶液中固定。
1.2.5 大鼠一般状态及疾病活动指数(DAI)评分 实验第1天开始,每日观察并记录各组大鼠的一般状态,隔日测量并记录大鼠体质量、粪便性状及便潜血情况,实验结束后统计各组大鼠DAI,具体评分标准见表1。

表1 DAI评分标准Tab.1 DAI scoring criteria
1.2.6 HE染色观察大鼠结肠组织病理改变 将大鼠结肠组织依次梯度脱水、包埋、切片,进行HE染色,光学显微镜下观察染色后各组大鼠的结肠形态,每个样本高倍镜下随机选取5个视野。
1.2.7 Western blot检测大鼠结肠组织IL-6、JAK2、STAT3、p-STAT3蛋白表达水平 每个样本取100 mg结肠组织研磨、裂解、离心后取上清,使用BCA蛋白定量试剂盒检测蛋白浓度,加入5×Buffer后煮沸使其变性。依次制备分离胶、浓缩胶,每组以70 μg/ml上样量加入样本,将电压调至80 V与120 V分别进行电泳,而后采用湿转法,70 V/70 min条件将蛋白转印至PVDF膜,放入含5%BSA的封闭液中封闭70 min,TBST洗涤5 min后孵育一抗过夜,TBST洗涤10 min×3次后孵育二抗2 h,TBST洗涤5 min×6次,使用biosharp发光液化学发光后采集图像,分析灰度值。
1.2.8 ELISA法检测大鼠血清中IL-6含量 按照ELISA检测试剂盒说明书操作,在96孔板中完成标准品的配制、加样、洗涤等,最后加入显色液,置于酶标仪中,对各孔的吸光度值进行测定,根据得到的标准曲线计算各组大鼠血清中IL-6含量。
1.2.9 免疫组化法测定大鼠结肠组织IL-6R、MPO含量 随机选取各组大鼠结肠组织进行浸蜡包埋、切片、脱蜡、抗原修复、封闭,滴加一抗孵育过夜,滴加二抗孵育过夜,复染后封片、图像采集,高倍镜下随机选取3个视野,使用Image J计算分析阳性面积比例。
1.3 统计学处理 采用Prism 8.0软件进行数据统计分析,计量资料以±s表示,多组间比较采用方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠一般状态观察及DAI评分 实验期间,空白对照组大鼠精神状态佳,毛色柔顺有光泽,食欲良好,体质量稳步增加,大便规律且性状无异常。使用3%DSS水溶液造模7 d后,除空白对照组外,其余4组大鼠均出现不同程度的活动度下降,毛色光泽度变差,饮食摄入减少,大便次数增多,粪便不成形甚至肉眼血便表现,DAI评分显著升高,差异有统计学意义(P<0.01)。药物治疗7 d后,与UC模型组比较,灰树花治疗组、西药治疗组与联合治疗组大鼠一般状态有明显改善,食欲有所提升,大便逐渐规律且成形,DAI评分明显降低,差异有统计学意义(P<0.01)。连续给药14 d后,各治疗组大鼠体质量显著增加,DAI评分降低更为明显,而UC模型组大鼠DAI评分虽有所下降,但仍有较为明显的精神状态不佳、排便次数多、便溏等表现,大便不成形未见好转,便隐血呈阳性。与UC模型组比较,其他3个治疗组大鼠DAI评分均显著下降(P<0.01),尤以联合治疗组降低最为明显,且与灰树花治疗组和西药治疗组比较差异有统计学意义(P<0.05),见图1。

图1 大鼠DAI评分情况Fig.1 DAI score of rats
2.2 大鼠结肠组织病理改变 结果显示,空白对照组大鼠结肠黏膜结构完整,腺体排列整齐,无明显异常;与空白对照组比较,UC模型组大鼠可见结肠组织黏膜缺损或脱落,腺体排列紊乱,炎症细胞浸润明显,黏膜基层增厚;与UC模型组比较,灰树花治疗组、西药治疗组与联合治疗组大鼠结肠黏膜病变均有减轻,黏膜缺损有不同程度改善,腺体排列趋向规则,但部分仍可见炎症细胞浸润,见图2。

图2 大鼠结肠组织病理改变(HE,×200)Fig.2 Histological changes of rats colon (HE,×200)
2.3 大鼠结肠组织IL-6、JAK2、STAT3、p-STAT3蛋白表达水平 与空白对照组比较,UC模型组大鼠结肠组织IL-6、JAK2、STAT3、p-STAT3蛋白表达显著升高(P<0.01);与UC模型组比较,灰树花治疗组、西药治疗组、联合治疗组大鼠结肠组织IL-6、JAK2、STAT3、p-STAT3蛋白表达水平显著降低(P<0.01),但各治疗组间上述蛋白表达水平差异无统计学意义,见图3。

图3 大鼠结肠组织IL-6、JAK2、STAT3、p-STAT3蛋白表达水平Fig.3 Expression levels of IL-6, JAK2, STAT3 and p-STAT3 proteins in rats colon tissue
2.4 大鼠结肠组织IL-6R、MPO含量 与空白对照组比较,UC模型组大鼠结肠组织中IL-6R、MPO含量均显著增高(P<0.01);与UC模型组比较,各治疗组大鼠结肠组织中IL-6R含量均显著降低(P<0.01),MPO含量也明显降低,其中灰树花治疗组和西药治疗组(P<0.05),联合治疗组(P<0.01),见图4。

图4 大鼠结肠组织IL-6R、MPO表达情况(免疫组化,DAB染色,×400)Fig.4 Expressions of IL-6R and MPO in colon tissue of rats (immunohistochemistry,DAB staining,×400)
2.5 大鼠血清中IL-6含量 与空白对照组比较,UC模型组大鼠血清中IL-6含量显著升高(P<0.01);与UC模型组比较,灰树花治疗组、西药治疗组大鼠血清中IL-6含量明显减少(P<0.05),联合治疗组大鼠血清中IL-6含量显著减少,差异有统计学意义(P<0.01),见图5。
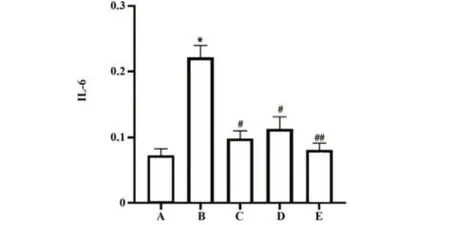
图5 大鼠血清IL-6含量Fig.5 IL-6 content in rats serum
3 讨论
近几十年来,新兴工业化国家UC的发病率迅速上升,由其诱发的炎症相关结肠癌较其他类型的结肠癌预后更差,病死率更高[14-15]。目前西医治疗UC的主要手段都存在一定的局限性,如根治困难、长期使用后极易出现不良反应、耐药性升高等,因此,研制和开发治疗UC的新药迫在眉睫。
在中医学中,UC属“大瘕泻”“痢疾”“肠澼”等范畴。在隋代巢元方所著《诸病源候论》中就曾有论述:“凡痢皆由荣卫不足,肠胃虚弱,冷热之气乘虚入客于肠间,肠虚则泄,故为痢也”。UC的中医病机极为复杂,先天不足或后天失养导致脾肾虚弱是主要病因之一,由于脾气不能散布精气于全身,肾气不能温煦、蒸化、制约阴寒,体内正气不足,进而寒从中生,肠道运化能力失司,病情迁延不愈[16-18]。因此,在治疗UC时,首先应考虑补益脾气,兼以辨证施治,如此才能在最大程度上缓解UC病情。灰树花又名栗子蘑、千佛菌,其性平味甘,具有健脾益气、扶正补虚之功效,可从根本改善患者体质,补益正气、驱邪外出,很大程度上解决了目前西药在治疗UC方面所面临的难题。据文献报道,干灰树花子实体中含蛋白质31.5%、碳水化合物49.69%、粗纤维10.7%,营养元素远超其他食用菌,居首位[5]。由于灰树花子实体中含有大量的天门冬氨酸与谷氨酸,有“食用菌之王”“华北人参”的美誉,其含有的多糖、肽类等具有很好的抗肿瘤、抑制炎症感染、改善免疫功能的作用,含有的多酚具有明显的抗氧化功效,可起到一定的治疗和缓解作用[7-8,19]。也有实验证实灰树花具有一定的免疫调节及抗炎活性,能够显著增强动物脾淋巴细胞的增殖能力,灰树花中的吡喃糖环及α型和β型糖苷键还可有效抗击肿瘤[20-22]。本研究结果显示,与空白对照组比较,UC模型组大鼠一般状态欠佳,大便次数增多,粪便不成形,甚至肉眼可见血便表现,DAI评分显著升高,且结肠组织可见黏膜缺损与炎症细胞浸润,MPO活性也显著升高,说明UC大鼠模型制备成功。与UC模型组比较,各治疗组大鼠的一般状态有所改善,DAI评分均有不同程度的降低,且结肠黏膜损伤减轻,尤以联合治疗组下降最为明显。说明灰树花提取物可在一定程度上有效改善DSS诱导的UC大鼠结肠炎症反应。
IL-6是一种典型的促炎细胞因子,主要由巨噬细胞及T细胞产生,多数在炎症反应的急性期分泌,可将其视作炎症反应发生发展过程的主要标志物之一。在既往的实验及临床观察中发现,UC患者的血清检测和组织活检中IL-6含量均大幅增加。JAK2是一类重要的酪氨酸蛋白激酶,在UC的炎性级联式反应中发挥重要的传导和衔接作用。STAT3是信号传导通路家族的重要成员之一,与细胞增殖分化和凋亡密切相关,其在人体免疫反应、炎症反应等病理过程中发挥重要调控作用。在IL-6/JAK2/STAT3通路中,大量IL-6首先与靶细胞表面IL-6受体(sIL-6R)识别并结合,形成sIL-6R/IL-6复合物,进而活化细胞膜表面gp130,然后激活JAK2,使受体酪氨酸激酶活化,并与STAT3蛋白结合,使STAT3磷酸化激活下游转录因子,调控炎症细胞因子表达,从而介导炎症反应发生。本研究结果显示,与空白对照组比较,UC模型组大鼠结肠组织IL-6、IL-6R、JAK2、STAT3、p-STAT3蛋白表达均显著升高,经药物治疗后上述蛋白含量明显降低,其中联合治疗组IL-6、STAT3、p-STAT3蛋白含量下降最为明显,提示灰树花提取物与西药联合治疗效果优于单一西药治疗作用。此外,本研究结果还显示灰树花提取物可降低UC大鼠血清中IL-6含量,且与西药联合应用后,效果明显优于西药治疗组。
综上所述,灰树花提取物调控IL-6/JAK2/STAT3信号通路相关因子表达,可能是改善UC大鼠结肠炎症反应的重要机制之一。本研究结果提示灰树花提取物在改善UC炎症方面具有一定优势,协同西药治疗后优于单独应用西药治疗效果。可考虑在临床治疗UC疾病时协同或交替用药,降低西药的不良反应。因UC病机复杂,病情又多随病程转变,用药治疗机制还待进一步探索,课题组后续也将深入探讨影响UC病程进展的其他可能机制。
