氧化应激在脊髓损伤中的作用及机制研究进展
2024-04-08马春伟张海鸿
马春伟,张海鸿
1. 兰州大学第二医院骨科(兰州 730030)
2. 兰州大学第二临床医学院(兰州 730030)
脊髓损伤(spinal cord injury, SCI)是中枢神经系统(central nervous system, CNS)的一种严重创伤性疾病,可导致受伤平面以下感觉、运动和括约肌功能障碍,进而引发截瘫、排尿和排便功能障碍等临床表现[1]。全球每年约25~50 万人受SCI 的影响,导致200~300 万人致残[2],给社会和患者带来巨大负担。SCI 是一种具有破坏性的神经病理状态,其病理生理学包括急性和慢性阶段,并涉及缺血、氧化应激、炎症、细胞凋亡和运动功能障碍等一系列破坏性事件[3]。氧化应激是指活性氧(reactive oxygen, ROS)产生与机体抗氧化防御之间平衡失调的状态[4]。作为SCI 重要的损伤标志和病理过程,减轻氧化应激有助于改善SCI 后的症状和功能恢复。本文综述了SCI 后氧化应激的作用及其相关机制,旨在为SCI 的治疗提供新的思路。
1 脊髓损伤后氧化应激的发生机制
SCI 的病理过程分为原发性和继发性损伤。原发性损伤是由外力直接造成的脊髓组织和细胞破坏[3]。继发性损伤是原发性损伤引发的级联反应,进一步导致脊髓组织损害和大量ROS 的产生[5]。ROS 既包括自由基,如超氧化物和羟基,也包括非自由基,如过氧化氢(H2O2)和单线态氧[4]。正常情况下,细胞会产生适量ROS,以维持平衡并修复损伤[6]。但在SCI 中,ROS 的过量生成打破了这一平衡,引发氧化应激[7]。SCI 后谷氨酸水平上升,导致钙离子流入细胞并引发钙超载,激活线粒体内的NADPH 氧化酶(reduced nicotinamide adenine dinucleotide phosphate oxidase,Nox),产生更多ROS 和活性氮(reactive nitrogen species, RNS)[8],加剧线粒体功能障碍和氧化应激。ROS 的其他来源包括细胞内的过氧化物体、溶酶体、内质网和氧化酶[9-10]。SCI 引起的过量ROS 和RNS 对细胞DNA、脂质、蛋白质造成损害,引发细胞损伤和死亡,加剧了SCI 的严重性[2]。
2 脊髓损伤后氧化应激对神经元及胶质细胞的影响
2.1 活性氧促进细胞凋亡
细胞凋亡,作为一种常见的程序性细胞死亡方式,是SCI 后继发性损伤的主要病理特征,并对SCI 的进展和恢复具有关键影响[11]。在SCI 中,过量的ROS 导致神经元凋亡,因此控制ROS 水平对神经元保护极为重要[12]。Liu 等[13]研究发现,在SCI 模型大鼠中,伊马替尼激活Nrf2/HO-1 通路,有效减轻了氧化应激、细胞凋亡和炎症。同样,Rao 等[14]研究显示,通过减少ROS 生成,可以减轻PC12 细胞的凋亡和细胞周期停滞,增强存活率。因此,控制ROS 产生以减少神经元和胶质细胞的凋亡成为SCI 治疗的重要研究方向。
2.2 抑制活性氧可减轻炎症
炎症是身体对SCI 的自然响应,目的是清除坏死的组织和细胞。然而,炎症标志物的增加会形成有毒的微环境,导致脊髓组织的细胞凋亡、空腔形成和神经胶质疤痕,加剧SCI 并妨碍神经功能的恢复。氧化应激在促进炎症中扮演重要角色[15]。Liu 等[16]发现,晚期氧化蛋白产物(advanced oxidation protein products,AOPP)通过激活Nox,使BV2 细胞产生过量的ROS,并通过Nox4-ROSMAPK-NF-κB 信号通路诱导炎症。降低ROS 水平能有效抑制SCI 炎症[17]。Li 等[18]研究表明,锌可减轻小鼠SCI 后的ROS 生成和氧化应激,抑制NLRP3 炎症小体的活化。因此,有效控制ROS 的产生和清除对于减轻SCI 后的炎症和促进功能恢复具有重要意义。
2.3 活性氧与铁死亡
铁死亡作为一种新近发现的细胞死亡方式,与细胞凋亡、自噬、坏死等有所不同。铁死亡是由铁依赖的脂质过氧化引起,其特征包括线粒体体积缩小、膜密度增加、嵴减少或消失,以及膜外壁破裂等[19-20]。Ge 等[21]研究表明,在小鼠SCI 模型中,NRF2 / HO-1 和GPX4 通路能降低丙二醛(MDA)、ROS 和脂质过氧化物水平,减轻神经元铁死亡和脊髓损伤。另一项研究发现,血红素处理可诱导神经元铁死亡,而生长分化因子15(growth differentiation factor15, GDF15)减少氧化应激后可降低此类死亡[22]。因此,在SCI治疗中,控制ROS 的过量产生和脂质过氧化是关键,这有可能成为未来促进神经功能恢复的新靶点。
2.4 活性氧参与轴突变性
SCI 发生后,原发性机械损伤及继发性病理反应会导致神经轴突损坏和神经功能受损。氧化应激作为神经退行性途径的一个诱导因素,会引起神经元死亡和神经轴突变性[23]。小胶质细胞和巨噬细胞等反应性细胞上调Nox 等,产生ROS 和RNS,进而损伤轴突,加剧神经变性[15]。Wang等[24]研究发现,在SCI 大鼠模型和H2O2诱导的氧化应激小胶质细胞中,抑制小胶质细胞活化可减轻氧化应激,进而促进轴突再生和功能恢复。Zheng 等[25]利用H2O2处理神经元以模拟SCI 后的氧化应激环境,通过光生物调节(photobiomodulation, PBM)降低ROS 水平,促进神经元存活和轴突再生。然而,Hervera 等[26]的研究表明,适度的ROS 通过NOX2-PI3K-p-Akt信号通路促进背根神经节细胞(dorsal root ganglion,DRG)轴突再生,这与先前的研究结果相悖。表明适量的ROS 可能促进轴突再生,而过量的ROS 可能导致神经元凋亡和轴突变性。未来应进一步探索ROS 在轴突再生中的作用机制,并验证调节ROS水平是否有助于预防轴突变性和促进轴突再生。
2.5 其他方面
神经病理性疼痛(neuropathic pain, NP)作为SCI 的一种常见并发症,影响着多达60%的SCI 患者[27]。ROS 在NP 的发生中发挥关键作用,SCI 导致的过量ROS 会激活细胞内磷酸化钙调蛋白依赖性蛋白激酶II(P-CamKII),导致神经元过度兴奋和疼痛[28-29]。降低氧化应激有助于减轻SCI 后的超敏反应和痛觉异常[30]。因此,控制ROS 和脂质过氧化在SCI 治疗中对缓解NP 至关重要。
3 调控脊髓损伤氧化应激的相关通路
脊髓损伤后的氧化应激不仅加剧了神经组织的损害,而且影响了损伤后的恢复过程。大量研究证明,可以通过调控Nrf-2 等相关信号通路来有效缓解脊髓损伤后的氧化应激(图1)。
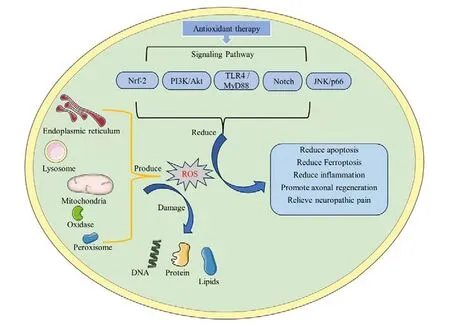
图1 相关信号通路在脊髓损伤后发挥抗氧化应激作用Figure1. Related signaling pathways play an anti-oxidative stress role after spinal cord injury
3.1 Nrf-2信号通路
核因子红细胞系2 相关因子2(Nrf-2)是一种关键转录因子,参与调控多种ROS 解毒酶。在氧化应激下,Nrf-2 从KEAP-1 中解离并迁移到细胞核,与抗氧化反应元件(ARE)结合,调控包括血红素加氧酶-1(HO-1)和醌氧化还原酶-1(NQO-1)在内的抗氧化基因和酶的表达,以消除ROS 并减轻氧化应激[31]。Nrf-2 途径在抗氧化应激中扮演着重要角色。Li 等[32]的研究发现,在用H2O2处理的骨髓间充质干细胞(bone marrow stem cell, BMSC)模拟SCI 氧化应激模型和SCI 大鼠中,辅酶Q10 能通过上调Nrf-2/ NQO-1 的表达来抑制氧化应激和减少细胞凋亡。Xia 等[33]的研究也表明,靶向上调Nrf-2 的表达可以减少脂多糖(lipopolysaccharide, LPS)诱导的星形胶质细胞的氧化应激、炎症和凋亡。因此,Nrf-2 作为一条经典的抗氧化应激通路,其靶向干预能有效调控SCI 后的氧化应激水平,减少细胞损伤,并促进SCI 的恢复。
3.2 PI3K/AKT信号通路
PI3K/AKT 信号通路由磷脂酰肌醇3 激酶(PI3K)和下游的蛋白激酶B(AKT)构成,是细胞生理和病理过程中的一条关键途径。PI3K 分为I类、II 类和III 类三种亚型,其中I 类研究最为广泛。在此通路中,PI3K 将磷脂酰肌醇(3,4)-二磷酸二钠(PIP2)转化为磷脂酰肌醇(3,4,5)-三磷酸(PIP3),从而激活AKT。激活的AKT 通过磷酸化级联反应调控下游效应分子,此过程受脂质和蛋白质磷酸酶的调节[34]。PI3K/AKT 通路在SCI后的炎症、细胞死亡和胶质瘢痕形成中发挥着重要作用[35]。例如,He 等[36]发现,在乙醇诱导的氧化应激模型中,激活PI3K/AKT 通路可以减少ROS 的生成,从而缓解氧化应激,减轻神经元的氧化损伤。Li 等[37]发现,上调AKT 的磷酸化能够减少ROS生成,而用抑制剂阻断PI3K/AKT 通路会逆转这种保护效果。这些发现表明,PI3K/AKT 通路在调节SCI 的细胞炎症和凋亡以及氧化应激中发挥重要作用,为SCI 氧化应激的治疗提供新的靶点。
3.3 TLR4 / MyD88信号通路
Toll 样受体(Toll-like receptor, TLR)是一组能够响应病原体、细胞因子和各类应激源刺激的模式识别受体,它们激活MyD88 依赖性途径和MyD88 非依赖性途径两个主要的下游途径[38]。SCI 后,激活的TLR4 / MyD88 信号通路会增加炎症相关基因的表达,从而引发炎症[39]。此外,TLR4 / MyD88 途径不仅参与炎症反应,还与SCI中的氧化应激密切相关。Li 等[40]的研究显示,H2O2可在体外诱导神经干/祖细胞(NSPC)的氧化应激和凋亡,而使用TLR4/MyD88 抑制剂TAK-242 可显著减少NSPC 产生的ROS,并增加抗氧化酶表达和细胞存活率。Zhang 等[41]也发现,TLR4 抑制剂TLR4-IN-C34 显著减少了LPS 诱导的小胶质细胞中的ROS 产生。这些研究表明,活化的TLR4 / MyD88 通路促进ROS 产生,因此,作为一个潜在的靶点,未来有必要更深入探究该通路在氧化应激中的作用机制。
3.4 Notch信号通路
Notch 信号通路作为一种在进化上高度保守的机制,参与多种正常生理和病理过程。在Notch 通路中,经过三次裂解的受体直接进入细胞核,调控靶基因的表达[42]。Notch 在SCI 继发性损伤中扮演着关键角色,影响神经元分化、神经炎症和轴突再生等过程[43]。Li 等[44]的研究显示,H2O2处理的星形胶质细胞在经历氧化应激和细胞凋亡增加后,使用Notch 抑制剂DAPT 可以有效逆转这些现象。同样,Lv 等[45]发现,激活的Notch 通路会提高氧化应激水平。因此,Notch通路在SCI 后的氧化应激响应中发挥显著作用,是一个重要的研究焦点和潜在的治疗靶标。
3.5 JNK/p66信号通路
C-Jun 氨基末端蛋白激酶(JNK)是丝裂原活化蛋白激酶(MAPK)家族的一部分,分为三个主要亚型:JNK1 和JNK2 广泛分布于多种组织,而JNK3 主要存在于大脑、心肌、平滑肌和睾丸[46]。特定刺激激活MAP3K,进而导致MAP2K 和JNK的连续磷酸化,激活的JNK 随后介导p66 的磷酸化[46-47]。研究表明,激活的JNK/p66 信号通路能诱导大量ROS 的产生,加剧氧化应激下的细胞损伤[47]。Cheng 等[48]的研究发现,在SCI 大鼠模型中,激活JNK/p66 通路导致了ROS 的过量产生和氧化应激损伤。因此,将JNK/p66 通路作为干预靶点,减少ROS 的产生,可能有助于减轻SCI 中由氧化应激引起的损害。
4 活性氧作为脊髓损伤后的治疗靶点
4.1 抗氧化剂
在SCI 治疗中,众多天然化合物已显示出显著的抗氧化、抗炎和抗凋亡效果[49]。例如,研究表明迷迭香酸(RA),一种水溶性多酚类植物化学物质,在SCI 大鼠模型中展现出这些特性,并促进了功能恢复,体外实验亦证实了其效果[50]。同样,青藤碱,从中草药提取的一种生物碱,在SCI 治疗中同样能减轻氧化应激和炎症[51]。这些发现突显了天然化合物在SCI 治疗中的潜力。
微小RNA(microRNA, miRNA)和长链非编码RNA(lncRNA)作为基因调控的非编码RNA,在SCI 治疗中显示了较大潜力[52]。例如,miRNA 可以调节SCI 导致的氧化应激和炎症,如过表达microRNA-299a-5p 减轻了小鼠SCI 的症状[53]。同样,lncRNA 如CASC9 可减轻LPS 诱导的氧化应激和细胞凋亡[54]。这些研究结果表明,非编码RNA 是治疗SCI 后氧化应激有希望的干预靶点。
Sirtuins,一组NAD 依赖的蛋白脱乙酰酶(SIRT1-7),在调节SCI 相关氧化还原通路中发挥关键作用[12]。Chen 等[55]的研究发现,SCI大鼠中SIRT6 表达降低,而上调SIRT6 能明显减轻氧化应激、炎症和细胞凋亡。Li 等[56]的研究则表明SIRT4 通过改善线粒体功能,有助于改善MDA、乳酸脱氢酶(LDH)和ROS 的代谢,促进SCI 恢复。这些研究表明Sirtuins 在改善SCI 后的氧化应激和功能恢复方面具有潜力。
微量元素,如锌和硒,在人体中具有重要生物学功能。研究显示,它们能降低SCI 后ROS 的产生,从而减轻氧化应激损伤[18,57]。在SCI 治疗中,提升抗氧化剂的溶解度、生物利用度和生物相容性是较大挑战。近期,纳米颗粒和外泌体的应用被发现能有效提高抗氧化剂的治疗效果,代表了治疗SCI 的新方向[58-59]。
4.2 线粒体移植
线粒体在细胞的病理生理活动中扮演着关键角色,特别是在维持三磷酸腺苷(ATP)生成和细胞稳态方面。SCI 导致线粒体功能障碍,引发ROS 过量产生、线粒体DNA 损伤和ATP 生成减少等问题。新型线粒体移植策略已被提出以改善这些问题[60]。Lin 等[61]的研究通过向SCI 大鼠受损部位移植同种异体线粒体,发现可以显著改善炎症和氧化应激,促进细胞存活和功能恢复。此外,线粒体移植在改善脊髓缺血再灌注损伤方面也显示出潜力[62],其可能成为治疗SCI 的一个有希望的策略。
4.3 针灸治疗
针灸,作为中医的重要组成部分,拥有悠久的历史,并适用于治疗多种疾病。针灸通过在特定穴位插针,结合多种操作手段来进行治疗[63]。研究表明,针灸能促进SCI 功能恢复。Cheng 等[48]研究表明,电针能激活JNK/p66 途径,抑制ROS生成,从而改善SCI 后的功能恢复。同样,Dai 等[64]研究指出,电针通过激活Nrf2 / HO-1 途径,有助于SCI 的恢复。作为一种非侵入性治疗,针灸副作用较少,因此在SCI 治疗中具有潜在的价值。
5 结语
SCI 会导致不可逆的损害,目前研究重点在于减少SCI 后的继发性损伤,特别是氧化应激这一关键领域。众多研究显示,氧化应激对SCI 的进展有重大影响,因此改善氧化应激是治疗SCI的关键方向。本文详细阐述了SCI 后氧化应激的影响、相关信号通路的干预机制及治疗方法。Nrf-2、PI3K/AKT、TLR4 / MyD88、Notch、JNK/p66 等信号通路在调控SCI 的氧化应激中发挥着作用。研发针对这些通路的特异性激活剂或抑制剂,是未来治疗SCI 的一个重要方向。天然化合物因其多样的药理作用、易获取性、低成本及显著疗效,在治疗SCI 方面具有巨大潜力,并有望在临床应用中发挥作用。线粒体移植作为一种新兴治疗策略,通过替换受损细胞中的线粒体,减少ROS 的产生,增加能量生成,从而挽救受损细胞。尽管如此,线粒体移植的来源和方法仍存在争议,需要更多的研究来解决。目前,SCI 氧化应激的研究主要局限于实验室,还缺乏临床证据支持其有效性和可行性,因此未来需要开展更多临床试验来发展相关药物和治疗方法。
