良性前列腺增生与牙周炎
2024-04-08杨室淞钱信行侯俊清
杨室淞,朱 聪,钱信行,侯俊清,方 程
1. 河南大学医学院(河南开封 475400)
2. 武汉大学中南医院循证与转化医学中心(武汉 430071)
3. 武汉大学中南医院泌尿外科(武汉 430071)
4. 中国融通医疗健康集团有限公司开封一五五医院泌尿外科(河南开封 475400)
5. 河南省前列腺疾病预防与诊断工程研究中心(河南开封 475400)
牙周炎是一种常见的牙周炎症性疾病,牙周微生物群落失调引起的炎症反应,导致牙周支持组织的破坏,影响全球约7.43 亿人[1-2]。良性前列腺增生(benign prostatic hyperplasia,BPH)的特点是出现尿液储存和膀胱排空的异常,大多数60 岁以上男性均会受到一定程度的影响[3]。尽管已有较多文献表明牙周炎和BPH 之间具有相关性,但探讨两种疾病关联机制的研究较少。本文对两种疾病的相关性研究现状和可能的关联机制进行综述,旨在为两种疾病的临床诊疗和后续研究提供新思路,并为早期改善口腔环境,预防BPH 的发生或改善其预后提供依据。
1 牙周炎与良性前列腺增生的相关性
自Loe 团队开创式将细菌和牙周炎的发病机制联系以来,已有非特异性菌斑假说、特异性菌斑假说和生态菌斑假说3 个假说被提出,用来解释牙周炎的微生物病因,并确定了牙菌斑中的特定微生物群[4-8](表1)。因未检测到牙菌斑的患者也可表现出侵袭性和晚期牙周炎症状,且假定的牙周病原菌,如牙龈卟啉单胞菌、福赛斯坦纳菌和齿垢密螺旋体,经常在健康的牙周部位发现[9],非特异性菌斑假说和特异性菌斑假说的概念受到质疑。随着牙周炎的加重,口腔微生物从主要由需氧和兼性厌氧革兰氏阳性菌群转变为主要由专性厌氧菌组成的菌群[10],这些特定的细菌产生有毒的产物,介导牙周组织的破坏。龈下菌斑的微生物被分为六组复合体,其中红色复合体(牙龈卟啉单胞菌、福赛斯坦纳菌和齿垢密螺旋体)与牙周炎的临床特征最为相关[11]。有大量研究表明,口腔病原菌可能通过循环系统影响人体的其他组织器官,引起多种疾病,如心血管疾病、2 型糖尿病、类风湿性关节炎、阿尔茨海默病、非酒精性脂肪性肝病和结直肠癌[12]。

表1 牙周炎微生物病因研究Table 1. Researches on the microbial etiology of periodontitis
BPH 以尿道周围过渡区的前列腺基质细胞和上皮细胞增殖为特点,阻塞前列腺尿道,导致膀胱的解剖和功能发生变化,从而引起下尿路症状(lower urinary tract symptoms, LUTS)和膀胱出口梗阻(bladder outlet obstruction, BOO)[13]。BPH发病机制可能与雄激素、雌激素、胰岛素、炎症和干细胞等多种途径有关[14]。BPH 的临床治疗依据其增生程度分为保守观察、药物治疗和手术治疗。虽然手术治疗能应对药物治疗效果不佳或拒绝接受药物治疗的患者[15],但仍可能引发并发症。目前BPH 的发病机制尚未完全明确,进一步探究其发病机制有利于为BPH 的防治提供新策略。
2010 年美国一项研究发现,与单独患有前列腺炎或牙周临床附着水平(clinical attachment level,CAL)大于2.7 mm 的患者相比,同时患有这两种疾病的患者血清前列腺特异性抗原(prostate-specific antigen,PSA)浓度显著升高[16]。2022 年,我国一项研究纳入479 名轻度-中度牙周炎患者、355 名重度牙周炎患者以及162 名健康口腔对照,在调整年龄、BMI 等混杂因素后发现,牙周炎患者的PSA 水平显著高于健康对照,但血清PSA 水平与牙周炎的严重程度无显著相关性[17]。此外,部分研究发现血清PSA 水平与基线牙周测量指数、牙周病严重程度或牙缺失没有相关性[18-19]。也有假说认为,前列腺的炎症反应是由PSA 水平的局部升高引起的,即使这种升高发生在牙周组织中[20]。可以看出牙周炎与PSA 的关系仍存在争议,需要更多的数据来佐证。
Boland、Estemalik 等开展的临床研究表明,口腔致病菌可能通过人体循环从牙周迁移到前列腺组织,并导致前列腺疾病的发生发展,但尚未研究其中的通路或机制[21-26]。本团队既往实验研究表明,牙周炎可能通过炎症、氧化应激、抑制凋亡和代谢改变等因素影响前列腺增生进展[27-28],见表2。鉴于牙周炎的可预防性,证实两者之间的关系以及探讨牙周炎参与BPH的机制,对从口腔水平预防BPH 的发生或减缓BPH 的进展有着重要意义。
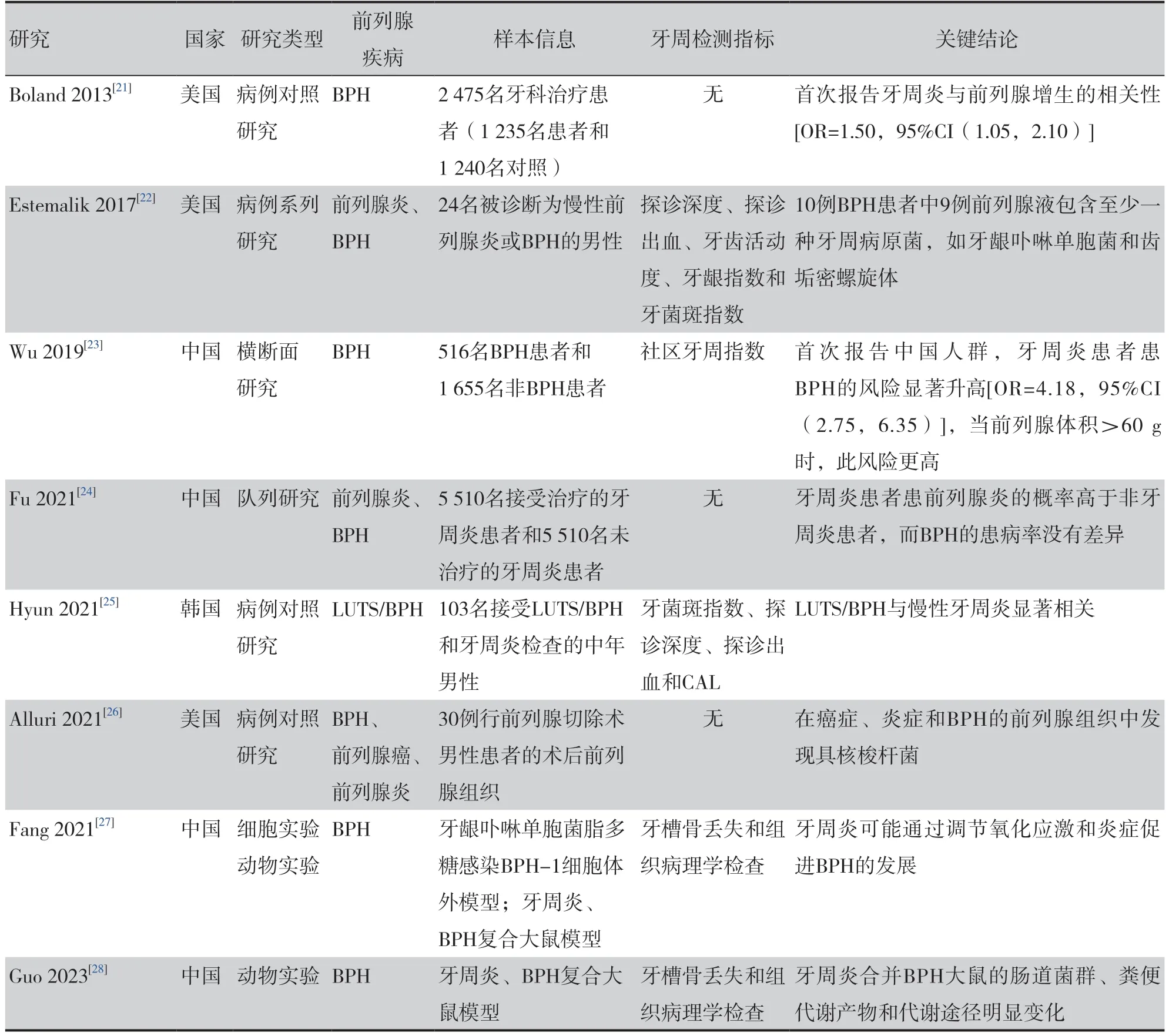
表2 牙周炎和前列腺增生相关研究Table 2. Researches on the correlation between periodontitis and benign prostatic hyperplasia
2 牙周炎与良性前列腺增生相关性的可能机制
牙周炎和BPH 有许多共同的危险因素,如年龄、吸烟、饮酒等[29-30],尽管大量研究发现两种疾病有一定联系,但其机制尚未明确。
2.1 牙周病原菌及其产物远距离传播
牙龈卟啉单胞菌被认为是牙周炎的主要病原体之一,可分泌脂多糖(lipopolysaccharide, LPS)和蛋白酶等多种毒性因子,这些毒性因子可直接破坏牙周组织,并激活牙周组织中广泛的宿主免疫细胞,引发局部免疫反应,使防御细胞释放大量炎症介质并对牙周组织造成二次损伤[12]。牙龈卟啉单胞菌及其毒性因子可以通过调节宿主免疫反应,引起局部和全身性的病理变化,从而在大脑、心血管、肺、骨骼、消化道和围产期等非口腔系统疾病中发挥致病作用[31]。在前列腺组织或前列腺液中能检测到牙周病原菌的DNA,说明牙周病原菌可能通过血液循环或某种途径,从牙周迁移到前列腺,发挥在口腔中类似的作用[22,26]。
2.2 炎症
牙周炎与BPH 的发生发展中有许多相同的炎症介质发挥作用。牙周炎患者牙周组织CXC趋化因子配体13(CXC-chemokine ligand 13,CXCL13)和血清中环氧化酶2(cyclooxygenase-2,COX-2)、 细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、TNF-α、IL-17等细胞因子升高[13,32-33]。在BPH 组织中CXCL13也显著升高[34]。COX-2 会催化花生四烯酸,产生各种前列腺素,引起机体疼痛、炎症等反应,炎细胞浸润的BPH 组织中COX-2 表达量高于无炎细胞浸润的BPH 组织[35],表明BPH 的炎症导致COX-2 过表达。ICAM-1 促进炎症部位的黏连性,BPH患者的血清ICAM-1浓度显著高于健康人群[36]。IL-17被认为是BPH发生和发展的关键细胞因子,可以调节IL-6、IL-8、IL-1 和TNF-α 的表达,其浓度在正常前列腺中可忽略不计,但在前列腺增生组织中升高[37]。牙周炎导致这些炎症因子增多,可能促进BPH 的发生。
2.3 氧化应激
氧化应激是由机体内自由基、活性氧(reactive oxygen species,ROS)和抗氧化系统间的不平衡产生,ROS 水平的提高会对脂质、蛋白质和DNA 等生物分子造成损害,导致细胞功能障碍和细胞死亡[38]。常见的氧化应激标志物,详见表3。氧化应激通过下调LPS 引发的Toll 样受体(Toll-like receptor,TLR)信号的负调节因子,抑制牙龈卟啉单胞菌LPS 在巨噬细胞中诱导的内毒素耐受,从而促进牙周炎的进展[39]。多项研究证明了氧化应激标志物局部浓度与牙周炎进展之间的关系,例如牙周炎患者在非手术治疗后,唾液中谷胱甘肽过氧化物酶(GPx)和白蛋白(ALB)等抗氧化水平升高[40]。与牙周健康人群相比,牙周炎患者的氧化应激标志物水平,如总抗氧化能力、丙二醛(MDA)、GPx、一氧化氮(NO)、8-羟基脱氧鸟苷酸(8-OHdG)明显上升,并显示出与牙周恶化和探诊出血相关的线性趋势[41]。此外,已有大量研究发现氧化应激和BPH 的发生发展有关[42-43]。ROS 已被揭示通过激活NF-κB 诱导激酶(NIK)和TNF-α/AP-1转导途径刺激NF-κB,从而诱导前列腺疾病[44]。BPH患者血清和前列腺组织氧化损伤增加[45-46],本团队在体外使用牙龈卟啉单胞菌的LPS 刺激人源BPH-1 细胞系,结果发现细胞内ROS 和过氧化氢水平升高[27]。牙周炎导致的氧化微环境,可能调节炎症、增殖、凋亡及迁移的基因,增加BPH 的发病风险。
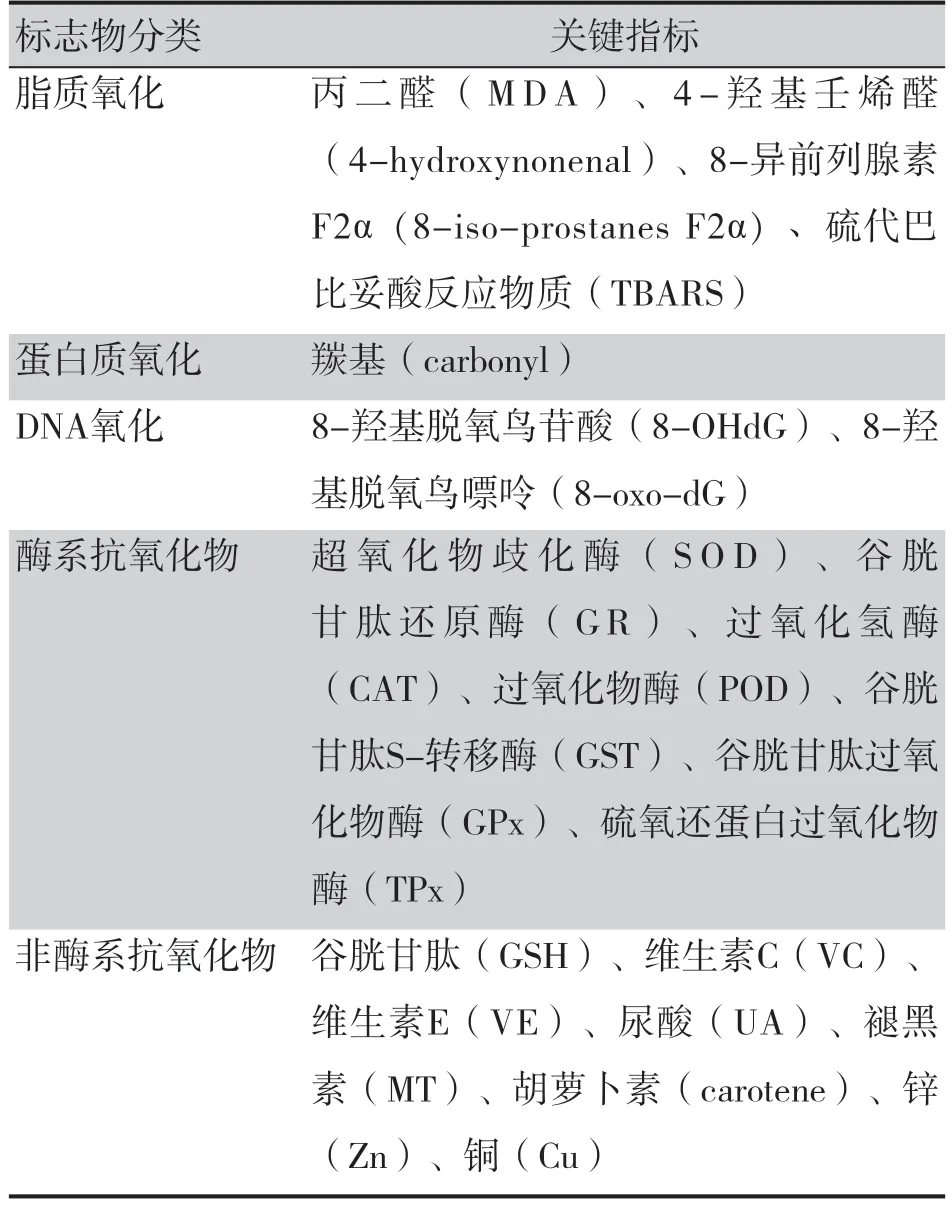
表3 常见氧化应激标志物Table 3. Common oxidative stress markers
2.4 激素水平变化
牙周炎和BPH 均受到体内激素水平的影响。流行病学研究表明,糖尿病患者牙周炎的严重程度高于健康人,且胰岛素抵抗可以促进牙周炎的发展,糖尿病患者BPH 发病率增加[47-48],且高胰岛素血症和胰岛素抵抗都被认为是BPH 的独立风险因素[49]。
一项纳入5 468 名参与者的队列研究表明,较低的血清促甲状腺激素(TSH)水平与较高的牙周炎患病率相关[50]。而在另一项研究中,排除患有前列腺癌、甲状腺和类甲状腺疾病、其他引起LUTS 的疾病、糖尿病、肾病和炎症性疾病的受试者后,纳入40 名BPH 患者和40 名同年龄段的健康人群,发现BPH 患者的血清游离三碘甲状腺原氨酸(FT3)和游离甲状腺素(FT4)显著增加,TSH 显著降低;前列腺大小与血清FT3、甲状旁腺激素(PTH)和PSA 呈正相关,与TSH 呈负相关[51]。说明甲状腺功能紊乱在牙周炎和BPH中都有一定影响。
褪黑素作为一种内源性激素,具有调节昼夜节律、抗氧化、抗炎等多种生物学功能,牙周炎患者唾液褪黑素含量明显降低,但经过治疗后得到恢复[52]。已有多项研究证明了褪黑素对牙周炎具有治疗作用[53-54]。尿频及夜尿增多是BPH 储尿期症状的早期信号,褪黑素分泌与夜尿症严重程度呈显著负相关,而褪黑素治疗可一定程度改善夜尿症状[55-56]。
患有BPH 和LUTS 的男性雄激素水平较低,雌激素水平升高,而睾酮治疗可以改善炎症和胰岛素等因素对前列腺的影响[13]。研究发现,雌二醇水平较高或睾酮水平较低的男性,牙周炎患病率和严重程度也有所增加[57]。体外研究发现,阻断雄激素受体会增加牙槽骨丧失和炎症水平[58]。但在另一项体外研究中,使用睾丸切除的牙周炎大鼠模型,发现睾酮耗竭可能通过减少IL-1β 的产生来减轻牙周炎的炎症性骨吸收[59]。表明激素失调可能共同参与了牙周炎和BPH 的发生,但这一机制又和年龄、炎症等因素密切相关,而且低雄激素水平对牙周炎的影响还存在一定争议。
2.5 节律
昼夜节律使生物体能够适应和预测环境的时间变化。在哺乳动物中,几乎所有的生理学活动都受到生物节律的调节,比如睡眠-苏醒、体温周期、消化、内分泌和代谢等活动[60]。昼夜节律紊乱(circadian rhythm disorders,CRD)已成为现代社会的一种常见现象,其发生往往与轮班工作、睡眠障碍和各种炎症性疾病有关,它可以诱导炎症细胞和炎症因子的产生,并增加了许多疾病的发生风险,如肥胖、癌症、心血管和代谢疾病[61-62]。CRD 通过抑制免疫力和促进炎症对健康产生有害影响[63]。生物钟中包含许多节律性基因,可以调节与细胞生理和代谢相关的基因表达[64]。
研究发现轮班工作与牙周病患病风险增加显著相关,其影响超过了睡眠不足[65]。牙周炎患者节律相关基因表达降低,表现出昼夜节律途径的改变[66],在体外研究中,CRD 可能通过增加巨噬细胞的浸润和活化,促进牙槽骨的吸收,加剧牙周炎[67],并且牙骨质被证明确实存在节律基因[68],CRD 可能导致牙周炎的潜在分子机制改变。
Bmal1和Per2是两种关键的节律相关基因,已有研究证明了小鼠前列腺中Bmal1和Per2的节律性改变[69],Bmal1可通过调节细胞周期参与前列腺生长[70]。昼夜节律综合征是一种潜在病因,其比代谢综合征可更好地预测老年男性BPH 导致的LUTS[52]。
2.6 微量元素和维生素等营养物质
多种营养物质对牙周健康有重要影响。牙周炎患者唾液中的钠、镁、钾、钙、镉、铁、铷、铯、锰和钒浓度都高于健康口腔人群[71]。锌是仅次于铁的人体内最丰富的微量矿物,可能参与免疫防御、炎症反应和骨重建阶段,适当剂量范围的锌补充或锌转运蛋白的调节可以通过增强免疫防御或上调局部细胞增殖和分化功能来促进牙周再生[72],牙周炎患者锌浓度较低[73-74]。与健康前列腺比较,BPH 组织中锌水平下降了61%,前列腺癌组织锌水平下降了82.6%[75]。另一项研究发现BPH 组织中央部分锌水平明显升高,外周部分锌水平只是略有下降,但前列腺癌外围部分的锌含量急剧下降至30 µg/g 以下[76],说明低水平的锌对牙周炎和BPH 的发生发展具有一定的促进作用,并且锌在BPH 中的变化还需进一步研究,而它在前列腺癌中起着更关键的作用,可以作为前列腺癌的检测指标之一。
口腔和牙周组织健康需要各种维生素,缺乏维生素会导致牙龈出血和炎症等口腔疾病[77]。维生素C(VC)对氧化应激和促炎介质的合成具有抑制作用,维生素D(VD)对促炎细胞因子的分泌具有抑制作用,并且两者都可以减少牙龈出血[78]。VD3 可能通过NF-κB 途径,抑制TNF-α/牙龈卟啉单胞菌脂多糖诱导的人牙龈成纤维细胞中β-防御素、IL-8 和p65 等趋化因子的表达[79]。前列腺和膀胱上具有VD 受体,VD 可以通过这些受体抑制前列腺生长,降低过度收缩力,减少炎症[80],还有减少前列腺体积和PSA 水平以及改善BPH 症状方面的作用[81]。
3 结语
牙周炎和前列腺增生都是衰老相关的慢性疾病,其发病率和患病率随着男性年龄的增长而增加。现有研究认为牙周炎使牙周组织局部损伤,从而让牙周病原菌及其毒性因子进入人体血液循环,通过炎症、氧化应激、代谢等途径影响人的泌尿系统。牙周炎也可能通过调节激素、微量元素和维生素等的变化,间接影响前列腺增生进展。提示保护口腔环境可以早期干预BPH 的发生发展。未来仍需开展更多的高质量研究,进一步证实两者的关系并探讨具体的关联机制,为两种疾病的防治提供新的策略。
