小鼠甲状腺原代细胞的快速培养和鉴定*
2024-04-07谭秋婵林嘉伟阳小雅姚丹丹王立伟陈丽新巫株华
谭秋婵, 林嘉伟, 阳小雅, 潘 丽, 姚丹丹, 王立伟, 陈丽新, 巫株华
(1广州卫生职业技术学院生理学教研室,广东 广州 510450;2佛山市第一人民医院乳腺外一科,广东 佛山 528000;3暨南大学医学院,广东 广州 510632;4广东省结核病控制中心,广东 广州 510630)
甲状腺功能亢进和减退与甲状腺细胞的异常增殖和凋亡以及激素合成过程障碍相关[1-2]。甲状腺原代细胞无疑是研究甲状腺内分泌课题的重要手段。国内外较多文献报道人甲状腺细胞的原代培养,而正常甲状腺人体组织较难获得,多来源于甲状腺肿瘤旁的正常组织[3-6],难以满足研究需求。小鼠因繁殖方便又易于进行基因操作,成为了实验室最佳的模式生物。但小鼠甲状腺小,细胞不易分离,目前关于小鼠甲状腺原代细胞培养的报道较少[7],方法较难复制。因此,本项工作拟报道一种能快速成功培育具备良好内分泌功能的小鼠甲状腺原代细胞的方法,为甲状腺疾病研究奠定基础。
材料和方法
1 材料
SPF 级FVB 小鼠20只,雌雄不限,6~8周龄,18 ~20 g,由广东省医学实验动物中心提供,许可证号为SCXK(粤)2020-0002(动物实验操作符合《赫尔辛基宣言》的原则)。二型胶原酶(Invitrogen);兔Anti-Thyroglobulin(Abcam);小鼠总三碘甲状腺原氨酸(total triiodothyronine,TT3)和小鼠总甲状腺素(total thyroxine,TT4)酶联免疫分析(ELISA)试剂盒(Bio-Swamp);PrimeScript TM RT reagent Kit 和 2 X Tap PCR Master Mix 试剂盒[天根生化科技(北京)有限公司]。
甲状腺原代细胞培养液[8]:由DMEM:F-12(GIB‐CO)配制而成,内含5%胎牛血清(Gibco)、促甲状腺激素10 IU/L(Sigma)、转铁蛋白5 g/mL(Sigma)、生长抑素10 g/L(Sigma)、氢化可的松3.6 g/L(Sigma)、氨酞一组胺酞一赖氨酞醋酸盐10 g/L(SANTA CRUZ)、胰岛素1 g/mL(中国药品生物制品检定所)、青霉素(10 kU/mL)/链霉素(10 g/L)1%(北京百奥莱博科技有限公司)。
2 方法
2.1 甲状腺原代细胞培养 (1)摘取组织:摘取20只小鼠甲状腺(与甲状软骨及其上下气管一并摘取以保证甲状腺的完整性,见图1),迅速将组织放入含无菌磷酸缓冲盐溶液(phosphate buffer saline, PBS)的EP 管中;(2)机械性消化:在体视显微镜下观察并剥离甲状腺,除去表面筋膜,用1 mL 无菌注射器针头将组织切成1 mm×1 mm×1 mm 小块;(3)化学性消化:将组织均分转入4 支1.5 mL EP 管中,分别加入400 mL 1 g/ L 二型胶原酶(用含10% 胎牛血清的DMEM:F-12 配制);37 ℃孵箱消化,每5 min 用手摇晃一次;4 组消化时间分别为15、25、35 和45 min。终止消化后,用1 mL 移液枪吹打组织10~15 次,200目筛网过滤消化液;157 ×g 离心5 min ;加入PBS 重悬,再离心;(4)无菌培养:弃上清,加入1 mL 培养液,调整细胞密度为1×109/L并接种到6孔板中,每孔加入1 mL 细胞悬液和1 mL 培养液,观察后在37 ℃、5% CO2培养箱中培养。次日半量换液。

Figure 1. Schematic diagram of mouse thyroid gland extraction.A: pre-thyroidectomy photograph; B: extraction of tra‐chea and thyroid gland.图1 摘取小鼠气管及甲状腺示意图
2.2 免疫荧光检测TG 将消化好的甲状腺原代细胞接种于直径22 mm的圆形玻片上。在培养第3天,根据免疫荧光的步骤检测甲状腺原代细胞TG 的表达。
2.3 检测TT3、TT4 分别在第3、5、7、10 和14 天吸取6 孔板中的上清液检测TT3 和TT4 的表达,检测步骤参照Bio-Swamp的ELISA试剂盒的说明书。
2.4 检测相关基因mRNA 的表达 分别在第3、7、10 和14 天,采用苯酚法收集甲状腺细胞的总RNA,逆转录后进行qPCR,检测甲状腺球蛋白(thyroglobu‐lin,TG)、甲状腺过氧化物酶(thyroid peroxidase,TPO)、钠碘同向转运体(sodium-iodine isotransporter,NIS)、促甲状腺激素释放激素受体(thyrotropin-re‐leasing hormone receptor,TSH-R)等基因的mRNA 表达,引物序列见表1。

表1 RT-qPCR引物序列Table 1. The sequences of the primers for RT-qPCR
3 统计学处理
用SPSS 20.0 统计软件进行分析。计量资料均以均数±标准误(mean±SEM)表示。组间均数比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
结 果
1 消化最佳时间
消化即刻观察显示,在25 min 之前,组织消化不彻底,镜下细胞少;25 min 之后消化虽彻底,但能看到较多单个细胞和细胞碎片,随着时间的延长,细胞碎片更多;消化25 min 组则能看到较多的细胞团和部分单个细胞。培养24 h 后观察,消化25 min 组的细胞状态最好、密度最大(见图2)。
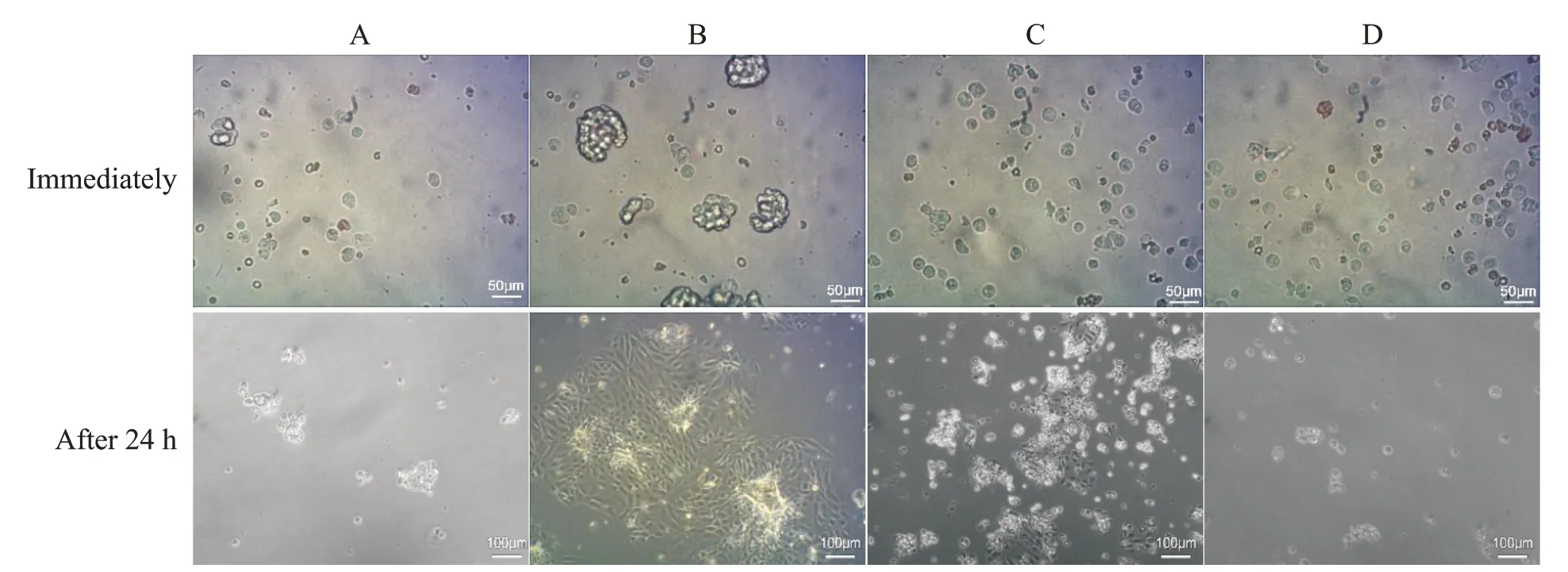
Figure 2. Immediately observation of cells at different digestion time points and the observation after 24 h of culture. A: the 15 min digestion group; B: the 25 min digestion group; C: the 35 min digestion group; D: the 45 min digestion group. The cells digested for 25 min grew best after 24 h. Most cell masses and some individual cells were observed in this group after digest immediately.图2 不同消化时间的细胞即刻观察和培养24 h后观察
2 甲状腺原代细胞的观察
培养第2 天,滤泡上皮细胞开始贴壁,细胞呈岛状生长,具有一定的三维结构;第3 天开始细胞迅速生长,3~7 d 内细胞分散生长,形态多种多样,多呈不规则;在第5~7 天出现次级滤泡结构。随后次级滤泡结构逐渐消失,细胞密度越来越大,细胞形态逐渐拉长(见图3)。
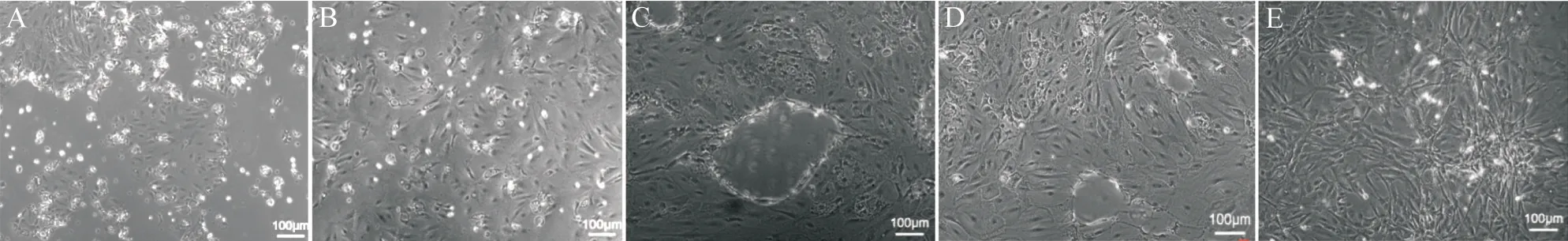
Figure 3. Observation of primary thyroid cells in mice under microscope. A: day 3; B: day 5; C: day 7; D: day 10; E: day 14.图3 小鼠甲状腺原代细胞镜下观察
3 甲状腺原代细胞鉴定
由图4可见,培养第3~5天的甲状腺细胞的胞质中可观察到TG 特异性荧光。所得的甲状腺滤泡上皮细胞占原代培养细胞的95%以上。

Figure 4. Identification of mice primary thyroid cells. A: the nucleus were stained by Hoechst (blue); B: TG was dyed with 488 green fluorescence; C: the merged image of nucleus and TG in primary thyroid cells.图4 小鼠甲状腺原代细胞鉴定
4 14 d 内小鼠甲状腺细胞分泌TT4 和TT3 的变化趋势
由图5 可知,小鼠甲状腺原代细胞在培养14 d内TT3 和TT4 的分泌水平有下降趋势。培养第7 天分泌量仍能达到60%;第10 天分泌量降至50%以下(P<0.01);第14天降至30%以下(P<0.01)。
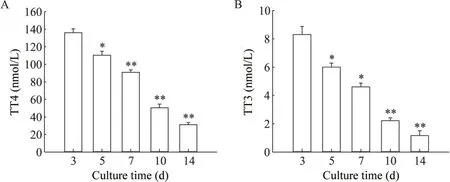
Figure 5. The TT4( A) and TT3( B) secretion changes of mouse thyroid cells within 14 d. Mean±SEM. n=3. P<0.05 vs 3 d.图5 小鼠甲状腺原代细胞TT4和TT3分泌水平14 d内的变化
5 甲状腺原代细胞14 d内特异基因的表达
RT-qPCR 检测结果显示,第7 天培养的甲状腺原代细胞的TG、TPO、NIS和TSH-R等基因的表达能保持98%以上,培养第10 天的表达量均有下降(P<0.05),但能维持在50%以上,而上述基因在14 d 的表达量降低至40% 以下,甚至更低(P<0.01),见图6。

Figure 6. The mRNA expression of specific genes in mouse thy‐roid primary cultured cells within 14 d of culture.Mean±SEM. n=3. P<0.05 vs 7 d.图6 培养14 d 内小鼠甲状腺原代培养细胞特异性基因的mRNA表达
讨 论
目前,常见的甲状腺细胞株主要有大鼠细胞系FRTL5 以及人类细胞系Nthy-ori 3-1。Nthy-ori 3-1 在人甲状腺疾病的研究中有种属上的优势,但因其不具有分泌功能,不适用于甲状腺分泌功能障碍的研究[9-10];FRTL-5 虽具有良好的吸碘能力和分泌功能[11],但其不死性证明其已经失去了一些细胞周期的基本控制机制[12]。因而,原代细胞用于甲状腺疾病研究有相对的优势。目前,人甲状腺原代细胞多来源于甲状腺肿瘤旁组织[13],因此,这些细胞可能已失去了一些甲状腺的特征。随着细胞适应体外生长条件,其可能无法保持在正常甲状腺功能和信号通路中起关键作用的重要特征[14]。选择小鼠甲状腺原代细胞作为甲状腺疾病的研究对象,既简便又利于开展转基因动物实验[15]。本研究摸索了一种快速且简便易行的小鼠甲状腺细胞的培养方法,成功培养了具有甲状腺特性和分泌功能的原代细胞。
甲状腺原代细胞培养的难点主要有两方面。(1)无菌操作。整个分离过程涉及的步骤多,因而容易导致污染,每一步都需严格遵守无菌操作原则,所有器械都是无菌器械,操作环境需提前紫外消毒30 min。(2)消化时间。此前有关小鼠甲状腺细胞培养的研究所报道的消化时间基本在60~120 min[7,16-17]。本研究通过优化取材方式及消化酶的配比,摸索出的最佳消化时间为25 min,大大缩短了消化时间,可降低研究人员的时间成本。当甲状腺消化成部分滤泡和部分单个或多个黏着细胞的消化状态时,其细胞数量和活性最佳,细胞在第2 天均可贴壁生长。细胞在培养第5~7 天左右出现了特殊的二维结构-次级滤泡结构,后续我们将对该结构的功能进一步探究。
甲状腺原代细胞对培养液的要求较高,为了能让小鼠甲状腺细胞的特性能保持更长时间,我们在培养液中加入了6 种特殊的物质。Ambesi-Impiombato 等[8]最早使用该培养液来进行甲状腺细胞的培养,称为6H 物质。Wang 等[18]通过此方法对人的甲状腺细胞进行体外培养,观察培养8 d内大部分基因表达仍与正常组织一致,但少部分基因表达下降。在前人的基础上,我们仅对原代细胞进行14 d 内的观察,显示7 d 内细胞仍能正常分泌TG 蛋白和甲状腺激素,提示7 d内细胞分泌功能良好。观察特异性基因的表达,显示10 d 内其表达量仍较高,14 d 之后下降较为明显,这提示培养10 d 以内的细胞用于基因的研究较为合适。
为了更好地保证细胞特性,我们并没有对小鼠原代细胞进行传代和冻存。但后续将会考虑进一步优化培养技术,探索其传代后特性和功能的变化规律,以期获得可长期培养且性能稳定的小鼠原代甲状腺细胞培养系。
