着丝粒蛋白H在肾上腺皮质癌的表达及对肾上腺皮质癌细胞活力和迁移的影响*
2024-04-07邹存茹刘呈悦蒋荷坪何文玺张鑫源苏文霞
邹存茹, 王 丹, 张 玉, 刘呈悦, 蒋荷坪, 何文玺, 张鑫源, 苏文霞△
(1山东第二医科大学基础医学院,山东 潍坊 261053;2山东第二医科大学附属医院病理科,山东 潍坊 261031;3山东第二医科大学临床医学院,山东 潍坊 261053)
肾上腺皮质癌(adrenocortical carcinoma, ACC)是一种起源于肾上腺皮质的罕见恶性内分泌肿瘤,具有高度侵袭性。50%~60%的患者伴有类固醇激素分泌增加,表现为库欣综合征或男性化[1]。该病预后差,5 年总生存率约50%[2]。尽管ACC 是一种罕见肿瘤,发病率低,但由于疾病诊断时多为晚期,已出现远处转移,而且手术后容易复发,因此仍是一种严重威胁人们健康的恶性肿瘤。
着丝粒蛋白(centromere protein, CENP)是在细胞分裂过程中起重要作用的一组蛋白。在细胞有丝分裂和减数分裂过程中,CENP 衔接染色体与纺锤体微管的结合,进而调控姐妹染色单体的准确分离,保证细胞的精确复制[3]。CENP 表达异常或功能缺损会造成染色体丢失、易位,导致细胞核型异常和染色体不稳定,从而使细胞生长失控,促进肿瘤的产生与发展[4-5]。
CENP-H 是CENP 家族的重要的成员之一,是活性着丝粒复合体的重要组成部分,与CENP-A 和CENP-C 一起定位于内板,负责将着丝粒与纺锤体微管连接起来[6-7]。近年来研究发现,CENP-H 在肿瘤中高表达,并与疾病进展和预后显著相关,靶向沉默CENP-H导致肿瘤细胞的凋亡和增殖抑制[8-13]。然而,目前CENP-H 在ACC 的表达水平、与疾病进展和预后的关系以及沉默CENP-H对ACC 细胞活力和迁移的影响尚不清楚,本文旨在研究这些问题。
材料和方法
1 主要材料
胎牛血清购自HyClone;siRNA 及细胞转染试剂购自广州锐博生物技术有限公司;兔抗人CENP-H单克隆抗体购自武汉博士德生物工程有限公司;兔抗人GAPDH、p-ERK1/2、t-ERK1/2、p-P38、t-P38、p-JNK1/2 和t-JNK1/2 单克隆抗体购自Cell Signaling Technology。
2 主要方法
2.1 GEPIA2 数据库 运用GEPIA2 数据库(http://gepia2. cancer-pku. cn/)[14],分 析CENP-H 在76 例ACC患者和128例健康对照中的mRNA表达水平,分析其在不同TNM 分期ACC 患者中的表达,并进一步分析其与ACC患者总体生存率(overall survival)之间的相关性。
2.2 UALCAN 数据库 应用UALCAN 数据库(http://ualcan.path.uab.edu/index.html)[15]中的数据分析CENP-H 在不同TNM 分期ACC 患者的表达和预后。
2.3 免疫组织化学染色 4 例ACC 和4 例正常肾上腺石蜡组织切片脱蜡,柠檬酸钠沸液中抗原修复10 min,加入3%过氧化氢室温孵育12 min,5%牛血清白蛋白封闭35 min,倒出封闭液后加入兔抗人CENP-H 单克隆抗体(1∶100 稀释),4 ℃孵育过夜。加入Ⅱ抗室温孵育1 h,显微镜下观察二氨基联苯胺显色情况。苏木精复染,分化、脱水、封片,采用综合计分法进行半定量分析。
2.4 细胞培养及转染 人ACC 细胞系H295R 用含10%胎牛血清和1% Gibco™ Insulin-Transferrin-Sele‐nium (ITS-G)的DMEM/F12 培养液,于37 ℃、5% CO2、饱和湿度下培养。将对数生长期的H295R细胞调整密度为1×105/mL,取2 mL 种于六孔板内,待细胞融合度为30%~50%时,用转染试剂将终浓度为50 nmol/L 的CENP-HsiRNA (siCENP-H)转染细胞,放入37 ℃、5% CO2培养箱中培养。细胞分为si‐CENP-H 组和阴性对照(siNC)组。siCENP-H 的序列为5´-AACAAUUUCCUUAAGGGCAGGAUCC-3´;siNC的序列为5´-UUCUCCGAACGUGUCACGUTT-3´。
2.5 CCK-8 实验 将对数生长期的H295R 细胞种于96孔板内,每孔5 000个,siRNA 转染细胞(方法同前),于0、24、48、72 和96 h 检测细胞活力。收获前2 h,每孔加入10 µL CCK-8 溶液(5 g/L)继续培养。置于摇床上低速振荡10 min,在酶联免疫检测仪570 nm波长处测量各孔的吸光度(A)。每组设3个复孔,实验重复3次。
2.6 划痕实验 收集转染后72 h 实验组和对照组细胞,调整细胞密度为2×105/mL,取2 mL 种于6 孔板内,待细胞融合度为70%~80%时进行划痕并更换培养液,用含1%胎牛血清和1% ITS-G的DMEM/F12培养液,在37 ℃、5% CO2、饱和湿度下继续培养,于0、24、48和72 h观察细胞迁移情况并拍照记录。
2.7 Western blot实验 收获转染后72 h细胞,提取细胞总蛋白;经10% SDS-PAGE 分离蛋白,转膜,封闭;加入Ⅰ抗(GAPDH 和CENP-H 抗体,1∶1 000;p-ERK1/2、t-ERK1/2、p-P38、t-P38、p-JNK1/2 和t-JNK1/2 抗体,1∶2 000),4 ℃孵育过夜;孵育辣根过氧化物酶标记的羊抗兔Ⅱ抗(1∶5 000);ECL 化学发光法检测蛋白的表达,扫描后用Gel-Pro Analyzer 软件进行灰度分析,计算目的蛋白与内参照条带灰度的比值,以及磷酸化MAPK 与总MAPK 条带灰度的比值。实验重复3次。
3 统计学处理
GEPIA2 数据库和UALCAN 数据库中导出的箱线图、小提琴图及生存曲线采用数据库网站中的统计分析方法,其中箱线图数据的表达格式为中位数。使用SPSS 18.0软件对实验结果进行分析,实验数据采用均数±标准差(mean±SD)表示,两组定量资料比较采用独立样本t检验。以P<0.05 为差异有统计学意义。
结 果
1 CENP-H mRNA 在ACC 中高表达且随肿瘤分期表达升高
GEPIA2 数据库 分 析了CENP-H 在76 例ACC 患者和128 例健康对照中RNA 测序(RNA-seq)数据的差异(以TPM值衡量mRNA表达水平),发现CENP-H在ACC 中高表达(P<0.05),见图1A、B。GEPIA2 数据库进一步检测了CENP-H 在肿瘤不同TNM 分期患者中的表达,通过方差分析,发现CENP-H 在I、II、III和IV 期ACC 患者的表达存在显著差异(F=5.82,P<0.01),见图1C。UALCAN 数据库显示,CENP-H 在IV 期ACC 的表达显著高于I、II 和III 期(P<0.05),见图1D。以上结果表明,CENP-H mRNA 在ACC 中高表达且随肿瘤分期表达升高。
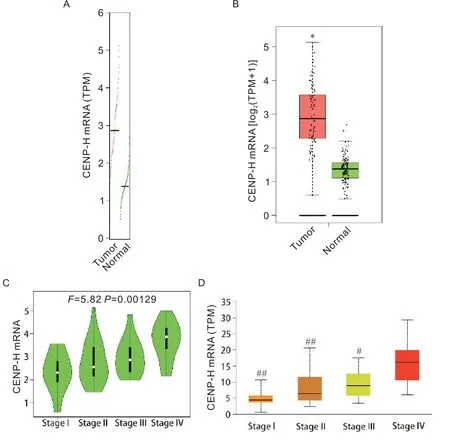
Figure 1. The mRNA expression of CENP-H in adrenocortical carcinoma (ACC). A and B: the mRNA expression of CENP-H in ACC patients( n=77) and normal controls( n=128) from GEPIA2 database; C: violin plots of CENP-H mRNA in different TNM stages of ACC patients from GEPIA2 database; D: the mRNA expression levels of CENP-H in different TNM stages of ACC patients from UALCAN database. TPM: transcripts per million. *P<0.05 vs normal; #P<0.05, ##P<0.01 vs stage IV.图1 在ACC中CENP-H的mRNA表达
2 CENP-H高表达与ACC患者不良预后相关
GEPIA2数据库分析了CENP-H的mRNA 表达与ACC 患者总体生存率之间的相关性。CENP-H 高表达组患者的总体生存率明显低于低表达组(HR=4,P<0.01),见图2A。UALCAN数据库也显示,与CENPH 低表达组相比,CENP-H 高表达组患者的总体生存率显著降低(P<0.000 1),见图2B。以上结果表明,CENP-H高表达与ACC患者不良预后相关。
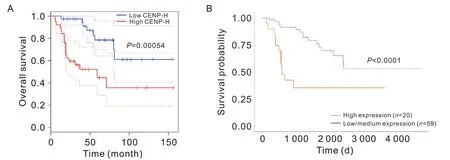
Figure 2. Correlation of between CENP-H expression and prognosis of adrenocortical carcinoma( ACC) patients. A: impact of CENPH expression on the overall survival of ACC patients in GEPIA2 database( n=38); B: impact of CENP-H expression on the survival probability of ACC patients in UALCAN database.图2 CENP-H表达与ACC预后的相关性
3 CENP-H 蛋白在ACC 组织的表达水平高于正常肾上腺
CENP-H 为核内蛋白,在4 例ACC 组织的阳性率为(4.7±0.5)%,在4例正常肾上腺的阳性率为(0.9±0.2)%,差异有统计学意义(P<0.01),见图3。这表明CENP-H 蛋白在ACC 组织的表达水平高于正常肾上腺。
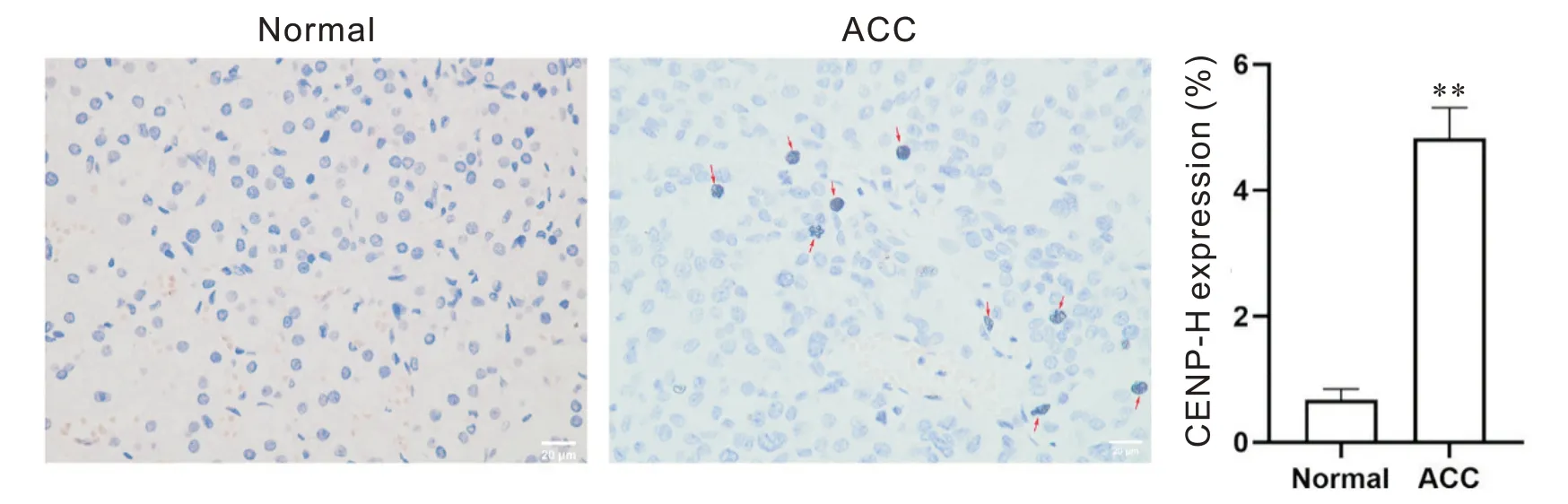
Figure 3. The expression of CENP-H protein in adrenocortical carcinoma( ACC) tissues. Immunohistochemical staining of paraffinembedded ACC and normal adrenal gland specimens was performed. Scale bar=20 µm. Red arrows indicate CENP-H posi‐tive cells. Mean±SD. n=4. **P<0.01 vs normal group.图3 CENP-H蛋白在ACC石蜡切片的表达
4 敲减CENP-H表达抑制H295R细胞活力和迁移
H295R细胞转染siCENP-H后CENP-H蛋白表达水平显著下降(P<0.01),表明成功敲减H295R 细胞中CENP-H表达,见图4。转染siCENP-H 后24 h,H295R 细胞活力较对照组显著降低,随着时间延长,在转染后48、72 和96 h,与对照组的差距逐渐加大(均P<0.01),见图5A。siCENP-H 组H295R 细胞的迁移率也较siNC 组显著降低,随着时间延长两组的差距逐渐增大(均P<0.01),见图5B。以上结果表明,敲减CENP-H表达可以抑制H295R 细胞活力和迁移能力。

Figure 4. The expression of CENP-H protein in H295R cells transfected with siCENP-H. Mean±SD. n=6. **P<0.01 vs siNC group.图4 H295R细胞转染siCENP-H后CENP-H蛋白的表达

Figure 5. Impact of CENP-H knockdown on the viability (A; CCK-8 assay) and migration (B; wound-healing assay) of H295R cells. Mean±SD. n=3. **P<0.01 vs siNC group.图5 敲减CENP-H表达对H295R细胞活力和迁移的影响
5 敲减CENP-H表达抑制MAPK信号通路的活化
H295R 细胞转染siCENP-H 后72 h,p-ERK1/2 与t-ERK1/2 的比值在siNC 组为0.64±0.13,在siCENPH 组为0.88±0.57,差异无统计学意义(P=0.05);p-P38 与t-P38 的比值在siNC 组 为0.90±0.02,在si‐CENP-H 组为0.75±0.06,siCENP-H 组显著低于siNC组(P=0.02);p-JNK1 与t-JNK1 的比值在siNC 组为0.92±0.04,在siCENP-H 组为0.52±0.20,siCENP-H组显著低于siNC 组(P=0.03);p-JNK2与t-JNK2的比值在siNC 组为0.81±0.17,在siCENP-H 组为0.36±0.16,siCENP-H 组显著低于siNC 组(P=0.03),见图6。这表明敲减CENP-H表达抑制P38 和JNK 信号通路的活化,其中抑制JNK 信号通路活化的效应尤为显著。

Figure 6. Impact of CENP-H knockdown on the activation of MAPK signaling pathways in H295R cells. The protein levels of p-ERK1/2, t-ERK1/2, p-P38, t-P38, p-JNK1/2 and t-JNK1/2 were detected by Western blot. Mean±SD. n=6. *P<0.05 vs siNC group.图6 敲减CENP-H表达对H295R细胞中MAPK信号通路的影响
讨 论
已有研究发现CENP-H 在鼻咽癌、舌癌、非小细胞肺癌、食管癌和肝癌中高表达,且肿瘤体积越大、病理分级分期越高CENP-H 的表达也越高,CENP-H高表达的患者较低表达患者总体生存率降低。CENP-H是评估鼻咽癌、舌癌、非小细胞肺癌、食管癌和肝癌预后的独立标志物[8-12]。我们研究发现ACC患者中CENP-H 的mRNA 和蛋白表达均高于健康对照,CENP-H mRNA随肿瘤分期表达升高,CENP-H高表达患者的总体生存率明显低于低表达患者,提示CENP-H 高表达与ACC 患者不良预后相关,CENP-H是评估ACC患者预后的可靠标志物。
CENP-H 在发生远处转移的IV 期ACC 患者表达水平较肿瘤局限在肾上腺的I 期、II 期和近处转移的III 期患者明显升高,且CENP-H 高表达患者的生存率显著降低,提示CENP-H 在ACC 肿瘤进展和转移中具有重要作用。在肝癌细胞中,敲减CENP-H导致了细胞增殖抑制和集落形成能力降低,并诱导了细胞凋亡[13]。那么,CENP-H 对ACC 细胞生物学功能具有怎样的影响呢?我们发现敲减ACC 细胞CENP-H的表达后细胞活力和迁移受到抑制,说明CENP-H 在增强ACC 细胞活力和促进细胞迁移中具有重要作用。
MAPK 信号通路是调控细胞生长、分化、发育、迁移等关键的信号通路。MAPK 分子包括ERK1/2、JNK1/2/3、P38 和ERK5,磷酸化的MAPK 分子具有活性,能够进一步激活与细胞生长、分化、发育、迁移等相关的转录因子,从而调控细胞生物学行为[16]。此外,MAPK 信号通路还参与了肿瘤的增殖和转移。在前列腺癌细胞中敲减DLL3的表达可导致p-ERK1/2、p-JNK1 和p-P38 蛋白水平下降,而过表达DLL3导致p-ERK1/2、p-JNK1 和p-P38 蛋白水平升高,DLL3通过MAPK 信号通路促进了前列腺癌的增殖、迁移和侵袭[17]。在肺癌细胞中敲减CENP-H表达可导致p-ERK1/2 和p-P38 蛋白水平下降,其中p-P38 蛋白的下降尤为明显,CENP-H通过ERK/P38信号通路调控肺癌的进展和顺铂耐药[18]。在本研究中,敲减ACC细胞CENP-H表达后p-ERK1/2 蛋白无明显变化,p-P38 和p-JNK1/2 蛋白水平降低,以p-JNK1/2 蛋白的降低尤为显著,表明敲减ACC 细胞CENP-H表达抑制了P38 和JNK 信号通路。在生理状态下,P38 和JNK 信号通路主要参与炎症、凋亡和应激反应[19]。P38 和JNK 信号通路根据细胞类型的不同可能发挥促进或抑制细胞增殖、分化、迁移等截然相反的生物学效应,而在肿瘤细胞中,两者可能通过促进炎症因子的释放促进肿瘤的发生[20]。P38δ缺失抑制了小鼠皮肤癌细胞的增殖,因而P38 信号通路在小鼠皮肤癌进展中具有重要作用[21]。我们的研究结果提示CENP-H 可能通过P38 和JNK 信号通路发挥调控ACC 细胞活力和迁移的作用,下一步需要在敲减CENP-H表达的同时加入P38 或JNK 激动剂检测细胞活力和迁移的改变,来明确CENP-H 是否经由P38和JNK信号通路影响ACC细胞活力和迁移。
综上所述,本研究通过分析ACC 患者和健康对照CENP-H mRNA 和蛋白水平的表达差异,发现CENP-H 在ACC 患者高表达。进一步的研究发现CENP-H mRNA 随肿瘤分期增加而表达升高,CENPH 高表达患者的总体生存率明显低于低表达患者。敲减ACC 细胞CENP-H表达,可减弱细胞活力,抑制细胞迁移,并抑制P38 和JNK 信号通路的活化。本研究为评估ACC患者的预后提供了可靠的生物标志物,并为ACC患者的治疗提供了潜在的靶点。
