hUMSCs外分泌上清联合替莫唑胺在不同胶质瘤细胞系中的协同增敏作用*
2024-04-07刘雨思王明明张玉富靳小燕史海燕陈美霓
刘雨思, 王明明, 张玉富, 靳小燕, 贺 晶, 史海燕, 陈美霓, 张 静,3,4△
(1延安大学基础医学院,陕西 延安 716000;2延安大学附属医院,陕西 延安 716000;3西安医学院第二附属医院,陕西 西安 710038;4陕西干细胞工程有限公司,陕西 西安 710075)
多形性胶质母细胞瘤(glioblastoma multiforme,GBM)是恶性程度最高的胶质瘤,也是成人中枢神经系统最常见的恶性肿瘤,随着人们生存环境的改变,其发病率呈逐年上升趋势[1]。由于常侵及瘤周重要的生命调控中枢,GBM预后远差于其他各系统肿瘤,死亡率很高[2]。对患者进行术后辅助性化疗被认为是延长GBM 患者生存时间的主要手段[3]。第二代口服烷化剂替莫唑胺(temozolomide, TMZ)因其较易通过血脑屏障而成为抗GBM 的一线化疗药[4-5]。但临床数据显示TMZ 的初始有效率约为56%[6],继发耐药率高达83%[7],这可直接导致化疗失败。因此,对于复发/难治及耐药的GBM 患者,迫切需要靶向性强且副作用可控的全新方案以辅助或取代现有治疗。
目前,人脐带间充质干细胞(human umbilical cord mesenchymal stem cells, hUMSCs)凭其低免疫原性及肿瘤嗜性等已成为肿瘤靶向疗法中的“种子细胞”[8]。对脑肿瘤而言,hUMSCs 还可跨越血脑屏障从而实现颅内定向给药。研究表明,hUMSCs可能是通过其外分泌上清(hUMSC culture supernatant,hUMSC-CM)的“细胞替代[9]”与“伪旁观者效应[10]”等方式共同发挥抗肿瘤作用。hUMSC-CM 含有多种细胞外囊泡和生物活性因子,其活性可显著影响邻近细胞的关键生物学功能。同时它保留了hUMSCs 穿过血脑屏障的特性与肿瘤倾向性。利用干细胞上清提取物治疗肿瘤既能发挥干细胞优势又可避免细胞递送的局限性,是一种可行的无细胞疗法替代方案[11]。抗癌药的配伍能有效克服肿瘤的原发和继发性耐药,这也许是提高GBM 对TMZ 敏感度的潜在途径。与大多数抗癌药不同,有效剂量的hUMSC-CM对正常细胞和组织器官的功能无不良影响,提示其与其它药物配伍治疗的安全性[12]。本研究以大鼠恶性胶质瘤细胞系RG-2、人星形细胞瘤细胞系U251和人胶质母细胞瘤细胞系LN-428 为研究对象,通过细胞活力检测、病理形态学观察及凋亡分析等技术,评估不同胶质瘤细胞系对TMZ以及hUMSC-CM 的敏感度差异,进而筛选出有效配伍浓度,观察二者体外治疗胶质瘤的协同增敏效果。通过检测胶质瘤细胞凋亡与自噬通路变化,以期揭示配伍给药的有效作用机制,为联合给药的选择性用药浓度及个体化治疗提供实验依据。
材料和方法
1 实验材料
1.1 细胞 人胶质母细胞瘤细胞U251和LN-428购自广州华拓科技有限公司;大鼠胶质母细胞瘤细胞RG-2购自上海雅集生物科技有限公司。
1.2 脐带标本 脐带组织取自延安大学附属医院产科剖宫产足月健康胎儿,脐带组织标本使用经过产妇本人允许并签订知情同意书,并获得延安大学医学生物科学伦理委员会(2022036)批准。
1.3 主要试剂与仪器 H-DMEM 培养液、胎牛血清(fetal bovine serum, FBS)购自Gibco;hUMSCs完全培养液购自武汉普诺赛生物科技有限公司;CCK-8 试剂购自Dojindo;苏木精-伊红染色试剂盒购自碧云天生物技术有限公司;TUNEL 试剂盒购自北京全式金生物技术股份有限公司;细胞周期试剂盒购自江苏凯基生物技术股份有限公司;抗人CD34、CD45、CD73、CD90 和CD105 流式抗体购自Affinity;cleaved caspase-3、cleaved caspase-8、cleaved PARP1、beclin-1、LC3 和β-actin 抗体购自Proteintech。流式细胞仪购自Agilent Technologies。
2 实验方法
2.1 胶质瘤细胞培养 RG-2、U251 和LN-428 细胞使用H-DMEM培养液,于37 °C、5% CO2孵箱中培养。
2.2 hUMSCs的分离、培养与鉴定 利用组织块贴壁法提取hUMSCs[13]。将脐带组织切成段,去除脐静脉和脐动脉,将华通氏胶切成2~3 mm 长度大小的组织块接种于细胞培养瓶中,于37 ℃、5% CO2孵箱中培养;细胞生长到80%~90%融合状态时第一次传代。当第3~8 代hUMSCs 生长密度达到80%~90%时加入胰酶消化,离心。用PBS将细胞重悬成1×109/L,加入I抗(纯化的抗人CD34、CD45、CD73、CD90和CD105)5 µL,4 ℃孵育60 min。PBS 洗涤3 遍,1 000×g离心5 min;用PBS将细胞重悬后使用流式细胞仪检测。
2.3 hUMSC-CM 的收集和冻干粉的制备 当第3~8代hUMSCs生长到80%~90%融合状态时,胰酶消化,1 000×g离心5 min。hUMSCs按照每75 cm2培养瓶接种7×105个细胞培养。hUMSC-CM 分两种FBS 剥夺方式收集:(1)24 h FBS 剥夺法:使用8~9 mL 含有10% FBS 的H-DMEM 孵育24 h,之后用14 mL 不含FBS 的H-DMEM 继续培养48 h 后收集hUMSC-CM;(2)48 h FBS 剥夺法:使用8~9 mL 含10% FBS 的HDMEM 孵 育48 h 后更 换14 mL 不含FBS 的H-DMEM孵育24 h,收集hUMSC-CM。将hUMSC-CM 于−80 ℃冷冻凝固后置于预冷的真空机中抽真空,升华干燥,制备成冻干粉,称重,溶解于PBS,经0.22 µm滤膜过滤筛选后收集在无菌离心管中,于−20 ℃储存。
2.4 CCK-8 实验检测细胞活力 将处于对数生长期的胶质瘤细胞接种于96 孔板中,加入含hUMSCCM 或TMZ 的培养液,孵育后每孔加入CCK-8 试剂10 µL,于37 °C 孵育2 h,酶标仪测定450 nm 处吸光度(A)。
2.5 HE 染色形态学分析 将处于对数生长期的胶质瘤细胞以5×107个/L 浓度接种于Nest-Dishes 蜂巢式爬片皿,待细胞生长密度达到75%时,加入含hUMSC-CM或TMZ的培养液,孵育48 h后取出。PBS洗涤3 遍,冷丙酮−20 °C 固定15 min,苏木精染色5 min,自来水冲洗,1%盐酸乙醇10 s,自来水冲洗,1%氨水返蓝30 s,自来水冲洗,置伊红液2 min,脱水,透明,封片,显微镜下观察拍照。
2.6 流式细胞技术测定胶质瘤细胞周期 将处于对数生长期的胶质瘤细胞以5×107/L 浓度接种于直径6 cm 培养皿,待细胞生长密度达到75%时,按照不同给药组分组处理48 h,收集细胞悬液于离心管中,1 000×g离心5 min。PBS 洗涤3 遍,1 000 ×g离心5 min,加入预冷的70%乙醇重悬,−20 ℃固定过夜。离心,用预冷的PBS 洗涤2 次,加入RNase 室温孵育15 min,利用PI 染色法进行染色[14]。室温避光孵育15 min,用流式细胞仪检测数据并分析结果。
2.7 TUNEL 法测定胶质瘤细胞凋亡 将对数生长期的胶质瘤细胞以5×107/L浓度接种于Nest-Dishes蜂巢式爬片皿,待细胞生长密度达到75%时,加入含hUMSC-CM 或TMZ 的培养液,孵育48 h,收集细胞爬片。PBS 洗涤,4%多聚甲醛室温固定30 min,PBS 洗涤。滴加细胞通透液0.1% Triton X-100通透细胞,静置5 min。将50 µL 1×标记溶液与TdT混匀后滴加至爬片表面,37 ℃避光标记1 h。向标本上滴加100 µL 0.1% Triton X-100,静置5 min。滴加2.5 µL 抗荧光淬灭剂,封片,通过荧光显微镜观察并采集图像。
2.8 Western blot 检测凋亡和自噬相关蛋白表达水平 按照不同给药实验组处理胶质瘤细胞,洗涤细胞后加入细胞裂解液,4 ℃、13 000 ×g离心15 min,吸取上清液,加入凝胶上样缓冲液,沸水浴煮10 min,得到蛋白样品。进行SDS-PAGE 凝胶电泳,350 mA恒流电流模式转膜2 h,置于5%脱脂牛奶中,室温封闭2 h,4 ℃孵育Ⅰ抗过夜,TBST 洗涤3 遍,室温下Ⅱ抗孵育1 h,滴加ECL发光液后曝光。
3 统计学处理
采用Graphpad Prism 9.0 软件进行统计学分析,两组数据差异分析采用非配对t检验,多组数据差异分析采用单因素方差分析(one-way ANOVA)。计量实验数据均以均数±标准差(mean±SD)表示,以P<0.05为差异有统计学意义。
结 果
1 hUMSCs的培养与鉴定结果
观察原代(P0)和传代(P1~P8)hUMSCs 的形态特征,可见hUMSCs 呈长梭形、涡旋状的成纤维细胞形态(图1A)。流式细胞术检测第4 代hUMSCs 抗原标志物表达情况,结果显示,hUMSCs 高表达CD73(98.2%)、CD105(97.7%)、CD90(98.5%)等阳性抗原标志物,低表达CD34(0.5%)、CD45(0.7%)等阴性抗原标志物,证明所检测细胞为间充质干细胞且纯度较高(图1B)。
2 hUMSC-CM的收集和冻干粉的制备
因第1~2 代hUMSCs 染色体异常核型比例偏高,而高代次hUMSCs 有老化征象,所以使用第3~8 代hUMSCs做后续实验。采用两种去血清法收集第3~8代hUMSCs 上清液,将收集的hUMSC-CM 放置−80 ℃冷冻、凝固后制备成冻干粉,见图2。
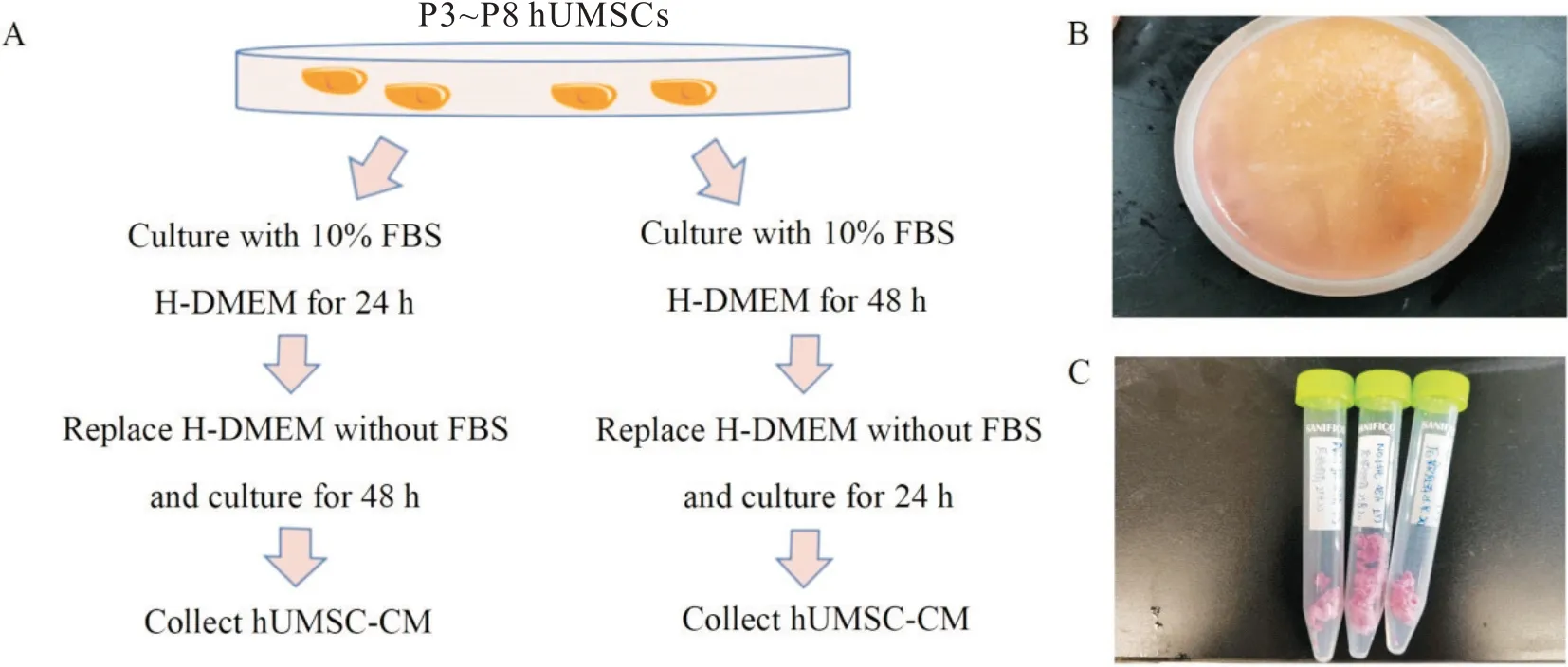
Figure 2. Method of powder preparation of P3~P8 hUMSC-CM. A: schematic diagram of collection of P3~P8 hUMSC-CM( the 24 h serum deprivation method is shown on the left and the 48 h serum deprivation method is shown on the right); B: hUMSCCM after freezing at −80 ℃; C: hUMSC-CM powder prepared by freeze-drying technique.图2 第3~8代hUMSCs培养上清液的粉末制备法
3 对比两种FBS 剥夺法收集hUMSC-CM 对胶质瘤细胞活力的影响
为明确hUMSC-CM 浓度是否受孵育时间和FBS的影响,将两种FBS 剥夺法收集的hUMSC-CM 分别设置为5 种剂量(0、1、3、6 和9 g/L)作用于RG-2、U251 和LN-428 细胞24、48 和72 h。根据CCK-8 结果,hUMSC-CM 以浓度依赖性方式抑制胶质瘤细胞增殖,胶质瘤细胞系对hUMSC-CM 的敏感度也不尽相同,如24 h 血清剥夺法收集的9 g/L hUMSC-CM 作用于胶质瘤细胞48 h 后,RG-2 细胞相对活力为(33.4±0.5)%,U251细胞为(53.4±0.7)%,LN-428细胞为(68.6±0.5)%;将48 h 血清剥夺法收集的9 g/L hUMSC-CM 作用于胶质瘤细胞48 h 后,RG-2 细胞相对活力为(21.3±0.5)%,U251 细胞为(48.2±0.4)%,LN-428细胞为(52.8±0.2)%,见图3。胶质瘤细胞对hUMSC-CM 的敏感度为RG-2>U251>LN-428。因24 h 收集法中hUMSCs 状态受剥夺血清时间影响较大,分泌上清能力受限,故采用48 h 收集法的hUMSCCM用于后续实验。

Figure 3. Effects of hUMSC-CM obtained by two serum deprivation methods on the viability of glioma cells. A: the viability of RG-2,U251 and LN-428 cells was detected by CCK-8 assay after 24, 48 and 72 h of treatment with hUMSC-CM collected by the method of serum withdrawal at 24 h; B: the viability of RG-2, U251 and LN-428 cells was detected by CCK-8 assay after 24, 48 and 72 h of treatment with hUMSC-CM collected by the method of serum withdrawal at 48 h. Mean±SD. n=3. *P<0.05, **P<0.01 vs 0 g/L hUMSC-CM group.图3 两种血清剥夺法采集hUMSC-CM对胶质瘤细胞活力的影响
4 胶质瘤细胞化疗敏感度差异及病理形态学检测
0、25、50、100、200 和400 µmol/L 的TMZ 处理RG-2、U251 和LN-428 细 胞48 h 后,TMZ 对RG-2、U251 和LN-428 细胞的IC50分别为74.2、140.6 和183.2 µmol/L。胶质瘤细胞对TMZ 的敏感度为:RG-2>U251>LN-428(图4A)。HE 染色病理形态学结果显示,对照组细胞生长密集,形态饱满,TMZ 处理组细胞数目减少,细胞形态呈现胶质样分化,部分收缩变圆,胞核致密浓缩(图4B)。
5 hUMSC-CM 联合TMZ 抗胶质瘤的协同增敏效应分析
CCK-8 实验结果显示,hUMSC-CM 与TMZ 配伍处理RG-2、U251 和LN-428 细胞48 h 后表现出对胶质瘤细胞的协同式剂量依赖性抑制作用(图5A)。在RG-2、U251 和LN-428 细胞中,9 g/L hUMSC-CM(C9)联合50 µmol/L TMZ(T50)配伍(C9+T50)组与T50 组相比细胞相对活力分别下降(66.8±0.4)%、(59.8±0.4)%和(38.9±0.7)%,差异有统计学意义(P<0.05)。C9 与T50 配伍后TMZ 对RG-2、U251、LN-428 细胞的IC50分 别 为21.16、42.52 和63.77µmol/L。C9+T50 组合可作为有效配伍浓度。HE 病理形态学结果显示,与对照组相比,C9+T50 组合处理后胶质瘤细胞生长密度变低,形态上表现出体积变小,突起伸长(图5B)。流式细胞术分析细胞周期结果显示,C9+T50 组RG-2 和U251 细胞被阻滞于G2/M期,LN-428细胞被阻断在G0/G1期(图5C)。
6 有效浓度hUMSC-CM/TMZ 配伍对胶质瘤细胞凋亡形态学的影响
TUNEL 荧光染色结果显示,与对照组或单独给药组相比,C9+T50 组RG-2、U251 和LN-428 细胞中TUNEL阳性染色荧光强度明显增强,见图6。

Figure 6. TUNEL staining was used to detect the apoptosis of glioma cells( scale bar=50 µm). Compared with control( CON) group,TUNEL expression was strongly positive after 9 g/L hUMSC-CM( C9) combined with 50 µmol/L temozolomide( T50), and the intensity of fluorescence was RG-2 > U251 > LN428.图6 TUNEL染色检测胶质瘤细胞凋亡
7 hUMSC-CM/TMZ 通过上调凋亡蛋白PARP1 和caspase-3/8 剪切并促进自噬蛋白beclin-1 和LC-3表达
Western blot结果表明,与对照组相比,联合组内RG-2、U251 和LN-428 细胞中cleaved caspase-3、cleaved caspase-8 和cleaved PARP1 蛋白水平显著升高(P<0.01),且自噬蛋白beclin-1 和LC3-II/LC3-I 水平显著高于对照组(P<0.01),见图7。

Figure 7. The protein levels of cleaved caspase-3, cleaved caspase-8, cleaved PARP1, beclin-1 and LC3 in RG-2, U251 and LN-428 cells were detected by Western blot. Mean±SD. n=3. *P<0.05, **P<0.01 vs CON group.图7 Western blot 检测RG-2、U251 和LN-428 细胞内cleaved caspase-3、cleaved caspase-8、cleaved-PARP1、beclin-1 和LC3蛋白水平
讨 论
hUMSCs 抗肿瘤的作用机制可能包括分化为受损细胞达到修复目的、分泌多种生物活性因子等两种方式[15]。前者可能会引起促瘤效应,对肿瘤细胞的抑制起到相反作用[16],因而利用富含细胞活性因子的干细胞上清提取物作为细胞替代疗法得到了越来越多的关注。但对hUMSC-CM 抗胶质瘤的研究鲜有报道,且hUMSC-CM 的浓度是否受FBS 和孵育时间的影响尚不清楚。据此,本研究采用24 和48 h 两个时点分批次剥夺血清收集hUMSC-CM,并以不同浓度梯度和时间作用于胶质瘤细胞,结果提示两种去剥夺血清法收集的hUMSC-CM 均可以剂量依赖性方式抑制胶质瘤细胞的活力。此外,为保证相同质量的粉末中成分基本相同,本实验采用第3~8 代hUMSCs 作为上清提取来源,经过3 次平行实验验证hUMSC-CM 对胶质瘤的杀伤效果是否一致。后续需结合组学分析等多层次实验鉴定每批次粉末中质量与成分是否保持均一。
目前,干细胞与多种化疗药在针对肿瘤的体内、外杀伤实验中已经取得了良好的协同式互作效应[17],但将hUMSC-CM 与TMZ 联用治疗胶质瘤的研究较少。本实验将hUMSC-CM 与TMZ配伍作用于胶质瘤细胞探讨其提高胶质瘤化疗敏感性的可行性。同时,为了明确该联合给药法是否对胶质瘤具有广谱性,本研究选用人星形细胞瘤U251 细胞、人胶质母细胞瘤LN-428 细胞和大鼠恶性胶质瘤RG-2 细胞3种胶质瘤细胞作为实验对象,利用细胞活力分析和病理形态学观察检测胶质瘤细胞系对TMZ的化疗敏感性差异。采用低、高两种浓度的hUMSC-CM 与低、中、高三种浓度的TMZ 配伍,作用于胶质瘤细胞,探讨联合给药的有效性。结果显示,利用3 和9 g/L hUMSC-CM 与50、100 和200 µmol/L TMZ 配伍给药,可显著抑制胶质瘤细胞活力且呈现剂量依赖性,其中RG-2细胞最敏感,其次是U251和LN-428细胞,进而筛选出C9+T50 作为有效配伍给药浓度。流式细胞术与TUNEL凋亡形态学结果表明,C9+T50可引起胶质瘤细胞周期阻滞并诱导凋亡发生。
近年来,关于GBM 的发病机制存在多种学说,如凋亡抑制[18-19]、细胞过度增殖等[20-21]。通过靶向调控GBM 细胞增殖和凋亡通路中的关键蛋白将有助于进一步发现治疗新靶点[22-23]。caspase-8/caspase-3/PARP1 通路被发现是影响多种肿瘤细胞增殖、凋亡及DNA 修复的重要信号转导通路之一[24-25]。其中,caspase-8 作为细胞凋亡发生的关键因子在人类胶质瘤中呈低表达,通过靶向上调caspase-8表达,或将成为治疗胶质瘤的新方向,且已有部分靶向药物取得了积极的效果[26]。而caspase-3 是caspase 家族中的核心蛋白,且被认为是细胞凋亡中最后的共同通道,在介导胶质瘤细胞凋亡的调控中也起到了重要作用[27]。PARP1 作为caspase-3 的底物与DNA 修复等有关。此外,自噬也参与了胶质瘤病理生理的重要调节过程。而关于自噬及其与hUMSC-CM 对胶质瘤细胞体外或体内敏感性的相关报道较少。为了探索hUMSC-CM 与TMZ 联合用药提高胶质瘤化疗敏感度的分子机制,本研究探讨了caspase-8/caspase-3/PARP1 信号通路及自噬蛋白beclin-1 和LC3 在其中的作用。结果表明,与单纯化疗组相比,C9+T50 可显著上调胶质瘤细胞内凋亡启动蛋白和凋亡执行蛋白的表达,增加PARP1 的剪切,诱导细胞凋亡,并通过上调自噬蛋白beclin-1 和LC3-II 的表达介导细胞发生自噬。后续研究需进一步分析hUMSC-CM 中细胞外囊泡中所含有的外泌体以及不同类型的细胞因子含量,探讨各种活性成分在调控具有不同病理生理学特征的胶质瘤增殖及诱导胶质瘤细胞凋亡和自噬中分别起到何种作用。
综上所述,hUMSC-CM 与TMZ 联用可能通过caspase-8/caspase-3/PARP1 信号通路抑制胶质瘤细胞活力,诱导细胞凋亡,并可促进细胞自噬发生,达到协同增敏式互作效应。后续需结合动物体内实验以深入探讨联合给药对GBM 生物学行为的影响。在多层次的实验基础上hUMSC-CM 联合化疗的综合方案将有潜力成为GBM治疗中重要的补充手段。
