乳酸菌和酵母菌复配发酵对羊肉香肠食用品质的影响
2024-04-03兰沁洁宋杰陈沫候伍加周娇裴慧洁邓霖杨勇
兰沁洁,宋杰,陈沫,候伍加,周娇,裴慧洁,邓霖,杨勇
(四川农业大学 食品学院,四川 雅安,625014)
羊肉是一种低脂肪、高蛋白、营养丰富的草食动物肉,在我国的生产量较大,具有良好的发展前景。目前,国内羊肉主要以鲜食为主[1],但随着消费习惯的不断变化,开拓羊肉制品的消费市场将具有较大的发展潜力。发酵香肠是一种风味独特、营养丰富、保质期长的典型发酵肉制品,因其特殊的风味,一直以来都深受广大消费者的喜爱。目前,国内外制作发酵香肠所使用的原料肉多为猪肉和牛肉,采用羊肉制作的传统发酵香肠因膻味较重,产品质构特性较差,消费者难以接受。另外传统发酵不可控因素多,易被污染。因此,降低发酵羊肉香肠的膻味、改善产品的咀嚼性、提高产品的整体可接受度、提升产品的食用安全性是扩大羊肉香肠消费市场的关键。
有研究表明,与羊膻味可能相关的物质有以下三类,一是中链脂肪酸,包括4-甲基辛酸、4-甲基己酸、4-甲基壬酸、己酸、辛酸和癸酸[2-4];二是长链脂肪酸,包括肉豆蔻酸、棕榈酸、硬脂酸和油酸[4-7];三是其他类物质,包括3-甲基吲哚、4-甲基苯酚等[2]。对于羊肉除膻,常采用添加香辛料掩盖、β-环糊精包埋和微生物发酵去除等方法[8-11]。其中,以微生物发酵除膻方便安全且有效,不仅能降低膻味,还能赋予羊肉一种独特的发酵风味。李秋桐[11]将从土壤和猪火腿中筛选得到的米曲霉TZH3、米根霉TZH4共同接种制作冷冻调理羊肉制品,感官结果表明接种组膻味降低;彭健斌[12]研究发现植物乳杆菌GIM1.191、戊糖片球菌GIM1.925、肉葡萄球菌GIMT1.955混合制作发酵羊肉脯,能够有效去除羊肉的膻味。利用微生物发酵去除羊肉膻味时,菌种的选择一直是一个难题,乳酸菌是发酵肉制品中重要的微生物菌群,对风味的形成有关键作用,而酵母菌在发酵过程中会产生乙醇,生成更多的酯类物质,有研究表明乳酸菌和酵母菌之间存在协同作用[13]。但是目前乳酸菌和酵母菌复配使用对羊肉香肠的膻味和品质的影响研究少见报道。
本研究采用前期从羊肉香肠中筛选得到的戊糖片球菌和近平滑假丝酵母复配发酵制作羊肉香肠,通过对基本理化指标、感官品质、脂肪酸、挥发性物质和生物胺含量的测定,探究复配接种对于羊肉香肠食用品质和膻味的影响,为获得食用品质佳、膻味轻的羊肉香肠提供理论依据。
1 材料与方法
1.1 材料与试剂
戊糖片球菌(L7)、近平滑假丝酵母(Y22),由本实验室前期从羊肉香肠中筛选鉴定得到;羊后腿肉、羊肠衣、猪肥膘、食盐、辣椒粉、花椒粉、十三香等调料,四川省雅安市雨城区苍坪山农贸市场;MRS培养基、YPD培养基、氯化钾、氢氧化钠、碳酸氢钠、正己烷、甲醇、氯仿等,成都浩搏优科技有限公司;组胺、酪胺标准品、丹磺酰氯等,美国Sigma公司;37种脂肪酸混合标准品,上海源叶生物科技有限公司;十一碳酸甲酯标准品,北京索莱宝科技有限公司。
1.2 仪器与设备
HD-3A智能水分活度测量仪,无锡市华科仪器仪表有限公司;PHS-3C pH计,上海仪电科学仪器股份有限公司;LC-2010CHT高效液相色谱仪,美国 Thermo Fisher Scientific公司;SC-80色差仪,北京康光仪器有限公司;TA.XT Expres质构仪,超技仪器有限公司;FOXα4000气味分析仪,法国Alpha M.O.S公司;Agilent 7890A/5975气相色谱-质谱联用仪,安捷伦科技有限公司。
1.3 实验方法
1.3.1 羊肉香肠的制作工艺
1.3.1.1 配方
参照巩洋[14]的配方,并做一定的改进。羊后腿肉80%、猪肥膘20%、食盐2.5%、白砂糖1%、辣椒粉1.3%、花椒粉0.4%、十三香0.05%、味精0.15%、葡萄糖0.1%、亚硝酸钠0.007 5%(均为质量分数)。
1.3.1.2 工艺流程
羊肉香肠制备工艺流程如下:
原料肉预处理→原、辅料混合→腌制→灌肠→发酵→成熟→干燥→成品
1.3.1.3 操作要点
参照巩洋[14]的制作工艺参数和预实验,做一定修改。
(1)原料肉预处理:选择经卫生检验合格的羊后腿肉和猪肥膘,清洗干净,沥干水分后切成小块;
(2)原、辅料混合:按照配方,加入各种配料,混合均匀;
(3)腌制:将混合均匀后的肉样于4 ℃冰箱中腌制4 h;
(4)接种发酵剂:将戊糖片球菌(L7)、近平滑假丝酵母(Y22)提前活化3次作为发酵剂,加入香肠肉馅中混匀,运用血球计数法计数,使得接种量为107CFU/g;
(5)灌肠:采用直径为20 mm的羊肠衣手动灌肠;
(6)发酵:将灌制好的羊肉香肠悬挂于恒温恒湿培养箱中进行发酵,设置条件:温度为20 ℃,相对湿度为75%,时间为2 d;
(7)成熟:温度为13 ℃,相对湿度为60%,时间为6 d;
(8)干燥:温度为55 ℃,时间为6 h。
1.3.2 实验分组
A组不接种发酵剂作为对照组;B组仅接种L7;C组仅接种Y22;D组接种复配比例为2∶1的L7和Y22,该接种比例是在前期预实验时,通过测定600 nm处的OD值所筛选出来的。
1.3.3 样品采集
取发酵羊肉香肠加工过程中的8个采样点:原料肉、腌制后、发酵第1天、发酵第2天、成熟第2天、成熟第4天、成熟第6天、干燥后。
1.3.4 基本理化指标的测定
1.3.4.1 水分活度的测定
参照GB 5009.238—2016《食品安全国家标准 食品水分活度的测定》中规定的水分活度仪扩散法。
1.3.4.2 水分含量的测定
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中规定的直接干燥法。
1.3.4.3 pH值的测定
参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》中规定的肉及肉制品中pH值的测定方法。
1.3.5 感官品质的测定
1.3.5.1 感官评价
将制作好的羊肉香肠于沸水中煮20~25 min,冷却后用刀切成2 mm左右的片状,由学院15名食品专业学生组成感官评定小组进行品尝评分,评分标准如表1所示。

表1 羊肉香肠感官评分表
1.3.5.2 色差
用全自动色差计测定样品的L*值、a*值和b*值。
1.3.5.3 质构
质构仪参数设定参照张楠[15]。探头P/5R;测量模式TPA;形变量50%;测前速度 2.00 mm/s;测中速度1.00 mm/s,测后速度5.00 mm/s;2次间隔3.00 s;触发自动;测定距离10.0 mm;触发力5.0 g。
1.3.5.4 气味
用电子鼻检测,检测参数参照张楠[15]:载气(零级空气)流速150 mL/min,顶空温度50 ℃,顶空时间300 s,进样体积0.15 mL,进样速度1.5 mL/s,数据采集时间120 s,延滞时间600 s。
1.3.5 游离脂肪酸含量的测定
参照GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》中规定的内标法。
1.3.6 挥发性物质的测定
参照刘英丽等[16]的方法,并稍作修改。
挥发性物质萃取:取5.0 g羊肉香肠绞碎,放于20 mL样品瓶中,60 ℃水浴30 min后将老化的萃取头插入样品瓶距离样品1 cm处,吸附30 min后取出,插入GC进样口,在250 ℃下吸附5 min,进行GC-MS测定。
GC-MS条件:VF-WAXms色谱柱(30 m×0.25 mm×0.25 μm),载气为氦气,流速1.0 mL/min,进样口温度250 ℃,升温程序:初始温度40 ℃,保持5 min,以2 ℃/min升温到80 ℃,保持1 min,再以4 ℃/min升温到200 ℃,保持5 min,不分流进样。离子源温度250 ℃,传输线温度250 ℃,质量扫描范围m/z33~450,溶剂延迟3 min。
定量方法:将未知化合物的质谱图与NIST11谱库中的质谱做对比,保留匹配度>80的化合物,通过峰面积归一化法计算挥发性成分的相对含量。
1.3.7 组胺和酪胺含量的测定
由于组胺和酪胺是发酵肉制品中毒性最强的生物胺,参照GB 5009.208—2016《食品安全国家标准 食品中生物胺的测定》中规定的液相色谱方法测定组胺和酪胺的含量。
1.4 数据处理
所有待测样品均平行测定3次,以平均值±标准差表示。采用IBM SPSS Statistics 27进行统计分析,并使用OriginPro 2021软件进行绘图。
2 结果与分析
2.1 基本理化指标的测定结果
2.1.1 水分活度的变化
水分活度(water activity,Aw)与微生物的生长密切相关,低水分活度能够抑制微生物的生长。从图1可以看出,在加工过程中,4组羊肉香肠的Aw均呈现下降趋势。成熟结束后,D组羊肉香肠的Aw显著低于A组(P<0.05),说明L7和Y22复配接种发酵能够降低加工过程中羊肉香肠的Aw,有助于抑制杂菌的生长,这与王德宝等[17]的研究结果是一致。经过55 ℃干燥后,由于高温导致Aw的迅速降低,4组羊肉香肠最终的Aw均低于0.70,且各组间差异不显著(P>0.05)。
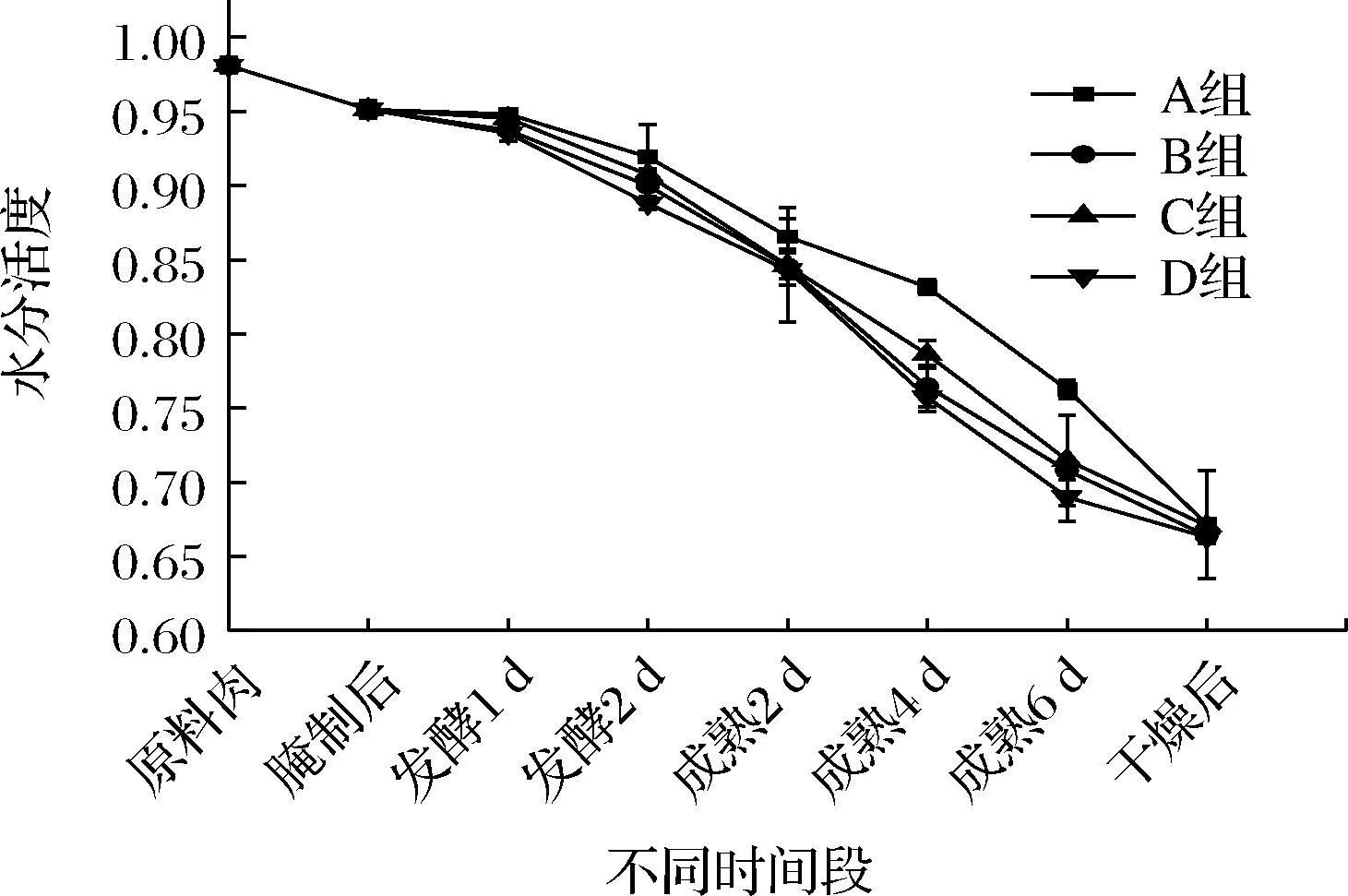
图1 羊肉香肠加工过程中水分活度的变化
2.1.2 水分含量的变化
4组羊肉香肠的水分含量变化情况如图2所示,都呈现先上升再下降的趋势。发酵1 d时,水分含量上升可能是因为培养箱的湿度较高。整个加工过程中,各组羊肉香肠的水分含量都迅速下降,可能是因为羊肠衣直径小,水分散失快。干燥后的4组羊肉香肠水分含量差异不显著(P>0.05)。
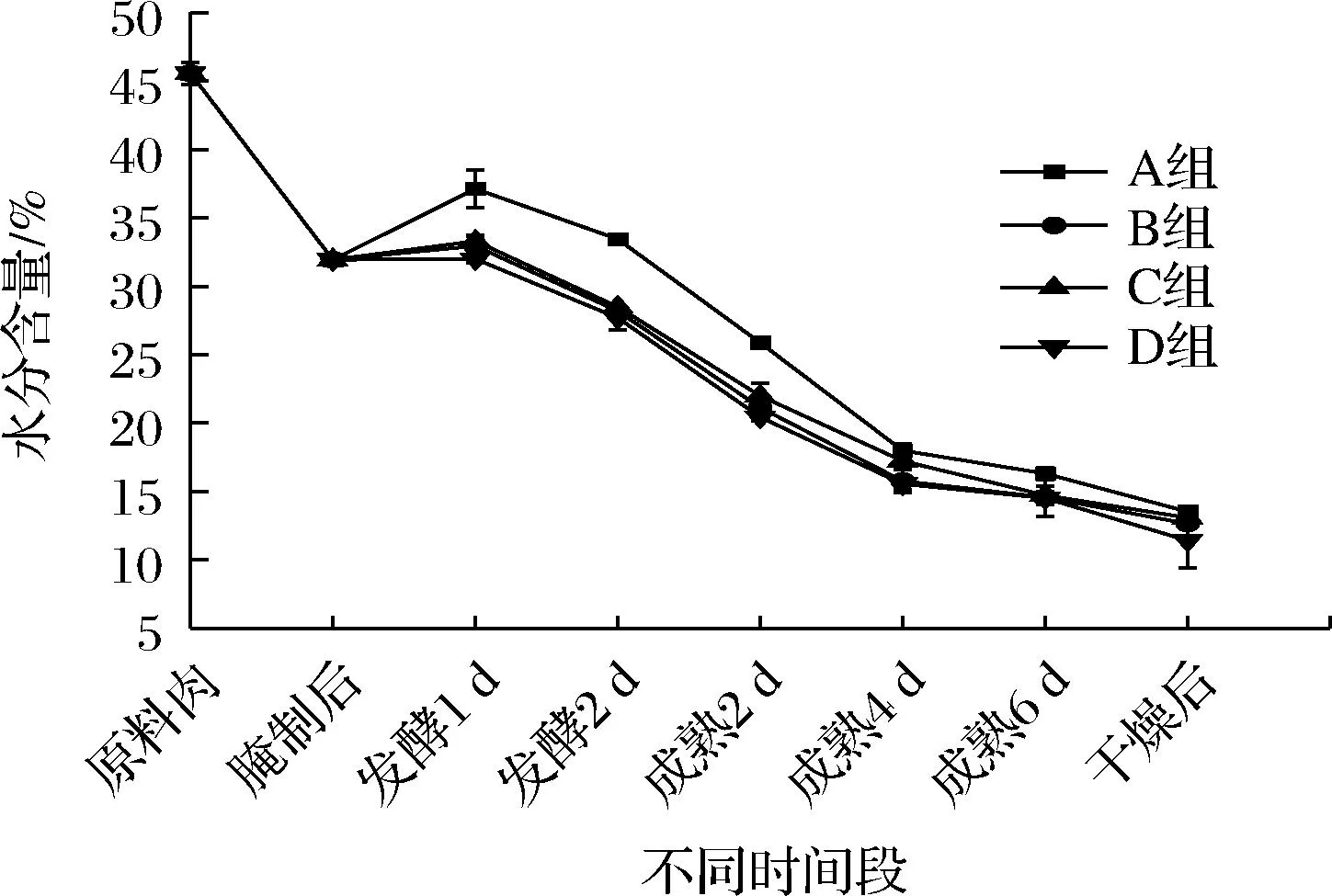
图2 羊肉香肠加工过程中水分含量的变化
2.1.3 pH值的变化
羊肉香肠在整个加工过程的pH值变化如图3所示,均是先下降再趋于平衡的趋势。最终,D组香肠的pH值显著低于其他3个组(P<0.05),为5.33±0.02,可能是因为乳酸菌和酵母菌之前存在某种协同作用,提高了乳酸菌的产酸能力。在55 ℃干燥后,4组香肠的pH值均有一点回升,可能是因为高温下产生一些碱性物质,中和了部分酸。巩洋[14]将植物乳杆菌、戊糖片球菌和葡萄球菌按1∶1∶1的比例混合发酵猪肉香肠,经干燥后,pH值同样地出现了略微上升的趋势。
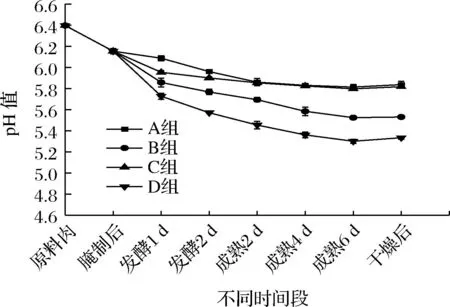
图3 羊肉香肠加工过程中pH值的变化
2.2 感官品质的测定结果
2.2.1 感官评价结果
4组羊肉香肠品质的感官评分结果见表2。香气方面,D组香气评分值为(20.75±1.75)分,显著高于A组的(13.75±2.60)分(P<0.05),D组羊肉香肠膻味最弱。说明复配接种发酵对羊肉的膻味有减除效果,这与李秋桐[11]的研究是一致的。而HOIKO等[10]利用嗜酸乳杆菌和动物双歧杆菌复配发酵羊肉香肠,通过感官评分发现能提升降低羊肉香肠的膻味,提升香气,但作用不显著(P>0.05)。感官评分总分方面,A组为(69.5±7.83)分,而D组为(88.5±5.28)分,显著高于A组(P<0.05)。可见,复配接种还能够提升羊肉香肠的色泽、组织结构等各方面的感官品质。同样地,LI等[18]将乳酸菌和葡萄球菌复配接种发酵香肠,结果表明感官评分得到了显著提高(P<0.05)。
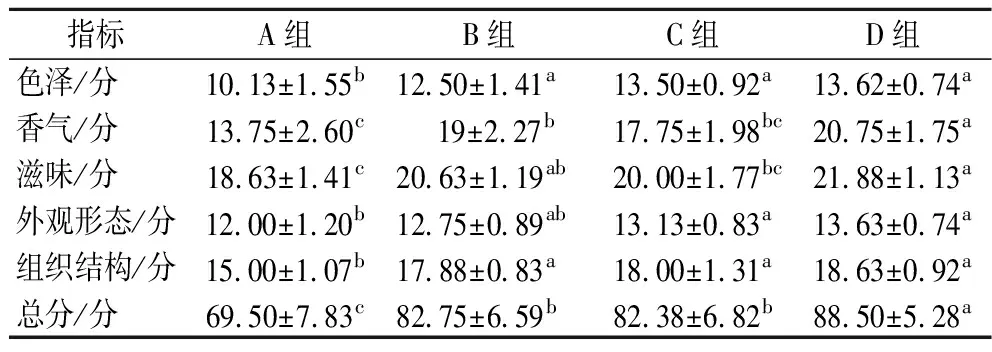
表2 感官评分结果
2.2.2 色差仪测定结果
羊肉香肠的色度值如图4所示,4组香肠均为亮度值(L*)>红度值(a*)>黄度值(b*),且3组接种了外源发酵剂的羊肉香肠B、C、D组的色度值均高于未接种的A组,其中,C组的红度值高于B组的红度值,这与感官评价C组比B组的颜色更玫瑰红是一致的。而D组的香肠的亮度值为35.65、红度值为17.30和黄度值为12.84均分别显著高于A组的亮度值29.76、红度值12.19、黄度值8.25(P<0.05)。说明复配接种L7和Y22能够提高羊肉香肠的外观品质。
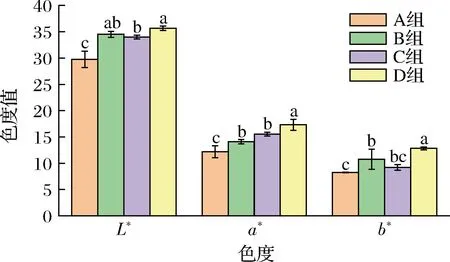
图4 羊肉香肠的色度值
2.2.3 质构仪测定结果
4组羊肉香肠成品的质构特性见表3。由表可知,接种发酵剂能够显著降低羊肉香肠的硬度、黏结性、黏性和咀嚼型,提升质构特性,这与张楠[15]的研究结果是一致的。其中,复配发酵组的降低程度更大,可能是因为乳酸菌和酵母菌存在某种协同作用,促进了生长,加速了蛋白质的消耗,使得硬度降低。乳酸菌和酵母菌复配接种提高了乳酸菌的产酸能力,加速了pH值的降低,从而加速蛋白质的降解、破坏蛋白质组织纤维结构,使得黏结性、黏性降低[19]。此外,D组羊肉香肠的恢复性显著高于A组(P<0.05),说明复配接种能够使羊肉香肠的口感更加柔和、细腻。
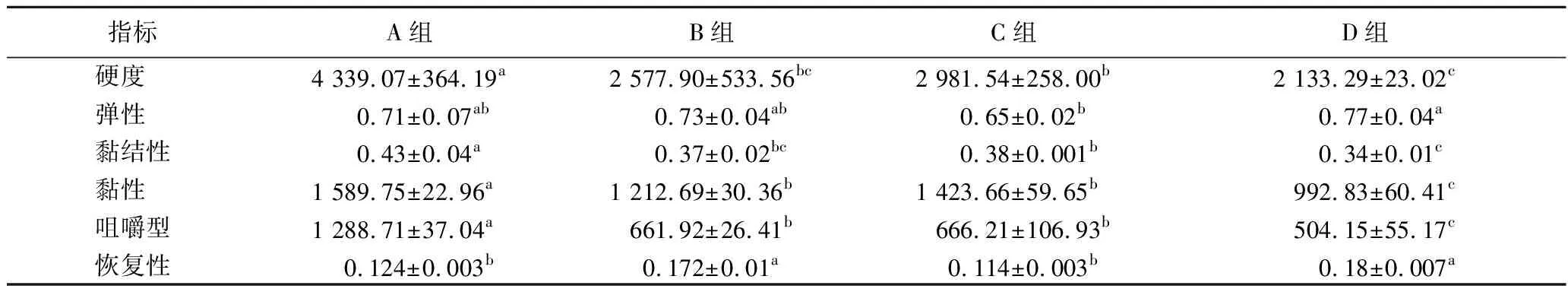
表3 羊肉香肠的质构特性
2.2.4 电子鼻测定结果
羊肉香肠的电子鼻PCA图如图5所示。
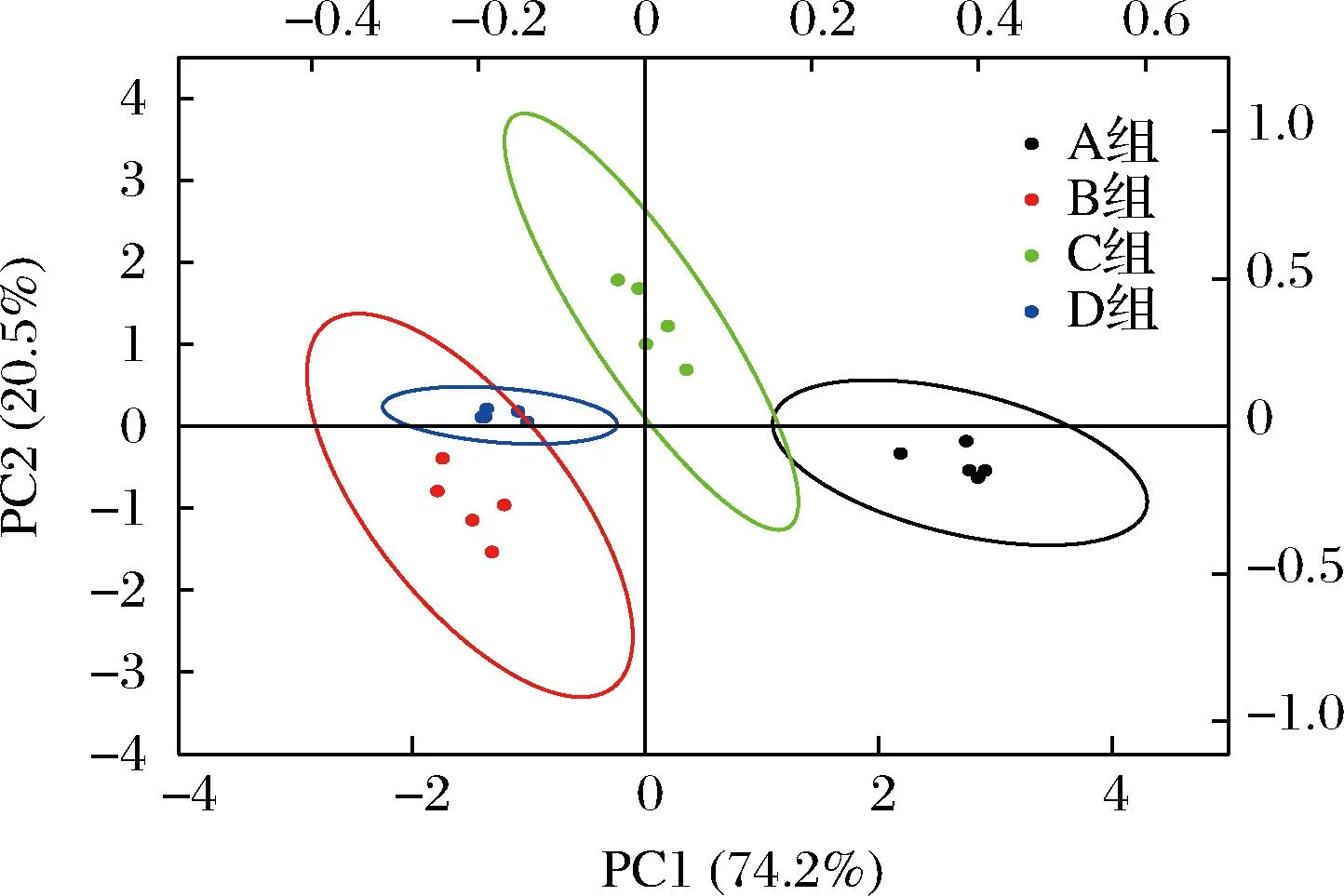
图5 羊肉香肠的电子鼻PCA图
由图5可知,A组和D组香肠的图形没有任何重叠之处,表明2组香肠的气味差异大,可能是因为接种复配菌株一是增加了羊肉香肠的风味,二是抑制了杂菌的生长,减少了不愉快气味的产生。
2.3 游离脂肪酸含量的变化
4组羊肉香肠在加工过程中游离脂肪酸含量的变化情况见附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.036037)。在本实验中,未检出中链和短链脂肪酸,可能是因为提取过程中的损失也可能是因为色谱柱的不匹配。在所检出脂肪酸中,饱和脂肪酸主要是棕榈酸(C16:0)和硬脂酸(C18:0),C16:0和C18:0是羊肉中占优势的饱和脂肪酸[20],而检出的不饱和脂肪酸主要是油酸(C18:1),C18:1是羊肉中发现的主要单不饱和脂肪酸[21],这与王德宝等[22]的研究结果也是一致的,油酸是香肠中风味物质的重要前体物质,在加工过程中会生成一些羰基类风味物质,会对羊肉香肠的风味产生影响。
对于干燥后的4组羊肉香肠而言,D组中的肉豆蔻酸(C14:0)、棕榈酸(C16:0)、硬脂酸(C18:0)和油酸(C18:1)的含量显著少于A组(P<0.05),有研究表明,这几种脂肪酸含量的增加会导致膻味强度的增加[4-7],而亚油酸(C18:2)含量多于A组,有研究显示增加多不饱和脂肪酸如C18:2的含量可以帮助降低羊肉气味,提高消费者的接受程度[6],这可能是D组香肠中膻味程度更低的原因。
2.4 挥发性物质的测定结果
羊肉香肠加工过程中挥发性物质的种类及相对含量的变化情况见附表2(https://doi.org/10.13995/j.cnki.11-1802/ts.036037),原料肉中检出的挥发性物质仅为18种,其中43.36%都为醇类物质。腌制后样品的物质增加到53种,萜烯类占比超过了50%。随着加工的进行,风味物质种类逐渐增加,其中D组羊肉香肠的挥发性物质种类数最多,这可能是造成电子鼻测定结果中,气味与对照组A组差异大的原因。JIANG等[23]以乳酸片球菌和米根霉为混合发酵剂,制作羊肉香肠,结果表明混合发酵有助于提高羊肉香肠中挥发性物质的种类,这与本实验结果是一致的。
4组香肠在各个加工阶段,共检出了126种挥发性物质,其中45种对羊肉香肠风味影响相对较大,相对含量较高的挥发性成分在加工过程中的变化情况见附表3(https://doi.org/10.13995/j.cnki.11-1802/ts.036037)。醇类物质中,占比最大的是芳樟醇,主要来源于香辛料。醛类物质中,占比最大的是己醛,来自于脂肪酸的氧化降解,大量的己醛会给肉制品带来不愉快的味道。经干燥后D组己醛的相对含量最低,说明复配发酵能够减少香肠的不良气味。酮类物质和酸类物质的相对含量都比较少,其中3-羟基-2丁酮仅在B组和D组中检出,并且在D组中的相对含量更高。3-羟基-2-丁酮又称乙偶姻,具有清香味奶香味,主要由葡萄糖代谢产生的二乙酸转化而来[24]。说明L7和Y22复配接种会增加羊肉香肠中3-羟基-2丁酮的含量,有助于提升风味。酯类物质是促进香肠风味形成的重要物质,总共在4组羊肉香肠中检出了22类酯类物质,含量最高的是乙酸芳樟酯。D组酯类物质种类和相对含量在加工过程中一直高于其他3个组,可能是因为两株菌间存在相互促进作用,导致了乳酸菌产酸,酵母菌产醇量的增加,从而生成了更多的酯类物质,增加了香肠的风味。萜烯类物质中,相对含量最高的均为右旋萜二烯,与腌制后的检出结果一致。烷烃类及衍生物在整个加工过程中相对含量都很低,这类物质阈值高,对香肠风味的影响较小。在芳香族及其衍生物中,占比最高的是茴香脑,具有茴香味,主要来自于香辛料。
对于干燥后的4组羊肉香肠,D组香肠中的己醛、辛醛、壬醛的相对含量低于A组,有研究表明壬醛、辛醛、己醛等短链脂肪醛是羊肉主要的醛类特征风味物质[25]。复配发酵羊肉香肠膻味的减轻可能与这几种醛含量的减少有关。D组香肠中的己酸乙酯、辛酸乙酯、癸酸乙酯相对含量显著高于A组(P<0.05),这是因为羊肉中的与膻味相关的中短链脂肪酸[2-4]己酸(C6:0)、辛酸(C8:0)、癸酸(C10:0)经加工过程后与醇类物质发生了反应,从而使得膻味得到了减轻。
2.5 组胺和酪胺含量的变化
由于组胺和酪胺是发酵肉制品中最常见且毒性最强的生物胺,为确保羊肉香肠的安全性,本研究只测定了组胺和酪胺的含量。羊肉香肠加工过程中组胺含量的变化见图6-a,酪胺含量的变化见图6-b。A、B、C、D 4组香肠的组胺和酪胺含量变化趋势是一致的,随着加工的进行,含量逐渐增加。在原料肉和腌制后均未检测到组胺和酪胺,说明原料肉中组胺和酪胺含量很低,腌制时不仅在低温下进行,还伴有很多香辛料,抑制了产胺微生物的活性。D组香肠中组胺和酪胺的含量均显著低于A组(P<0.05),可能是因为D组羊肉香肠中L7和Y22成为优势菌株,抑制杂菌的生长,并且pH值最低,使得部分产胺微生物的活性受到了抑制。干燥结束后,D组的组胺含量仅为(5.13±0.06) mg/kg,较A组降低了9.36%,酪胺含量仅为(3.01±0.01) mg/kg,较A组降低了20.97%,说明复配接种发酵可以降低香肠中组胺和酪胺的含量,提高其安全性,这与孙学颖等[26]的研究结果也是一致的。
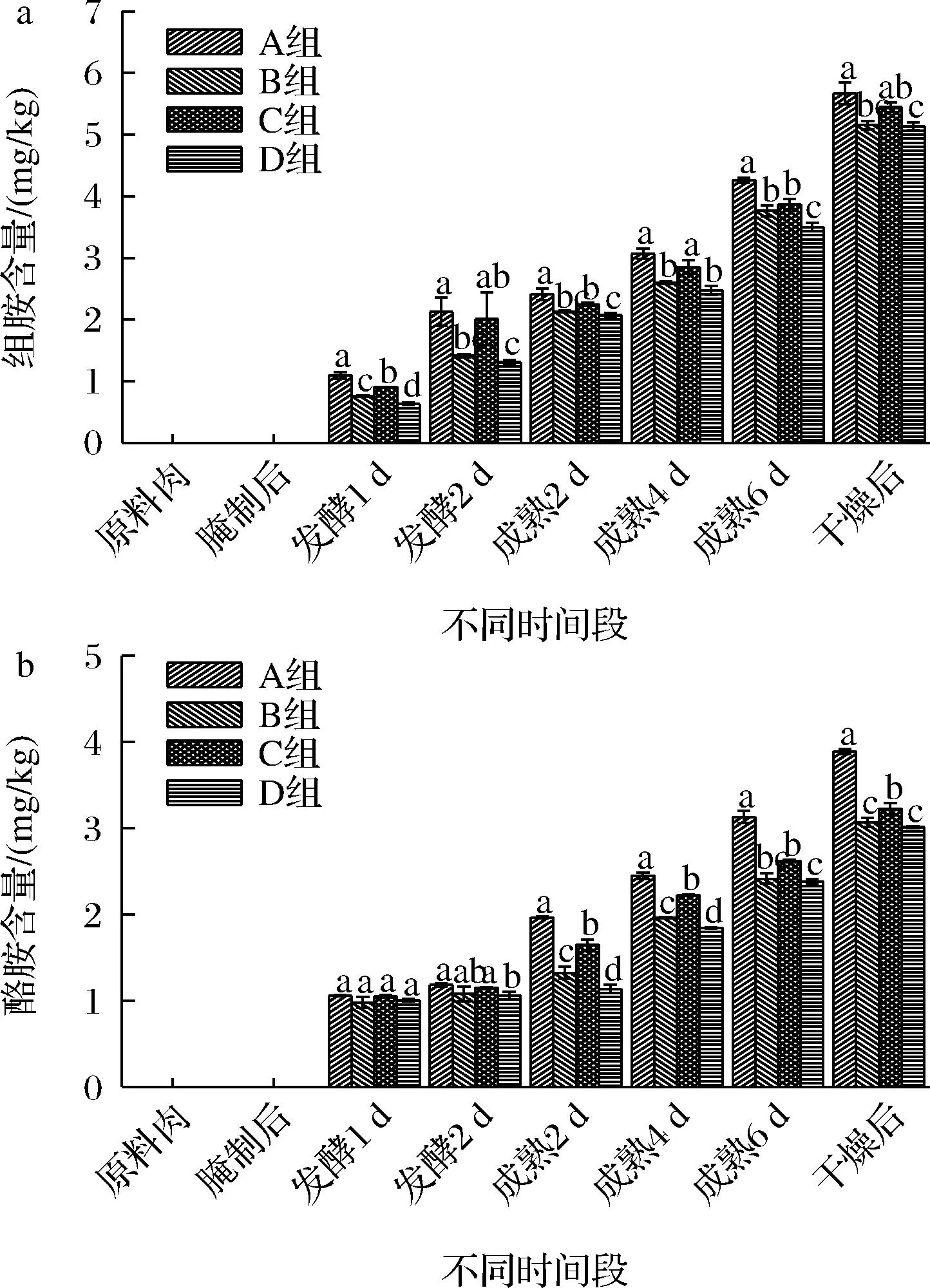
a-组胺含量的变化;b-酪胺含量的变化
本研究检出的组胺含量和酪胺含量均低于孙霞等[27]测定30种市售四川猪肉香肠得到的组胺平均值182.69 mg/kg和酪胺平均值176.93 mg/kg。一是因为本研究使用的原料肉是羊肉,羊肉中的饱和脂肪酸多于猪肉,不易发生脂肪氧化,减少了组胺和酪胺的积累[28];二是本研究是在恒温恒湿培养箱中进行香肠发酵的,能够减少羊肉香肠加工过程中所受到的污染;三是整个加工过程时间不长,组胺和酪胺的含量还在缓慢积累中;四是本研究使用的肠衣直径小,有研究表明小直径的肠衣可以降低香肠中生物胺的含量[29]。
3 结论
本研究将前期从羊肉香肠中筛选得到的戊糖片球菌L7和近平滑假丝酵母Y22以2∶1的比例接种发酵羊肉香肠,设置了空白接种对照组和单菌接种对照组,结果表明复配接种能显著降低羊肉香肠pH值,提升感官评分值、色度值、质构特性及挥发性物质的种类和相对含量,提升风味。复配接种还能够降低了与羊肉膻味相关的肉豆蔻酸(C14:0)、棕榈酸(C16:0)、硬脂酸(C18:0)和油酸(C18:1)的含量以及己醛、辛醛、壬醛的相对含量,提升了亚油酸(C18:2)的含量以及己酸乙酯、辛酸乙酯、癸酸乙酯的相对含量,减轻了羊肉香肠中的膻味。L7和Y22之间存在协同作用,复配发酵能使得羊肉香肠加工过程中产生更多的风味物质,对膻味起到掩盖作用,从而使得羊肉香肠中的膻味得到了进一步的减轻。羊肉香肠经干燥后,复配接种组中的组胺含量和酪胺含量较空白对照组显著降低(P<0.05)。相较于自然发酵和单菌发酵,乳酸菌和酵母菌复配接种发酵羊肉香肠能够更大程度地降低羊肉香肠的膻味,提高羊肉香肠的食用品质,提高羊肉香肠的整体可接受度和食用安全性。在之后的研究中,可以进一步探究酵母菌与乳酸菌协同生长的机理以及两者同时接种减除羊肉膻味的机理。
