尘螨诱导特应性皮炎小鼠模型和哮喘小鼠模型的构建
2024-04-02罗承慧高江瑞陈俊威魏春洁韦双双裴业春
罗承慧,高江瑞,陈俊威,魏春洁,韦双双,2*,裴业春,2*
(1.海南大学生命科学学院,海口 570228;2.海南大学全健康研究院,海口 570228)
过敏性疾病指以IgE介导的Ⅰ型变态反应为主要发病机制的疾病,包括特应性皮炎、食物过敏、过敏性鼻炎及过敏性哮喘等。随着过敏性疾病在世界范围内的发病率增加,人们对该疾病的关注度也越来越高。特应性皮炎(atopic dermatitis, AD)是皮肤科常见的慢性过敏性疾病,近三十年以来患病率呈持续增长趋势[1]。本病病因复杂,研究者对AD病因大致归结为遗传因素、感染性因素、变应原、心理因素等[2]。研究表明,吸入性变应原尤其是尘螨(dust mite,DM)是人和动物AD的一个重要诱因。尘螨诱发的过敏反应大致分为皮肤螨病和体内螨病,前者包括特应性皮炎(AD)、慢性荨麻疹、痤疮、酒糟鼻、疥疮和螨脓肿等疾病[3];后者主要包括过敏性鼻炎、过敏性哮喘、尿螨病、肺螨病、肠螨病以及其他系统螨病[4]。尘螨引起AD的途径主要有两个:通过破坏皮肤屏障直接引起;通过内在性吸入尘螨过敏原引起[5],这也解释了AD患者往往伴随有哮喘和过敏性鼻炎等其他过敏性疾病的原因。尘螨引起的AD可以通过减少和避免接触尘螨使AD的临床症状得到改善。哮喘是常见过敏性疾病之一,是一种以嗜酸性粒细胞、淋巴细胞等多种炎性细胞浸润、气道狭窄、气道高反应性以及黏液分泌增加为主要特征的气道慢性变应性炎症。多项研究表明IgE水平升高在过敏性哮喘、变应性鼻炎等特应性疾病中最具特征性,是诊断哮喘与气道高反应性的重要参考指标,高水平IgE被认为是在非过敏性哮喘中的危险因素。AD患者中,95%患者血清中尘螨过敏原抗体IgE阳性,这一比例在哮喘患者中为42%[6]。犬特异性皮炎(CAD)是一种遗传易感的炎症性和瘙痒性过敏性皮肤病,与产生针对环境过敏原(主要是螨虫和花粉)的IgE抗体有关[7-9]。患有AD的犬具有各种临床症状,具体取决于疾病的阶段(急性或慢性)、遗传因素、病变的严重程度和继发感染的存在,并且可能因具有类似症状的其他皮肤病而进一步复杂化[10]。兽医临床上有报道犬过敏的案例[11]。同样一项关于马来西亚患有皮肤病的犬常见过敏原血清学调查显示,52.9%的犬对螨虫血清反应呈阳性,这表明螨虫是马来西亚犬的主要过敏原[12]。屋尘螨(Dermatophgoidespteronyssinus, Der p)是导致犬超敏反应的主要过敏原,影响30%~100% CAD患犬[13]。来自日本的一项研究表明,经动物医院诊断患有CAD的15只犬中,8只显示出屋尘螨特异性IgE[14]。对粉尘螨(Dermatophagoidesfarinae, Der f)过敏原的致敏在患有AD的犬中很常见,日本的一项研究首次证明了这种Der f 2过敏原在患有特应性皮炎的犬身上的重要性,1999年,16只患有AD的犬中所有的犬都有抗Der f IgE,11只有抗Der p IgE[15];2002年,90只患有AD的犬中有75%对Der f 2呈阳性[16]。近年来,多项研究发现:西班牙、英国和马来西亚分别有100%、97%和48.4%的犬对Der f 2产生了IgE[17-19]。2016年,有研究表明,在巴西患有AD犬的血清中,使用犬IgE单克隆抗体进行免疫印迹检测,结果显示粉尘螨的低分子量过敏原的患病率很高,这项研究的结果表明,100%的血清识别条带在21~31 ku,可能是Der f 1[20]。热带无爪螨(Blomiatropicalis,Blo t)也称热带螨,其变应原同样可诱导动物产生过敏反应,研究表明皮试试验中发现过敏犬阳性的致敏原主要是热带螨[21]。
经典的Th1/Th2细胞亚群失衡已被认为是AD发病的主要机制,AD的炎症介质表达为双向模式,即急性期炎症表达为Th2细胞因子(如IL-10),慢性期炎症表达为Th1细胞因子(如IFN-γ和IL-12)[22-23]。研究表明,屋尘螨诱发AD患者的发病进程分为两个阶段,初期主要以Th2占优势的免疫应答,产生IL-4、IL-5、IL-13,在随后的24~48 h,则是以产生IFN-γ为主的Th1占优势的免疫应答[24]。IL-4具有广泛的生物学功能,其中IL-4诱导B细胞合成IgE可能在AD的发生发展中有重要作用。研究表明,在特应性皮炎的模型中,病变组织中的IL-4水平明显高于正常组织,证实IL-4与AD相关[25]。IL-10是一种Th2型细胞因子,生物学功能多样,可抑制炎症细胞因子的产生,抑制Th1细胞分泌IFN-γ和IL-2。研究发现小鼠体内IL-10水平在AD皮损中的表达增高,因此认为IL-10可能是AD发病的一个重要因素[26]。但后来有研究显示AD患者皮损及外周血中也有Th17细胞存在,并且该细胞分泌的IL-17表达也增高。IL-17可以诱导促炎因子的分泌,参与中性粒细胞、T细胞及树突状细胞的分化、成熟。因此认为Th17细胞可能参与AD的发病,但机制仍不明确。
本文利用3种尘螨(屋尘螨、粉尘螨、热带无爪螨)的主要变应原Der p 1、Der f 1、Blo t 5等比例混合对小鼠进行致敏,旨在构建尘螨诱导的特应性皮炎模型和哮喘模型,为开发和评价尘螨过敏症防治型疫苗提供过敏小鼠模型。
1 材料与方法
1.1 材料
1.1.1 实验动物 4~8周龄健康的雌性BALB/c小鼠购自广东省医学实验动物中心,饲养于海南大学动物房,保持在特定的无病原体条件下饲养,食物和垫料均为SPF级。所有动物试验均严格按照海南大学实验动物福利与伦理要求,并经海南大学动物伦理委员会批准。
1.1.2 菌株、载体和试剂 大肠杆菌(E.coli)DH5α感受态细胞、BL-21(DE3)感受态细胞均购自生工生物工程(上海)股份有限公司;PQE-80L-Der p 1、PQE-80L-Der f 1、PET-28a-Blo t 5原核表达载体均由海南大学生命科学院生物技术制药与分子药理学实验室保存;IFN-γ(货号:MM-0182M1)、IL-4(货号:MM-0165M1)、IL-10(货号:MM-0167M1)、IL-17A(货号:MM-0759M1)ELISA试剂盒均购自江苏酶免实业有限公司;Goat pAb to Mouse IgE(货号:ab19967)购自Abcam公司;ELISA酶标板(货号:F605031)、EL-TMB显色试剂盒(货号:C520026)、HRP-conjugated Goat Anti-Rabbit IgG(货号:D110058)购自生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1 特应性皮炎小鼠模型的诱导 将小鼠随机分2组,分别为正常组(Naive)、特应性皮炎组(AD),每组小鼠各6只。参照文献[27、28]方法制备AD模型,并根据实际情况作出修改:试验前剔除小鼠背部毛发,面积约为3 cm×3 cm,将均为1 mg·mL-1的尘螨主要变应原Der p 1、Der f 1、Blo t 5等比混合作为过敏原对小鼠进行致敏造模。第1天对模型组腹腔注射100 μg·只-1(含5%明矾)尘螨主要变应原,第6天在小鼠背部皮下注射100 μg·只-1尘螨变应原,第18、21、24、27天用毛刷在小鼠背部剔除毛发处刷出轻微小裂口,并取50 μg变应原于1 cm2正方形滤纸片上,贴于小鼠背部皮肤,再用保鲜膜覆盖防止挥发,外缠黏性的弹力绷带,第30~44天背部贴敷连续两周,2 d·次-1,50 μg·只-1。第46天麻醉后处死小鼠,进行后续检测。正常组以PBS替代变应原。处死小鼠前取眼眶血,用于IgE水平检测。
1.2.2 哮喘小鼠模型的诱导 小鼠分别分为正常组(Naïve)、哮喘组(Asthma)2组,每组小鼠6只。哮喘模型造模方法:用浓度均为1 mg·mL-1的 Der p 1、Der f 1、Blo t 5等比混合作为变应原致敏小鼠,变应原用量均为100 μL·只-1。第0、7天用1 mg·mL-1尘螨变应原混合液1 mL与50 mg铝佐剂混合,室温下震荡2 h,分别对哮喘模型组进行腹腔注射,共两次。第14、16、18天用100 μL·只-1变应原混合液对小鼠进行灌肺,共3次,灌肺后隔1 d采眼眶血,用于ELISA法检测IgE水平,第25天用变应原混合液对小鼠尾静脉注射进行变应原免疫激发,100 μL·只-1,0 min时记录体温,注射后每隔5 min记录一次体温变化,计时90 min。第32天小鼠尾静脉注射200 μL·只-10.5%伊文思蓝(Evans blue)进行耳朵点刺试验,30 min后将小鼠麻醉,用23 G刺血针刺穿耳朵皮肤,并滴上一滴约20 μL变应原混合液(500 μg·mL-1),1 h后麻醉处死小鼠,取肺进行HE染色。
1.2.3 AD小鼠致敏皮肤炎症的观察 致敏皮肤组织皮损情况观察,即处死小鼠后,对小鼠背部致敏区域皮肤组织进行拍照,观察小鼠背部致敏皮肤表面是否出现红斑、破损及结痂等过敏现象。
1.2.4 ELISA法检测皮损细胞因子和小鼠血清总IgE 在特应性皮炎小鼠模型诱导中,取致敏区域部分皮肤组织剪碎后加入适量PBS或研磨液经研磨仪研磨,离心取上清检测蛋白浓度,将所有样品调至统一蛋白浓度400 μg·mL-1进行ELISA试验,检测IL-10、IL-4、IL-17A、IFN-γ四种细胞因子水平。
在特应性皮炎小鼠模型诱导中,将肺组织剪碎后经研磨仪研磨离心取上清,离心取上清检测蛋白浓度,将所有样品调至统一蛋白浓度300 μg·mL-1,ELISA检测IL-10、IL-4、IL-17A、IFN-γ细胞因子水平。
ELISA检测细胞因子水平:设置标准品孔和样本孔,标准品孔加梯度稀释好的标准品各50 μL,样品孔先加样品稀释液40 μL,后加待测样品10 μL(样品最终稀释度为5倍),封板膜封板后37 ℃孵育30 min,弃去液体吸水纸拍干后每孔加满洗涤液,静置30 s,重复5次。每孔加酶标试剂50 μL,封板膜封板后37 ℃温育30 min,同样洗涤5次。每孔加显色剂A液50 μL,再加显色剂B液50 μL,轻轻震荡混匀后37 ℃避光孵育10 min。每孔加终止液50 μL,15 min内于450 nm波长处测定各孔吸光度(OD值)。
小鼠处死前取眼眶血,静置过夜后,10 000 r·min-1,4 ℃,离心10 min,收集上清,ELISA检测小鼠血清中总IgE水平。
ELISA检测血清总IgE水平:将浓度均为30 μg·mL-1的Der p 1、Der f 1、Blo t 5蛋白液等体积混合后作为抗原(100 μL·孔-1)包被96孔高吸附酶标板,3个空白孔用等量包被缓冲液代替蛋白液,封板膜封板后4 ℃静置过夜。除去酶标板中包被液后PBST洗涤并于吸水纸上拍干,重复洗涤5~8次,每孔加100 μL 5%脱脂奶粉,封板膜封板后37 ℃封闭1 h。弃去包被液,吸水纸上拍干,并用PBST洗涤液重复洗涤5~8次。每孔加100 μL待测小鼠血清(稀释5倍),每个样品重复3次,封板膜封板后,37 ℃孵育2 h。弃去样品液,进行上述同样洗涤操作。每孔加羊抗鼠的IgE抗体(1∶3 000),100 μL·孔-1,封板膜封板后37 ℃孵育2 h。弃去包被液洗涤后每孔加HRP偶联的兔抗羊IgG(1∶5 000),100 μL·孔-1,封板膜封板后37 ℃孵育1~2 h。弃去包被液洗涤后拍干,每孔加TMB显色液100 μL,37 ℃避光孵育15 min,每孔加终止液50 μL,15 min内于450 nm波长处测定各孔吸光值(OD值)。
1.2.5 哮喘小鼠应激性过敏反应的检测 将浓度均为500 μg·mL-1的Der p 1、Der f 1、Blo t 5三种尘螨变应原按体积比1∶1∶1混合后作为过敏原注射到过敏模型小鼠尾静脉中,100 μL·只-1,从0 min开始每隔5 min记录一次体温,计时90 min。绘制体温变化曲线,体温变化曲线所围成面积采用One-Way ANOVA统计分析,以P<0.05为差异显著性判断标准。
1.2.6 哮喘小鼠耳朵点刺试验 对小鼠尾静脉注射200 μL·只-10.5%伊文思蓝,30 min后将小鼠麻醉,用23G刺血针刺穿耳朵皮肤,在同样位置滴上一滴约20 μL尘螨变应原混合液(500 μg·mL-1),抗原攻击后,小鼠耳部的点刺部位的染料开始外渗,1 h后麻醉处死小鼠,用密度法检测小鼠耳朵的染料渗漏情况,结合小鼠耳朵的染料渗漏面积和染色密度计算每组小鼠耳朵的染料渗漏净强度。
1.2.7 哮喘小鼠肺部组织切片HE染色 小鼠耳朵点刺后处死,取出肺部组织保存于4%多聚甲醛固定液中,进行HE染色观察肺部组织炎症浸润情况。肺组织HE染色的炎症打分标准:以0~3分标准来评价支气管周围炎症的程度[29]。0分,没有炎症细胞浸润;1分,支气管周围偶尔出现炎症细胞;2分,大多数支气管包围者1~5层炎症细胞薄层;3分,大多数支气管周围环绕超过5层细胞厚度的炎症细胞。
1.2.8 统计学处理 数据的统计分析采用Graphpad 6.02软件完成,采用t检验进行统计分析。
2 结 果
2.1 AD小鼠致敏区域皮肤组织表面皮损观察与细胞因子检测
按图1A对小鼠致敏结束后,对小鼠背部致敏区域皮肤进行拍照观察皮肤表面皮损情况,结果如图1B显示,正常组(Naïve)小鼠背部致敏皮肤区域未见红斑、破损及结痂等过敏现象,尘螨混合变应原AD模型组背部致敏皮肤区域皮肤出现泛红和皮肤破损后的结痂现象。表明尘螨变应原使小鼠发生了较严重的皮炎症状。剪取小鼠背部致敏区域皮肤,经研磨仪研磨后进行ELISA试验,检测IFN-γ、IL-4、IL-10、IL-17A细胞因子水平,结果如图1C~F所示,AD模型组的IFN-γ水平较正常组(Naïve)呈降低趋势,IL-4、IL-10、IL-17A水平增加,且IL-10、IL-17A水平显著增加,说明模型组小鼠皮损中发生了Th1/Th2失衡,且为偏向Th2和Th17的反应。
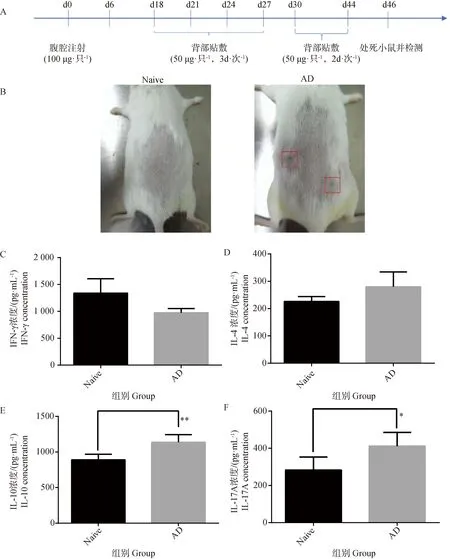
A. AD造模流程图;B. 小鼠皮损观察;C. IFN-γ水平;D. IL-4水平;E. IL-10水平;F. IL-17A水平。Naïve. 正常组;AD. 特应性皮炎组(红色框为皮损结痂)。结果以表示 (n=4)。*. P<0.05,**.P<0.01A. Flow chart of AD modeling; B. Observation of skin lesions in mice; C. IFN-γ levels; D. IL-4 levels; E. IL-10 levels; F. IL-17A levels. Naïve. Normal group; AD. Atopic dermatitis group (red boxes are lesion crusts). Results are expressed as (n=4). *. P<0.05, **. P<0.01
2.2 AD小鼠肺组织细胞因子的检测
对处死后的小鼠,取其肺组织加入研磨液经研磨仪研磨后,取上清进行肺组织细胞因子IFN-γ、IL-4、IL-10、IL-17A水平进行检测,结果如图2所示,AD模型组的IFN-γ、IL-4、IL-10、IL-17A水平均较正常组升高,其中IFN-γ、IL-10、IL-17A水平呈显著升高,说明在特应性皮炎小鼠的肺组织中,Th1/Th2平衡、Treg/Th17平衡可能会发生改变,进而可能会诱导肺部发生过敏反应。
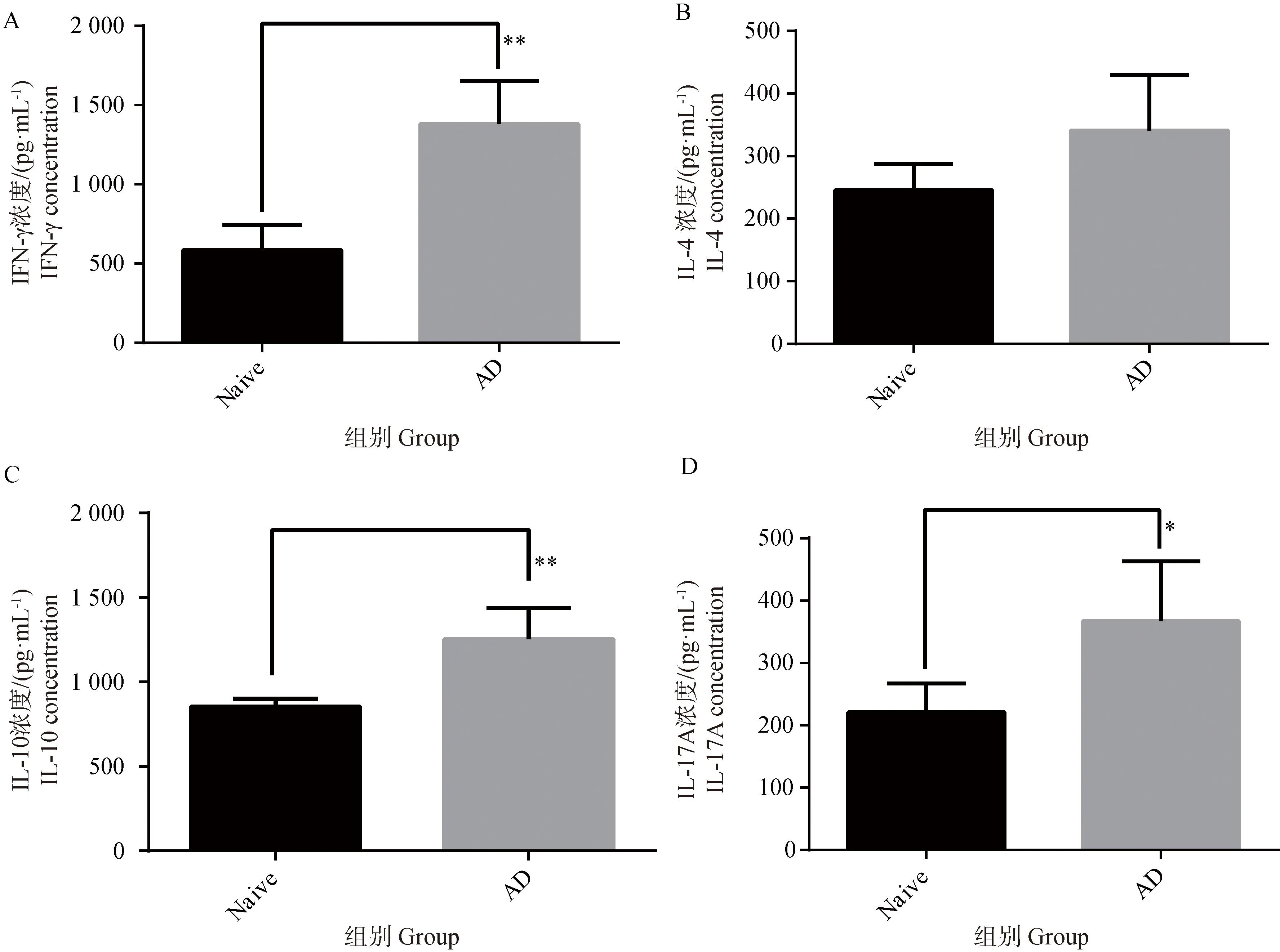
A. 肺组织IFN-γ水平;B. 肺组织IL-4水平;C. 肺组织IL-10水平;D. 肺组织IL-17A。Naïve. 正常组;AD. 特应性皮炎组。结果以表示 (n=4)。*. P<0.05,**.P<0.01A. Lung tissue IFN-γ levels; B. Lung tissue IL-4 levels; C. Lung tissue IL-10 levels; D. Lung tissue IL-17A. Naïve. Normal group; AD. Atopic dermatitis group. Results are expressed as (n=4). *. P<0.05, **. P<0.01
2.3 ELISA检测AD小鼠血清总IgE水平
IgE是特应性皮炎中一个重要的指标,IgE水平的升高是特应性皮炎发生的一个重要因素,通过ELISA检测小鼠血清总IgE水平,结果如图3所示,AD模型小鼠血清总IgE水平显著高于正常组,表明小鼠体内偏向过敏反应。
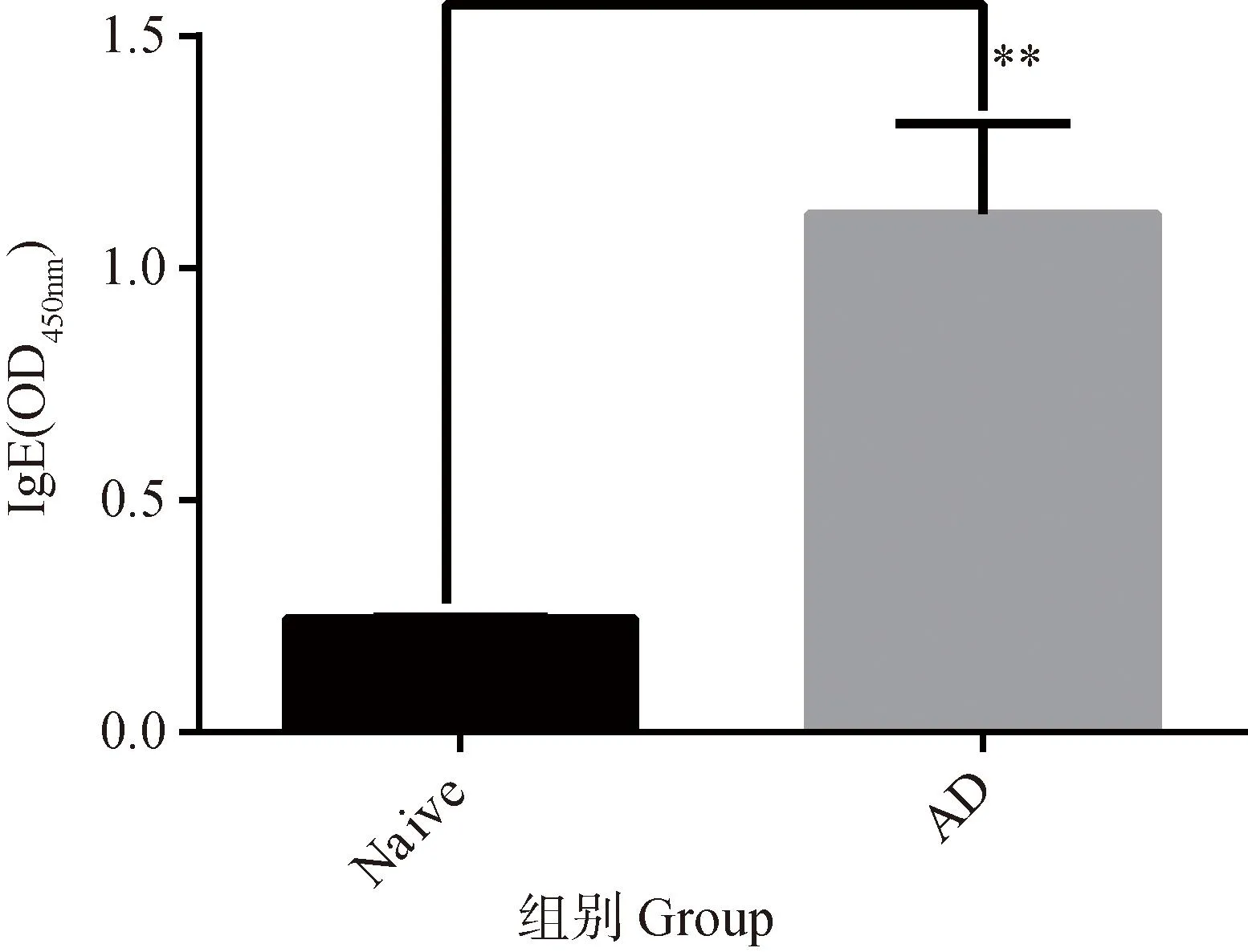
Naïve. 正常组;AD. 特应性皮炎组。结果以表示 (n=4)。*. P<0.05,**.P<0.01Naïve. Normal group; AD. Atopic dermatitis group. Results are expressed as (n=4). *. P<0.05, **. P<0.01
2.4 哮喘小鼠应激性过敏反应检测及ELISA检测血清总IgE水平
按照图4A进行哮喘模型造模后,进行小鼠尾静脉注射变应原激发,从0 min开始,隔5 min记录一次体温,结果如图4B、C所示,小鼠变应原激发后,哮喘模型组(Asthma)体温较正常组(Naïve)显著降低。IgE是哮喘过敏中一个重要指标,ELISA检测小鼠血清中IgE水平,结果如图4D显示,哮喘模型组小鼠IgE水平较正常组显著升高,表明小鼠体内偏向过敏反应。
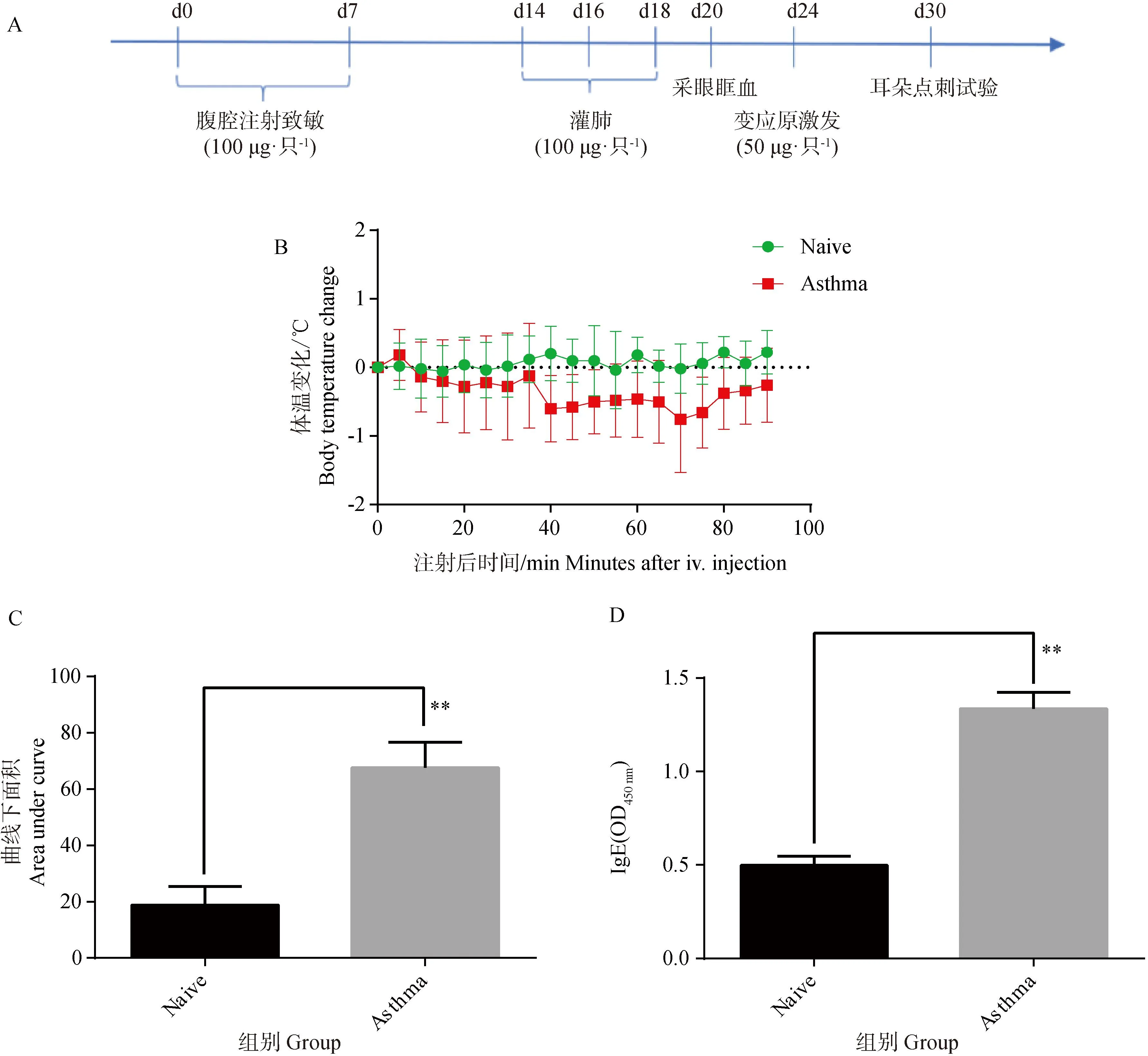
A. 哮喘模型造模流程图;B. 变应原激发小鼠体温变化曲线图;C. 温度变化曲线下面积图;D. IgE水平。Naïve. 正常组;Asthma. 哮喘模型组。结果以表示 (n=4)。*. P<0.05,**.P<0.01A. Flow diagram of asthma modeling; B. Plot of temperature change in allergen-primed mice; C. Plot of area under temperature change curve; D. IgE levels. Naïve. Normal group; Asthma. Asthmamodel group. Results are expressed as (n=4). *. P<0.05, **. P<0.01
2.5 哮喘小鼠耳朵点刺试验
小鼠尾静脉注射Evans Blue染料30 min后对小鼠进行耳朵点刺,并于点刺处滴一定量变应原,1 h后处死小鼠,并对耳朵染料渗出的情况进行拍照观察。通过计算染料渗出的荧光强度判断小鼠过敏情况,结果如图5A、B所示,哮喘模型组小鼠耳朵染料渗出荧光强度显著高于正常组,说明小鼠体内偏向过敏反应。
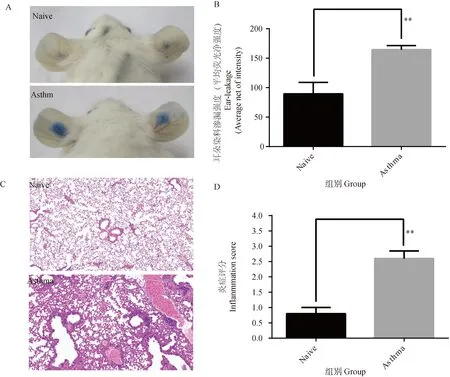
A. 小鼠耳朵点刺染料渗出图(4×);B. 小鼠耳朵染料渗漏强度统计图;C. 肺HE染色(100 μm);D. 肺HE染色评分图。Naïve. 正常组;Asthma. 哮喘模型组。结果以表示 (n=4)。*. P<0.05,**.P<0.01A. Mouse ear puncture dye leakage graph (4×); B. Mouse ear dye leakage intensity statistics graph; C. Lung HE staining (100 μm); D. Lung HE staining score graph. Naïve. Normal group; Asthma. Asthmamodel group. Results are expressed as (n=4). *. P<0.05, **. P<0.01
2.6 哮喘小鼠肺组织HE染色
处死小鼠后,取出小鼠肺组织,进行HE染色,评估小鼠肺部炎症细胞浸润程度,结果如图5C、D所示,哮喘模型组与正常组比较,肺部出现较多炎症细胞的浸润。
3 讨 论
研究表明在特应性皮炎(AD)在不同时期体现出不同的Th优势,即急性期以Th2为主,慢性期以Thl为主。其发病机制普遍认为与Th1/Th2失衡有关,在AD发病过程中,Th2免疫占主导地位,Th1免疫反应下降[30],从而造成机体内的免疫功能发生紊乱,引起机体血清IgE水平升高[31]。由小鼠致敏区域皮肤组织观察发现,经尘螨变应原混合液致敏之后,AD模型小鼠皮肤表面出现泛红及结痂等过敏症状,对致敏区域皮肤进行IFN-γ、IL-4、IL-10、IL-17A四种细胞因子水平测定后,IFN-γ水平降低,IL-4、IL-10水平升高,IL-4和IFN-γ是血清IgE浓度的重要调节因子。IL-4具有促进B淋巴细胞活化增强,诱导IgE合成的作用,而IFN-γ则具有拮抗IL-4的作用,抑制IgE的合成,因此本研究中IFN-γ降低,IL-4升高成为IgE显著升高的一大重要因素。IL-10具有很强的抗炎及免疫抑制活性,能够抑制IL-2、IFN-γ及促炎因子的产生及释放,因此本研究中IL-10的显著升高降低了IFN-γ的分泌,使小鼠皮损中的免疫反应偏向Th2反应。同时IL-10在AD皮损中的显著升高,印证了IL-10可能是AD发病的一个重要因素的结论[32]。Th17细胞与嗜酸性粒细胞之间存在相互作用,其效应因子IL-17是过敏性和炎症性疾病的重要细胞因子,可促进Th2的免疫应答,诱发并扩大皮肤炎症。已有研究表明急性期皮损中存在大量Th17细胞,慢性期皮损中IL-17水平降低[33]。本研究中IL-17A的显著升高促进了Th2免疫应答,结合以上结果表明皮损中免疫反应偏向Th2反应。多项研究表明AD小鼠具有以下皮肤炎症特点:小鼠致敏区域皮肤出现典型的湿疹样改变,如红斑、结痂和鳞屑;处于急性期时,皮损内Th2特征性的细胞因子IL-4表达升高,Th1类细胞因子IFN-γ下降等[27,34-36]。本研究中AD小鼠血清总IgE显著升高,皮损内出现湿疹样改变,IFN-γ降低,IL-4和IL-10升高等结果均符合AD小鼠皮肤炎症特点,因此本试验成功构建AD小鼠模型。同时,本研究发现特应性皮炎过敏反应已影响至肺组织,肺组织中IFN-γ、IL-4、IL-10、IL-17A水平均升高,表明体内反应发生了Th1/Th2失衡,以往研究表明特应性皮炎最终会有向其他过敏性疾病发展的可能[37],本研究中的特应性皮炎过敏反应存在发展成其他过敏性疾病的潜在风险,具体可能性还需进一步探究。
哮喘是一种以IgE介导的Ⅰ型变态反应,因此IgE水平升高在过敏性哮喘、变应性鼻炎等特应性疾病中最具特征性,是诊断哮喘与气道高反应性的重要参考指标,高水平IgE被认为是在非过敏性哮喘中的危险因素。在本次尘螨变应原诱导哮喘模型的试验中,通过对小鼠血清中总IgE水平、小鼠变应原激发体内体温变化、小鼠耳朵点刺试验等方面进行检测,结果显示,哮喘模型组小鼠血清总IgE水平显著升高。研究发现,鼠尾静脉注射热带螨变应原诱发应激性过敏反应时,小鼠的体温显著下降[29]。本研究中变应原激发后小鼠90 min内的体温变化及其变化值与Y轴所围成的面积显示,哮喘模型组变应原激发后体内温度显著降低,与前人研究结果一致,说明小鼠体内发生过敏反应。被动皮肤过敏反应(passive cutanceous anaphylaxis reaction, PCA)是研究I型变态反应性疾病的常用动物模型,能够比较系统反映Ⅰ型变态反应性疾病的病理生理过程[22]。因此本研究经过PCA法对小鼠进行耳朵点刺试验,根据耳朵染料伊文思蓝渗出的蓝斑强度判断小鼠体内过敏反应的严重程度,本研究结果显示哮喘模型组的蓝斑强度显著高于正常组,说明模型组体内发生严重过敏反应。多项研究表明,尘螨变应原诱导小鼠哮喘模型具有的主要特征如下:具有气道的炎症及气道高反应性;肺组织有明显的炎症细胞浸润;血清中IgE水平显著升高等[38-39]。综合本研究结果:IgE显著升高;应激性过敏反应时小鼠体温显著降低;伊文思蓝染料渗出强度显著增加;肺组织支气管周边出现大量炎症细胞的浸润等,可说明本研究成功构建过敏性哮喘小鼠模型。
4 结 论
本试验利用屋尘螨、粉尘螨、热带无爪螨的主要变应原Der p 1、Der f 1、Blo t 5混合,分别成功诱导特应性皮炎小鼠模型和哮喘小鼠模型,证实了尘螨变应原可以诱发动物皮肤螨病(特应性皮炎)和动物体内螨病(过敏性哮喘),也为开发和评价尘螨过敏症防治型疫苗提供小鼠模型。
