电导抑制-离子色谱法测定有机酸化剂中11种有机酸含量
2024-04-02谢秀兰
谢秀兰 徐 菲
(中国农业科学院北京畜牧兽医研究所,北京 100193)
有机酸化剂是由1种或者多种有机酸组成的一类酸化剂[1],具有抗菌、增加适口性和改善免疫功能等多种生物学作用,是天然的绿色无污染饲料添加剂[2]。有机酸化剂在饲料中的应用由来已久[3]。我国《饲料添加剂品种目录》中允许使用的有机酸化剂包括甲酸、乙酸、丙酸、丁酸、乳酸、苯甲酸、山梨酸、富马酸、柠檬酸、酒石酸和苹果酸等11种。近年来,随着人们对环境保护和食品安全的日益关注,以及我国饲料全面“禁抗”政策的实施,绿色、安全饲料添加剂的开发和应用越来越受重视[4-5],有机酸化剂作为一种理想的抗生素替代品,在畜牧生产中应用越来越广泛[6]。有机酸化剂总的来说可分为单一有机酸化剂和复合有机酸化剂两大类,已有研究表明多种有机酸复合使用具有一定的增益效果[7-8]。
有机酸化剂在使用过程中,其种类、浓度、添加水平都会直接影响应用效果[9]。准确测定复合有机酸化剂中的有机酸种类和含量有利于生产企业产品质量控制,有助于高效利用有机酸,同时可以为有机酸化剂的质量安全监管提供有效技术支撑。目前,有机酸含量的测定方法主要有气相色谱法[10]、液相色谱法[11-13]、离子色谱法[14-19]、毛细管电泳法[20-22]、液相色谱串联质谱法[23-25]、气相色谱串联质谱法[26-27]等。然而,目前尚没有全面地同时分析《饲料添加剂品种目录》中11种有机酸的研究报道。
基于离子排斥色谱原理的离子色谱法,其分离包括Donnan排斥、空间排斥和吸附作用等多种分离机理,具有样品前处理简单、分离分析干扰少、线性范围宽、准确度高、重现性好等特点[28],是分析低分子质量有机酸的一种有效方法。因此,本试验采用电导抑制-离子色谱法,通过优化流速、柱温、淋洗液等色谱条件,开发可以同步测定有机酸化剂中甲酸、乙酸、丙酸、丁酸、乳酸、苯甲酸、山梨酸、富马酸、柠檬酸、酒石酸和苹果酸等11种有机酸含量的分析方法,以期有效应用于有机酸化剂的生产质量控制、科学使用和质量安全监管。
1 材料与方法
1.1 主要仪器与设备
离子色谱分析仪(940 Professional IC Vario,瑞士万通中国有限公司),配备自动进样器(858 Professional Sample Processor)、有机酸柱(250 mm×7.8 mm,9 μm)、有机酸抑制器和电导检测器。超纯水制备仪(Milli-Q Advantage A10,德国默克密理博公司)。超声波清洗器(KQ-600型,昆山市超声仪器有限公司)。分析天平[XS105DU,梅特勒托利多科技(中国)有限 公司]。
1.2 试剂与样品
甲酸(纯度≥98%)、乙酸(纯度≥99.9%)、丙酸(纯度≥99.5%)、丁酸(纯度≥99.5%),购自上海麦克林生化科技有限公司;乳酸(纯度90.1%)购自德国Dr.Ehrenstorfe公司;D-酒石酸(纯度≥98%)、富马酸(纯度99%)购自上海源叶生物科技有限公司;苯甲酸(纯度≥99.0%)、山梨酸(纯度≥99.0%)购自北京索莱宝科技有限公司;柠檬酸(纯度≥98.0%)购自上海安谱实验科技股份有限公司;DL-苹果酸(纯度≥99.0%)购自上海默克化工技术公司;丙酮、乙腈均为色谱纯,购自德国Fisher公司;试验用水为经Mili-Q纯化的一级水(>18.2 MΩ)。
1.3 色谱条件
色谱条件的优化:采用单因素试验设计,分别比较不同流速(0.2、0.3、0.4、0.5和0.6 mL/min)对泵压、分离度、峰面积和保留时间的影响,不同柱温(25、30、35、40和45 ℃)对11种有机酸分离度的影响,淋洗液中不同硫酸浓度(0.2、0.5、1.0和2.0 mmol/L)对11种有机酸的分离效果,淋洗液中不同丙酮添加水平(2%、5%、10%、16%和20%)对11种有机酸的分离效果,丙酮和乙腈2种有机改进剂的添加比例对11种有机酸的分离效果。
优化后的色谱条件如下。色谱柱:有机酸柱(Metrosep Organic Acids 250/7.8,250 mm×7.8 mm,9 μm);淋洗液:按照体积比计,0.5 mmol/L硫酸水溶液∶丙酮∶乙腈=84∶6∶10;流速:0.50 mL/min;柱温:30 ℃;检测器:电导抑制检测器;抑制液:100 mmol/L氯化锂;进样量:20 μL;定量方法:外标法定量。
1.4 标准溶液的配制
准确称取11种有机酸各1.0 g,分别用超纯水或乙醇溶解并定容至50 mL容量瓶中,配制成质量浓度为20.0 mg/mL的标准贮备液,标准贮备液置于4 ℃冰箱中保存。分别移取一定体积的上述11种有机酸的标准贮备液,用淋洗液稀释配制成混合标准溶液。
1.5 样品前处理
1.5.1 非包被类酸化剂样品前处理
称取适量样品于100 mL容量瓶中,加入80 mL淋洗液,超声提取30 min,待冷却至室温后,加入淋洗液定容至100 mL。如有不溶物,3 214×g离心10 min,取上清液过0.22 μm微孔滤膜。
1.5.2 脂肪包被类酸化剂样品前处理
称量适量样品于250 mL锥形烧瓶内,加入50 mL石油醚,50 ℃超声10 min,加入50 mL超纯水,充分摇动直至样品完全溶解。转移溶液至分离漏斗中分液萃取,收集下层溶液,3 214×g离心10 min,取上清液过0.22 μm微孔滤膜。
1.5.3 含乳酸的酸化剂样品前处理
称量适量样品于50 mL锥形烧瓶内,加入5 mL 10 mol/L的氢氧化钠溶液,90 ℃水浴90 min,加入5 mL 10 mol/L硫酸溶液调节pH,待冷却至室温后,加入淋洗液定容至100 mL。如有不溶物,3 214×g离心10 min,取上清液过0.22 μm微孔滤膜。
1.6 数据分析
利用万通MagIC Net 3.2色谱数据处理软件,采用外标法进行有机酸定量分析。试验数据采用Excel 2013和SPSS 16.0软件进行统计分析。
2 结果与分析
2.1 色谱条件的优化
本试验采用11种有机酸含量分别为1 000 mg/L的混合标准溶液,以淋洗液0.5 mmol/L硫酸水溶液∶丙酮=80∶20(按照体积比计)、流速0.50 mL/min、柱温30 ℃为初始条件考察了流速、柱温以及淋洗液中硫酸浓度、有机改进剂种类和添加比例等条件对有机酸的分离情况。
2.1.1 流速的优化
比较不同流速(0.2、0.3、0.4、0.5和0.6 mL/min)对泵压、分离度、峰面积和保留时间的影响(图1)。随着流速升高,峰面积逐渐降低,泵压明显升高(由2.08 MPa升高至6.36 MPa),平均保留时间由70 min缩减至24 min。流速从0.2 mL/min提高到0.3 mL/min时,11种有机酸分离度变化不明显,但流速继续提高时,11种有机酸分离度变化明显。综合考虑泵压、峰面积、保留时间和分离度等因素,最终选择0.5 mL/min的流速进行后续试验。
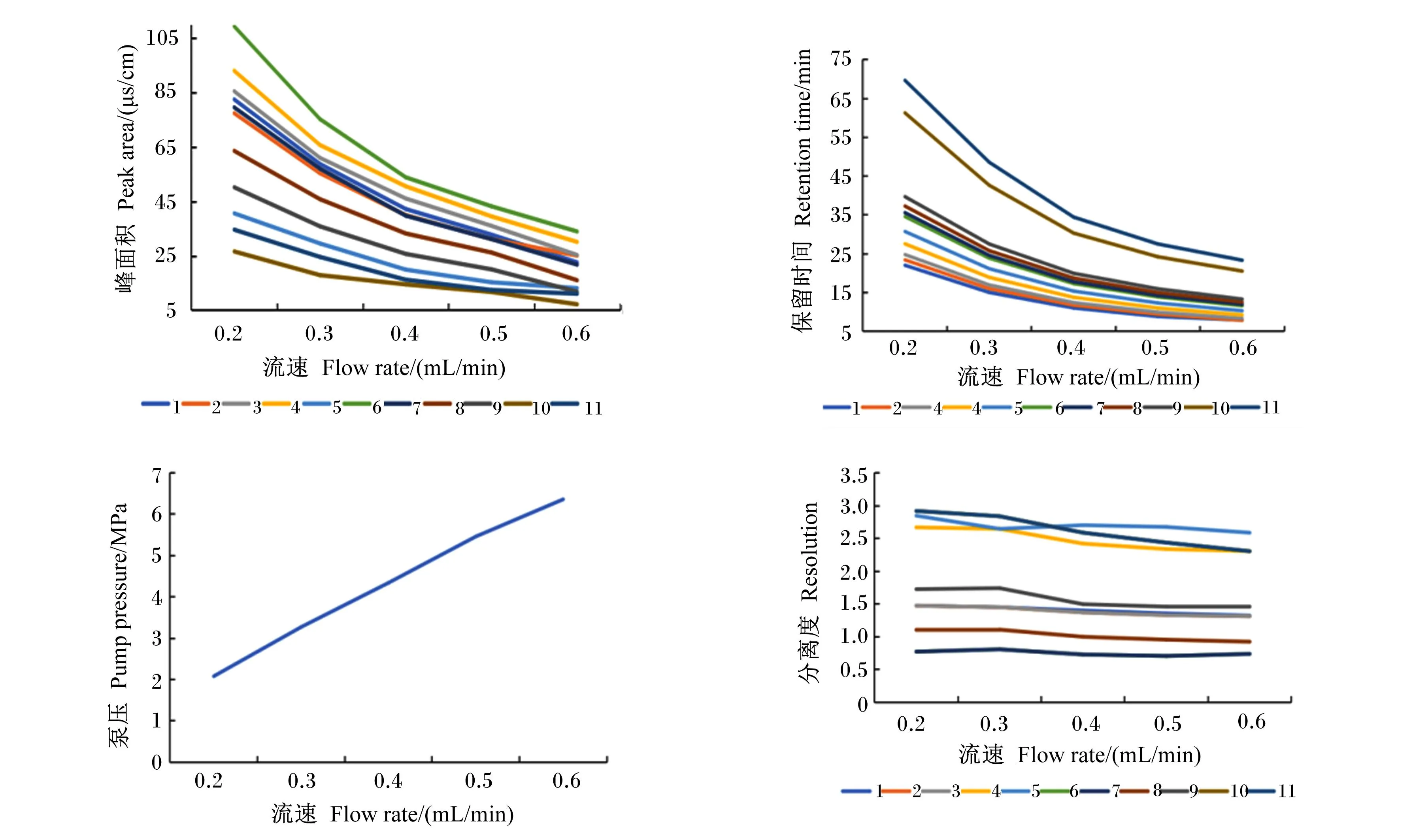
1.柠檬酸;2.酒石酸;3.苹果酸;4.富马酸;5.乳酸;6.甲酸;7.乙酸;8.丙酸;9.丁酸;10.山梨酸;11.苯甲酸。图2同。
2.1.2 柱温的优化
比较不同柱温(25、30、35、40和45 ℃)对11种有机酸分离度的影响。结果显示,在考察的温度范围内,柱温对11种有机酸的保留时间均有影响,但是对分离度均无影响。综合考虑试验的可操作性,最后选择常用的30 ℃柱温进行后续试验。
2.1.3 淋洗液中硫酸浓度的优化
比较淋洗液中不同硫酸浓度(0.2、0.5、1.0和2.0 mmol/L)对11种有机酸的分离效果。结果显示,随着硫酸浓度增加,基线明显升高(由27.4 μs/cm增加至225.7 μs/cm),有机酸响应值(峰面积)明显降低。在本试验考察的范围内,不同硫酸浓度对分离度影响不明显,当硫酸浓度为0.2 mmol/L时,甲酸、乙酸和丙酸的分离效果较好,但是此时柠檬酸、酒石酸、苹果酸和富马酸的分离效果较差,并且富马酸的峰形较差;当硫酸浓度增至1.0 mmol/L时,柠檬酸、酒石酸、苹果酸和富马酸的分离效果较好,但是甲酸和乙酸基本重合。综合考虑峰面积和分离度等因素,选取硫酸浓度为0.5 mmol/L的淋洗液进行后续试验。
2.1.4 淋洗液中有机改进剂种类及用量的优化
比较淋洗液中不同丙酮添加水平(2%、5%、10%、16%和20%)对11种有机酸的分离情况(图2)。随着丙酮添加水平增加,基线略有下降,分析时间由95 min缩减至30 min(其中以山梨酸和苯甲酸的保留时间变化最为明显),甲酸、乙酸、丙酸和丁酸的分离度逐步降低,但柠檬酸和酒石酸、富马酸与乳酸的分离度逐渐增加。综合考虑11种有机酸的分离度,最后选择丙酮添加水平为16%进行后续试验。
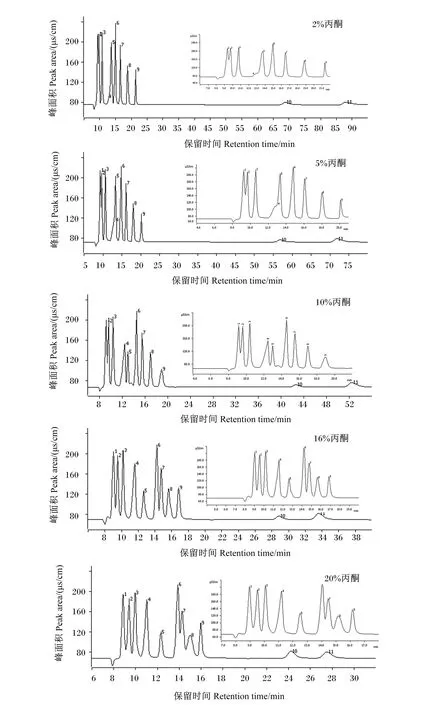
图2 淋洗液丙酮添加水平对11种有机酸分离度的影响
比较丙酮和乙腈2种有机改进剂的添加比例对11种有机酸分离效果的影响。结果显示,随着乙腈替代丙酮比例的增加,柠檬酸和酒石酸分离度略有下降,但甲酸和乙酸的分离度有所增加。选择添加10%的乙腈和6%的丙酮作为有机改进剂时,各有机酸的分离度均大于1.2,分离效果最好。
上述结果表明,当淋洗液中硫酸浓度为0.5 mmol/L,丙酮和乙腈添加比例分别为6%和10%,柱温为30 ℃,流速为0.5 mL/min时,11种有机酸分离效果最优。
2.2 线性范围、检出限和定量限
配制11种有机酸的系列混合标准溶液,重复测定3次,建立标准曲线,在各自的线性范围内,相关系数(R2)均大于0.999 4。以3倍信噪比作为检出限,10倍信噪比作为定量限,11种有机酸的线性回归方程、R2、线性范围、检出限和定量限见表1。

表1 11种有机酸线性回归方程、相关系数、线性范围、检出限和定量限
2.3 11种有机酸的回收率和精密度
向有机酸化剂样本稀释液中分别添加3个不同浓度的11种有机酸的标准溶液,每个添加水平重复测定6次。由表2可知,各有机酸回收率在92.9%~112.2%,相对标准偏差在0.2%~2.4%,方法准确度和精密度良好。

表2 11种有机酸的回收率和精密度
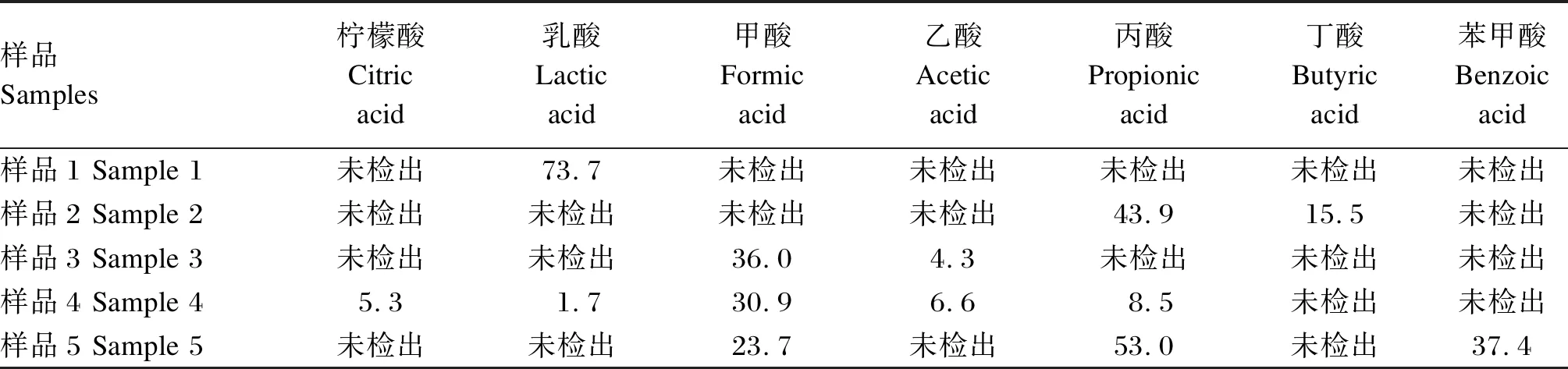
表3 5个实际样本中有机酸含量测定
2.4 实际样品分析
为了进一步验证方法的适用性,采用本试验建立的分析方法对5个典型的实际有机酸样品进行了检测。结果表明,本试验建立的分析方法可以用于测定多种类、高含量差的有机酸化剂样品,方法的可适用性强。
3 讨 论
3.1 流速的选择
离子色谱分离时,流速影响泵压、分离度、峰面积、峰宽和保留时间[19]。流速升高,泵压增加,流速过大会造成色谱柱压力接近其耐压上限而影响使用寿命[28];流速降低,分离度、峰面积、峰宽和保留时间增加,甚至可能造成峰形变形和拖尾[29]。综合考虑泵压、分析效率和分离情况等因素,本试验最后选择流速为0.5 mL/min。
3.2 柱温的选择
柱温升高会减小流动相黏度,增加组分传质速度和效率,避免慢传质过程中的谱带展宽效应,改善色谱峰形[30]。本试验条件下,柱温对11种有机酸保留时间均有不同程度的影响,但是可能是受淋洗液中有机溶剂影响,柱温对各有机酸峰形和分离度影响均不明显。综合考虑试验的可操作性,最终选择常选用的30 ℃为柱温。
3.3 淋洗液的选择
随着淋洗液中硫酸浓度的增加,有机酸离解被抑制,受Donnan排斥的影响逐渐减弱,其他作用影响相对增强,会影响有机酸的分离情况[28]。本试验条件下,随着硫酸浓度增加,Donnan排斥影响逐渐减弱,受到空间排斥作用影响的柠檬酸、富马酸、酒石酸和苹果酸等多元酸分离度有所提升,但以Donnan排斥为主要分离作用的甲酸、乙酸和丙酸分离度则逐渐降低。有机溶剂的重要作用在于调节离子交换过程中的选择性,改变分离柱对分析物的保留特性[31]。淋洗液中有机溶剂的加入可以降低淋洗液的极性,缩短分析时间,改变出峰顺序、峰形和分离度[32]。乙腈相对于丙酮,具有洗脱能力强、灵敏度高和柱压小等优势[31-33]。综合考虑各有机酸的分离度,本试验最终选择的淋洗液为0.5 mmol/L硫酸水溶液∶丙酮∶乙腈=84∶6∶10。
3.4 有机酸的出峰顺序
有机酸柱采用表面键合磺酸基团的交联聚苯乙烯/二乙烯基苯聚合物为填料,其裸露的磺酸氢质子是产生分离选择性的主要官能团,基于该官能团产生的溶质和固定相之间的Donnan排斥作用为主要保留机理[34],主要决定了有机酸的出峰顺序,表现为酸度系数(pKa)值低的有机酸出峰在前(表4)。除Donnan排斥作用以外,受空间排斥作用、氢键作用和π-π电子作用的影响,对应出现了柠檬酸出峰早于酒石酸、乳酸出峰早于甲酸、富马酸出峰晚于苹果酸和山梨酸、苯甲酸的保留时间最长等现象。本试验条件下,色谱优化过程中有机酸的出峰先后顺序均未发生变化。

表4 11种有机酸的保留时间
4 结 论
① 采用有机酸柱离子色谱结合电导抑制检测器对有机酸化剂中的11种有机酸组分进行了有效分离。通过单因素优化试验得到的最佳分离条件如下:0.5 mmol/L硫酸水溶液∶丙酮∶乙腈=84∶6∶10为淋洗液等度洗脱,柱温为30 ℃,流速为0.5 mL/min。在该条件下,11种有机酸组分在40 min内可以得到良好分离。
② 方法学考察结果显示,11种有机酸组分在上述色谱条件下,其含量与对应峰面积在一定范围内呈良好线性关系,R2大于0.999 4,检出限为0.01~0.11 mg/L,加标回收率为92.9%~112.2%,相对标准偏差为0.2%~2.4%。
③ 本试验建立的方法首次实现了《饲料添加剂品种目录》中11种有机酸的同步分析,具有前处理简单、线性范围宽、适用范围广等优点,可为规范有机酸化剂生产使用、加强产品的质控与监管提供关键技术支撑。
