胰岛素通路对围产期奶牛糖代谢、脂代谢、健康状况和生产性能影响的研究进展
2024-04-02姚军虎
李 磊 姚军虎 杨 景 张 俊*
(1.西北农林科技大学动物科技学院,杨凌 712100;2.陕西华秦农牧科技有限公司,杨凌 712100)
奶牛围产期包括产前3周和产后3周2个重要阶段,由于分娩前胎儿体积的增大,瘤胃受到挤压等因素导致干物质采食量(dry matter intake,DMI)降低,分娩后泌乳的开始致使营养需要增加,再加上自身内分泌和代谢的变化,围产后期奶牛极易发生能量负平衡(negative energy balance,NEB)。此时,奶牛加剧脂肪动员以满足葡萄糖供应不足而引发的糖代谢失衡,但这一过程又会削弱胰岛素的生理作用,引起胰岛素通路障碍,发生胰岛素抵抗(insulin resistance,IR)[1-2]。胰岛素抵抗是指外周靶器官或组织对胰岛素的敏感性和反应性减弱,胰岛素需要量超过正常产生量。胰岛素抵抗发生后,脂肪动员加剧,肝脏中过量非酯化脂肪酸(non-esterified fatty acid,NEFA)转化为酮体或再酯化形成的甘油三酯(triglyceride,TG)含量也相应增加[3],从而引发脂肪肝和酮病等代谢性疾病[4],损害奶牛健康状况和生产性能,降低其利用年限。本文阐述了围产期奶牛胰岛素抵抗的发生机制,揭示胰岛素通路对糖代谢、脂代谢、健康状况和生产性能的影响及相应调控措施,为预防围产期奶牛营养代谢性疾病、提高牧场经济效益提供理论依据。
1 胰岛素通路在机体中的作用
1.1 胰岛素通路的组成及主要作用
胰岛素通路在葡萄糖摄取、糖原合成及脂质和蛋白质合成中起关键作用[5]。动物采食饲粮后,体内血糖水平增加,胰腺β细胞分泌的胰岛素与靶细胞膜上的胰岛素受体结合后激活下游磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,也称为AKT)信号通路和丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)通路[6]。PI3K刺激磷脂酰肌醇二磷酸,形成磷脂酰肌醇三磷酸后激活磷酸肌醇依赖性蛋白激酶-1进而激活AKT[7]。PI3K/AKT通路能介导多种细胞功能,通过刺激糖原合成酶激酶3(glycogen synthase kinase 3,GSK3)调控糖原合成酶和ATP-柠檬酸裂解酶活性,分别调节糖原和脂肪酸的合成[8]。在肌肉和脂肪细胞中,PI3K/AKT介导葡萄糖转运体(glucose transporter,GLUT)4转移至细胞膜以摄取葡萄糖[9]。同时,PI3K/AKT通路激活胆固醇调节元件结合蛋白使其易位到细胞核进行转录以调控脂肪酸和胆固醇的合成,并通过哺乳动物雷帕霉素复合物1(mammalian target of rapamycin complex 1,mTORC1)的靶点活化以调控蛋白质合成[10]。当胰岛素受体底物(insulin receptor substrate,IRS)1与生长因子受体结合蛋白2结合后激活MAPK通路,细胞外信号调节激酶易位到细胞核以调节细胞分裂和生长。胰岛素通过以上信号通路调节糖代谢、脂代谢、蛋白质合成和细胞分裂与生长[11]。
1.2 在肝脏中的作用机制
肝脏、骨骼肌和脂肪组织都可作为胰岛素作用的主要靶器官,其中,肝脏在调控机体糖代谢和脂代谢中发挥着关键作用(图1)[12]。肝脏将机体部分葡萄糖转换为糖原储存,当多余的葡萄糖不能被代谢或吸收时会形成脂肪酸和甘油三酯,并通过极低密度脂蛋白(very low-density lipoprotein,VLDL)输送到脂肪组织。胰岛素通过调节糖原合成酶和糖原磷酸化酶增加肝糖原合成[13],并上调胆固醇调节元件结合蛋白1c增加肝脏新生脂肪生成,同时,胰岛素与其特定的细胞表面受体结合,产生酪氨酸激酶磷酸化并激活胰岛素受体,IRS1/2相互作用激活PI3K/AKT通路后[14],通过抑制由叉头框O1(forkhead box O1,FoxO1)介导的糖异生来降低肝脏葡萄糖生成及糖异生底物水平[15]。胰岛素通过减少甘油向肝脏的转运、甘油向葡萄糖的转化[16-17]及脂肪酸向肝脏的输送,降低肝脏乙酰辅酶A和丙酮酸羧化酶活性。除了在肝脏糖代谢和脂代谢中发挥作用,胰岛素还通过mTORC1调控肝细胞蛋白质合成[18]。
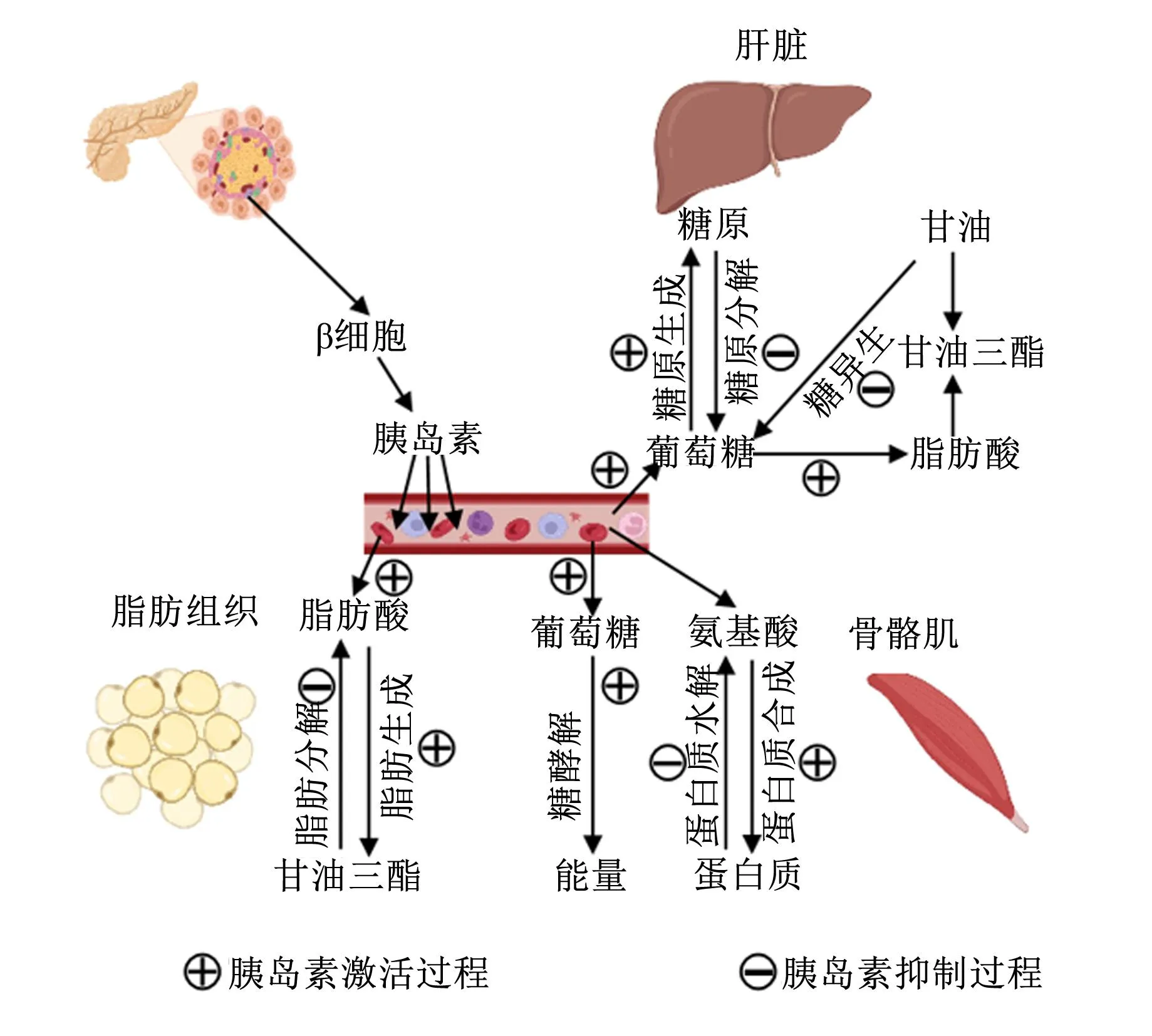
图1 胰岛素在肝脏、骨骼肌和脂肪组织中的主要生理作用机制
1.3 在骨骼肌中的作用机制
骨骼肌是胰岛素作用的靶组织之一,大约75%的葡萄糖被吸收进入骨骼肌,其余通过胰岛素依赖机制进入肝脏[19]。胰岛素的合成代谢作用主要体现在调控骨骼肌营养物质的储存[20]。动物采食后产生的高血糖促进胰腺分泌胰岛素,随着胰岛素分泌增多,胰岛素与胰岛素受体结合,导致IRS磷酸化,激活PI3K/AKT通路,调节GLUT4从细胞内区室易位到肌细胞中的肌膜和横小管膜以增强骨骼肌摄取葡萄糖[21]。胰岛素还可通过PI3K/AKT通路上调己糖激酶Ⅱ转录水平和活性,催化葡萄糖,发生磷酸化反应,使肌肉中葡萄糖转变成葡萄糖-6-磷酸[22],降低血糖水平。
1.4 在脂肪组织中的作用机制
脂肪组织是胰岛素敏感性组织,通过释放脂肪因子、促炎因子和脂肪酸影响糖代谢和脂代谢。胰岛素将动物摄入的营养物质向脂肪组织和骨骼肌进行分配,通过PI3K/AKT通路刺激前脂肪细胞向脂肪细胞分化[23],降低环磷酸腺苷水平抑制脂肪分解[24],刺激mTORC1靶点抑制甘油三酯脂肪酶、激素敏感性脂肪酶活性,将脂质转变成脂滴以增加葡萄糖和脂肪酸摄取等方式促进甘油三酯储存[25]。在胰岛素的刺激下,葡萄糖转化为3-磷酸甘油合成甘油二酯,同时还可与脂肪酸酰基辅酶A结合后在甘油三酯脂肪酶和单酰甘油脂肪酶作用下水解成甘油和脂肪酸[26],并最终代谢产生能量。
2 胰岛素抵抗及其发生机制
胰岛素抵抗是指动物体内胰岛素功能和反应性降低,导致葡萄糖的摄取吸收与利用效率减弱,机体需要大量的胰岛素才能使血液中葡萄糖处于稳态。作为胰岛素调节血液葡萄糖稳态的重要中间媒介,GLUT囊泡可在胰岛素的刺激下易位到细胞膜调节葡萄糖摄取,当GLUT转运出现异常时会发生胰岛素抵抗,因此,胰岛素抵抗和GLUT转运异常关系密不可分。哺乳动物体内发现了14种GLUT,其中,GLUT4对胰岛素敏感度最高。GLUT4在哺乳动物的心肌、脂肪和骨骼肌等组织中广泛存在。IRS1在胰腺和肝脏细胞中表达量较高,同时,IRS1丝氨酸和苏氨酸残基磷酸化会损害胰岛素信号传导[27],抑制GLUT4易位到细胞膜摄取葡萄糖[28],从而发生胰岛素抵抗。胰岛素抵抗主要发生在肝脏、骨骼肌和脂肪组织等对胰岛素敏感的靶器官内。肝脏胰岛素抵抗表现为胰岛素对肝糖异生的抑制作用被中断,对新生脂肪生成的作用增强,导致慢性高血糖症和高甘油三酯血症[29]。骨骼肌胰岛素抵抗表现为肌肉葡萄糖吸收、氧化及储存功能异常,导致葡萄糖转运和利用能力下降,胰岛素信号传导减弱,葡萄糖摄取与糖原合成减少、蛋白质合成受损导致肌肉脂质沉积[30],进一步降低胰岛素敏感性。脂肪组织胰岛素抵抗是指胰岛素阻碍脂肪分解使外周组织葡萄糖利用率下降,脂肪酸含量增加[31]。胰岛素抵抗发生后会引起机体糖代谢和脂代谢紊乱、炎症反应及氧化应激,最终诱发相应代谢疾病,损害动物健康。
3 围产期奶牛胰岛素通路异常及相关机制
3.1 胰岛素抵抗与围产期奶牛糖代谢、脂代谢异常的关系及其影响
围产期奶牛由于胎儿快速生长及泌乳的开始,奶牛营养需求大幅增加,能量摄入不能满足营养需求,导致能量负平衡[32]。能量负平衡触发肝脏脂肪动员并促进糖异生以满足奶牛不断增长的能量需求,此时脂肪组织产生大量NEFA并输送到肝脏进行完全氧化以在肝线粒体或过氧化物酶体中产生ATP,或不完全氧化产生酮体如丙酮、乙酰乙酸和β-羟基丁酸(β-hydroxybutyric acid,BHBA),或再酯化形成甘油三酯[33]。甘油三酯可在肝细胞蓄积,也可以VLDL的形式转运出肝脏并释放到血液循环中[34]。然而,肝脏氧化NEFA和合成VLDL的能力有限,当能量负平衡加剧时,酮体生成量增加并在体内储存,血浆脂蛋白浓度升高[35],从而增加脂肪肝和酮症的发病率,损害奶牛泌乳及繁殖性能。围产期能量负平衡的奶牛自身糖代谢失衡的同时伴随胰岛素抵抗[1]。脂肪酸在围产期奶牛糖代谢和脂代谢中扮演着重要的角色[36],能量负平衡启动脂肪动员后NEFA浓度增加。高浓度脂肪酸抑制由胰岛素刺激的外周组织对葡萄糖的摄取,并扰乱肝脏和外周组织的细胞内胰岛素信号通路,降低胰岛素敏感性[37]。胰岛素敏感性降低进一步加剧脂肪动员并提高泌乳早期奶牛体内脂肪酸浓度,引发恶性循环[38]。由能量负平衡导致的胰岛素抵抗及糖代谢、脂代谢紊乱已成为影响奶牛业快速发展的一大阻碍,严重影响动物健康生产且降低畜牧业经济效益,探求改善胰岛素抵抗的新方法已成为研究热点之一。
3.2 不同体况围产期奶牛的胰岛素反应
围产期奶牛体况评分(body condition score,BCS)与能量负平衡关系密切[39],发生胰岛素抵抗时与体况的关系更明显。正常情况下,胰岛素与胰岛素受体结合诱使IRS1/2磷酸化并激活PI3K/AKT通路,诱导GLUT4生成,使机体吸收葡萄糖。肥胖情况下,脂质累积与炎症因子生成显著增多,产生炎症反应,诱发胰岛素抵抗[40]。研究表明,过度饲喂或BCS较高的围产奶牛内脏脂肪被许多巨噬细胞浸润,并且浸润幅度越大,肥胖幅度越大,对胰岛素抵抗性越强[41-42]。修订后的定量胰岛素敏感性检查指数(revised quantitative insulin sensitivity index,RQUICKI)公式为:RQUICKI=1/[log10葡萄糖浓度(mg/dL)+log10胰岛素浓度(μU/mL)+log10NEFA浓度(mmol/L)],是基于葡萄糖、胰岛素和NEFA浓度用以评估奶牛胰岛素功能和能量稳态的指标[43-44],RQUICKI低表明胰岛素敏感性降低[41]。葡萄糖、胰岛素、NEFA浓度及RQUICKI是胰岛素抵抗发展的相关指标,Wu等[45]根据5分制体况评分将奶牛分为低(BCS≤2.75分)、中(3.0分≤BCS≤3.5分)和高(BCS≥3.75分)3组体况,正常饲喂并采集血液样本,发现高体况奶牛血液中胰岛素和甘油三酯浓度较高,RQUICKI较低,表明高体况奶牛更易发生胰岛素抵抗和脂肪分解。此外,胰岛素抵抗的发生导致高体况奶牛抗氧化能力下降,氧化应激增加,同时AKT蛋白表达量增加[46],且NEFA和BHBA浓度超出了正常值,奶牛患代谢紊乱和传染病的风险更高,从而影响产奶量和繁殖性能[47]。产前高体况奶牛在产后也更容易发生胰岛素抵抗[48],胰岛素抵抗又加剧高体况奶牛的脂肪分解,增加脂肪肝和酮症的发病率,影响奶牛健康。研究发现,产犊时BCS在3.00~3.50分的奶牛产后生产性能无显著差异,而BCS高于该分的奶牛患产后疾病的风险增加,因此建议产犊时BCS在3.00~3.25分[49]。体况在维持奶牛的健康方面起着重要作用,适中的体况方能保证奶牛平稳渡过围产期。
4 围产期奶牛胰岛素抵抗对健康状况和生产性能的影响
动物通过胰岛素提高肝脏对糖类的吸收率,增加肝糖原和肌糖原的形成与储存,阻碍酮体产生,保障动物健康。胰岛素抵抗发生过程非常迅速,奶牛产犊后随着产奶量提高,胰岛素与胰高血糖素浓度随之下降,脂肪动员以减轻能量负平衡状态。但由于围产奶牛无法适应巨大的代谢与内分泌变化在脂肪动员时易造成的低血糖等疾病状态,长此以往导致产后出现代谢紊乱,损害健康,降低生产性能。其中,过多脂肪的动员及过多酮体的产生是围产期奶牛代谢疾病的主要诱因[50]。围产期脂肪肝和酮病奶牛肝脏胰岛素受体基因表达显著降低,且血液中NEFA、葡萄糖浓度显著升高,表明机体对胰岛素的反应性降低,存在胰岛素抵抗[51-52]。
奶牛泌乳后乳腺对葡萄糖需求急剧增加,葡萄糖流向各组织器官以满足泌乳需要,导致脂肪肝奶牛血液葡萄糖浓度降低。奶牛产后DMI急剧下降,导致能量负平衡的同时NEFA浓度升高,甘油三酯在肝脏内大量蓄积,导致肝细胞坏死,降低肝脏免疫应答及抵抗内毒素的能力,致病因子侵袭后奶牛发病率升高。围产期酮病奶牛与胰岛素抵抗的结果显示酮病奶牛血液NEFA和BHBA浓度显著高于健康组,葡萄糖浓度显著低于健康组,表明酮病奶牛存在能量负平衡并动员大量脂肪以改善能量匮乏状态,导致胰岛素敏感性显著降低,奶牛对葡萄糖利用率下降,加剧胰岛素抵抗,损害了奶牛的生产性能[53]。随着奶牛生产水平的不断提高,胰岛素抵抗与脂肪肝作用机制越来越被重视,围产期是奶牛极其关键而又特殊的时期,围产奶牛对葡萄糖的需求显著增加[54],并通过更多脂肪动员满足自身能量需要,当脂肪动员超过机体代偿能力时导致糖代谢、脂代谢和胰岛素通路异常,引起脂肪肝,脂肪肝引起肝脏代谢紊乱、糖原合成障碍,加剧血中酮体含量的升高,产生酮病并伴随其他诸如乳房炎、子宫炎、难产、胎衣不下、蹄病、皱胃变位等疾病,严重威胁围产奶牛的健康状况和生产性能。围产期酮病和健康奶牛血液代谢产物标志物的变化见表1。
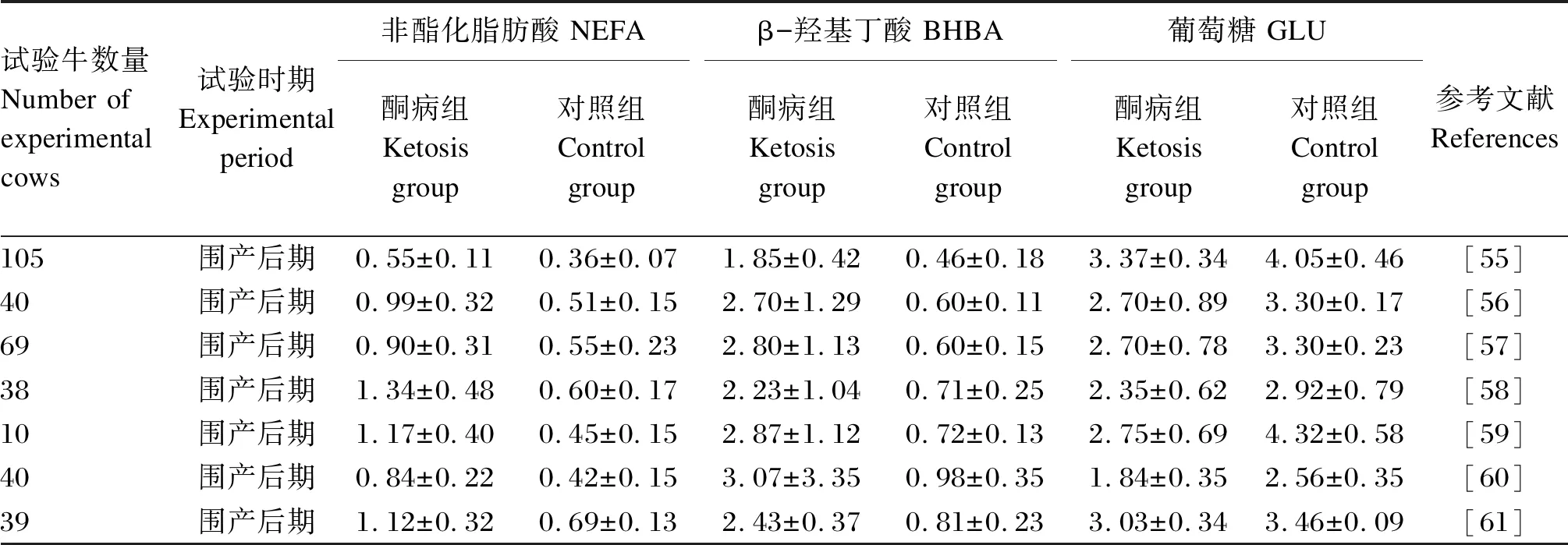
表1 围产期酮病和健康奶牛血液代谢产物标志物的变化
5 围产期奶牛胰岛素抵抗的调控措施
5.1 提高机体能量代谢
奶牛围产前期饲粮中碳水化合物提供的能量可有效改善围产期糖代谢、脂代谢和生产性能[62],胆碱和蛋氨酸可调节肝脏能量和脂质代谢,降低肝脏中脂肪含量,维持肝脏糖异生和机体葡萄糖稳态,提高围产奶牛RQUICKI,改善胰岛素抵抗[63]。葡萄糖在奶牛体内发挥自身生理作用和泌乳中扮演着重要的角色。小肠可直接吸收过瘤胃葡萄糖。Wang等[64]研究表明,奶牛饲粮中每天补充200 g过瘤胃葡萄糖可提高DMI及产奶量、促进能量代谢并降低围产期能量负平衡造成的负面影响,改善胰岛素抵抗。丙酸是反刍动物的关键葡萄糖前体,丙酸钙可在瘤胃内可水解成丙酸和钙离子,通过肝脏糖异生作用在肝脏中转化为葡萄糖并进入血液循环,从而提高奶牛的能量水平[2,65]。莫能菌素可改变瘤胃微生物菌群和增加革兰氏阴性菌的数量,为动物提供更多的能量[66]。丙二醇作为丙烯的衍生物可增加饲粮的能量水平,在瘤胃发酵过程中会迅速转化为丙酸,并被瘤胃壁吸收提供能量[67]。Chalmeh等[68]在围产奶牛饲粮中添加莫能菌素和丙二醇发现,两者联合使用可显著降低胰岛素抵抗率,改善围产期奶牛能量负平衡和胰岛素抵抗。但我国已禁止在奶牛生产上使用莫能菌素,未来还需寻找合适的替代品。
5.2 改善氧化应激
围产期奶牛易发生氧化应激,引起肝脏损伤,损害胰岛素信号转导,降低胰岛素敏感性,改变脂质代谢基因表达,引发胰岛素抵抗。高血糖状态损害抗氧化防御系统,随后产生过量活性氧,导致氧化应激和线粒体功能障碍,进而加剧胰岛素抵抗[69]。酶类和非酶类抗氧化剂可降低不良氧化反应水平,饲粮中合理添加抗氧化剂可抑制脂质氧化和清除自由基,缓解围产期奶牛过氧化应激状态[70]。核因子E2相关因子(nuclear factor erythroid 2-related factor 2,Nrf2)是氧化应激的中枢调节剂,可反式激活抗氧化蛋白的表达,以防止炎症引发的氧化损伤。Sun等[71]研究发现,丁酸钠可通过增加肝脏Nrf2的mRNA和蛋白质表达水平降低高脂肪饮食诱导的肝脏氧化应激和胰岛素抵抗,Nrf2在体外被敲低时,丁酸钠不发挥作用。Zhang等[72]研究表明,甘草酸单铵通过增加细胞核中Nrf2和超氧化物歧化酶的mRNA表达水平,增强抗氧化活性,减轻围产奶牛氧化应激损伤,提高胰岛素敏感性,改善胰岛素抵抗。维生素E可保护细胞膜和脂蛋白免受脂质过氧化,清除自由基,并调节细胞信号传导和基因转录以提高组织的抗氧化性能[73]。Chalmeh等[74]研究发现,维生素E可通过改善氧化应激和脂质动员增加围产奶牛胰岛素敏感性。因此,在围产期维持奶牛氧化还原稳态至关重要。
5.3 改善胰岛素相关关键通路和激酶
胰岛素抵抗通过下调PI3K/AKT、IRS1、GLUT4、GSK3等的表达,直接损害胰岛素对外周葡萄糖摄取的作用[75],如PI3K/AKT通路功能缺陷、IRS1丝氨酸磷酸化水平增加与GLUT4向细胞表面的输送减少导致胰岛素敏感性降低。GSK3表达下调可通过刺激葡萄糖摄取和糖原合成改善胰岛素作用,但上调则导致骨骼肌胰岛素反应性受损[76]等,可见胰岛素抵抗受多种关键通路和激酶影响。磷酸酶和张力蛋白同系物是胰岛素信号传导和外周胰岛素敏感性的负调节因子,Deng等[77]研究表明,磷酸酶和张力蛋白同系物沉默可增加AKT的磷酸化水平和PI3K的表达,降低IRS1的磷酸化水平,增加GSK3的磷酸化水平和胆固醇调节元件结合蛋白c的表达,进一步上调参与糖异生关键酶如磷酸烯醇丙酮酸羧激酶(PEPCK)和葡萄糖-6-磷酸酶(G6-Pase)的表达,改善胰岛素抵抗。Meeprom等[78]研究发现,葡萄籽提取物可通过改善骨骼肌中的PI3K/AKT和GLUT4表达并抑制糖原合成酶mRNA表达和增加糖原合酶表达,改善胰岛素敏感性和高血糖状态。Liu等[79]研究表明,鸢尾素可通过PI3K/AKT/FoxO1介导的PEPCK和G6-Pase表达下调减少糖异生,通过PI3K/AKT/GSK3介导的糖原合成酶激活增加糖异生,改善葡萄糖稳态。
6 小结与展望
围产期奶牛在发生能量负平衡的同时也常常伴随胰岛素抵抗,机体处于糖代谢、脂代谢和胰岛素代谢的异常状况,导致脂肪肝和酮病,破坏奶牛的健康、泌乳及繁殖性能,严重影响牧场的经济效益。通过提高围产期奶牛能量代谢状态,改善氧化应激及调控胰岛素相关关键通路和激酶等方式可有效提高胰岛素敏感性,维持葡萄糖和脂质代谢稳态,缓解胰岛素抵抗,并降低营养代谢性疾病的发生率,提高健康状况和生产性能。由于胰岛素涉及的通路较多,其在奶牛体内作用方式、代谢方向发生的变化等对机体产生的影响不尽相同,因此需要进一步研究胰岛素通路在围产期奶牛体内的运行、变化过程及诱导相应疾病的发生机制,从而促进奶牛养殖业高质量发展。
