动物细胞脂滴及其生物学功能研究进展
2024-04-02王世银宁程程
王世银 宁程程 牛 嘉 张 伟*
(1.新疆农业职业技术学院,农业农村部西北畜禽健康养殖技术重点实验室,昌吉 831100;2.中国农业科学院西部农业研究中心,昌吉 831100)
脂质在有机体能量供应、膜结构构建和信号转导等生命活动中发挥着重要作用,在细胞中,大量的脂质储存在脂滴中。由于能量供应是各项生命活动的基本保障,所以从低等的酵母菌到高等哺乳动物的大部分细胞中都有脂滴。脂滴是一个独立的细胞器,外层是由磷脂单分子层构成的膜,有多种蛋白质结合于膜上,其核心由甘油三酯和固醇酯等脂类物质构成[1]。细胞通过脂滴这样一个结构使疏水的脂质能够稳定地分散到亲水的细胞质中,为高效发挥脂质的生物学功能奠定了结构基础,同时又可缓冲细胞中过量脂质合成或细胞器崩解释放的游离脂肪酸所导致的细胞脂毒性[2],在细胞水平发挥对有机体的保护作用。脂滴是一个多样化的细胞器,细胞中脂滴的数量和大小,膜上结合的蛋白质及其中包含的脂质种类,均因细胞的类型、生理状态而存在较大的差异[3-6]。已有的研究结果表明,除了参与脂质代谢以外,脂滴还在基因表达、蛋白质折叠、限制氧自由基水平和药物活性调节等生物学过程中发挥调控作用[7-10],脂滴功能异常与多种人类疾病密切相关[11-12]。有研究发现老年人脑小神经胶质细胞中有大量的脂滴积累,这类细胞的吞噬能力很低,同时会产生高水平的氧自由基和炎性细胞因子,这可能与老年人脑神经退行性病变直接相关[12]。正是由于脂滴生物学功能的多样性,一直以来都是国内外学者研究的焦点。本文就脂滴结构、动态变化、与其他细胞器的相互作用及其生物学功能等方面的研究进展进行综述,旨在为后续相关研究提供参考。
1 脂滴的基本结构
脂滴是由磷脂单分子膜包裹脂质而形成的一个球形细胞器,其膜的表面结合着不同种类的蛋白质[1,13](图1)。随着白色脂肪细胞的分化,大量小脂滴相互融合为一个大脂滴,其直径可达100 μm以上,几乎充满了整个细胞。在其他类型细胞中,脂滴一般较小,直径在0.1~5.0 μm,呈分散或聚集状态。
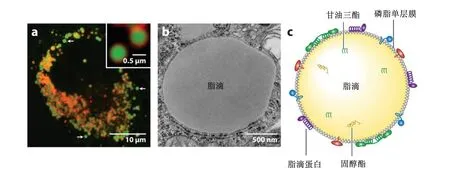
a:荧光显微镜拍摄的人乳腺癌细胞SUM159中的脂滴(绿色荧光) lipid droplets (green fluorescence) in human breast cancer cell SUM159 photographed by fluorescence microscope;b:电镜下果蝇S2细胞中的脂滴 lipid droplets in S2 cells of Drosophila melanogaster under electron microscope;c:脂滴结构模式图 lipid droplet structure model diagram。
脂滴是细胞中唯一具有单层膜结构的细胞器,构成膜的磷脂主要包括磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇、溶血磷脂酰胆碱和溶血磷脂酰乙醇胺等[14],磷脂的种类对脂滴的形态和功能维持至关重要。在脂滴形成的起始阶段,脂滴膜中的磷脂来源于内质网的外侧膜。此后,为了维持脂滴的不断生长和内质网膜的稳定,内质网必须持续合成磷脂并转运至脂滴和内质网膜中[15],但是维持并动态调整脂滴膜磷脂构成的机制尚未被阐明。
脂滴核心主要由甘油三酯和固醇酯构成,其比例因细胞种类和状态而异。目前已在其中发现了100多种中性脂肪[16-18],而且随着检测技术的发展,可能会有更多种脂质被发现。脂滴核心成分的多样性,也从另一个侧面印证了脂滴生物学功能的多样性。脂滴核心可能具有一定的内部结构,冷冻电镜观察到脂滴核心呈洋葱状的同心结构[19],提示核心中不同脂质可能呈规律性的分布。这种内部结构会随着有丝分裂或营养匮乏等细胞状态及所处内环境的变化而发生重构,转变为另一种由固醇酯构成的液晶外壳包裹内部无定型核的结构[20],但这种结构转变的生物学意义尚不完全清楚。
2 脂滴的特性
2.1 脂滴蛋白及其分类
脂滴通过结合在其膜上的各类蛋白质发挥其生物学功能[21]。哺乳动物细胞脂滴蛋白组由100~150种蛋白质构成[21],而在酵母中有35~40种[22]。另外,脂滴蛋白组随细胞种类及细胞所处状态的不同而有所变化。研究结果表明,体外培养的小鼠和人类脂肪细胞在诱导脂肪分解后,脂滴蛋白组的构成会发生显著变化[23-24]。脂滴蛋白一般是指结合在脂滴表面的蛋白质,至于脂滴内部是否有蛋白质存在尚无定论。有相关研究从脂滴核心中检测到了蛋白质[25-28],这些蛋白质都兼具亲水和疏水结构域,可以和磷脂结合为复合体而稳定地分散在脂滴核心的脂质中,但这些蛋白的生物学功能尚待研究。由此可见,深入解析数量众多的脂滴蛋白的作用机制,既是未来脂滴研究领域的一大挑战,也将为彻底阐明脂滴在细胞生命活动中的生物学功能提供依据。
根据脂滴蛋白的功能可将其划分为以下几类:1)作为脂质代谢的酶介导脂滴的生长、成熟和分解的蛋白,包括催化甘油三酯合成的酶类,例如长链酰基辅酶A合成酶3(long chain acyl-CoA synthetase 3,ACSL3)[29]、甘油-3-磷酸酰基转移酶4(glycerol-3-phosphate acyltransferase 4,GPAT4)[6]和二酰甘油酰基转移酶2(diacylglycerol acyltransferase 2,DGAT2)[30]等,以及催化甘油三酯分解的酶类,例如脂质分解的限速酶脂肪甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)[31]以及激素敏感脂肪酶(hormone-sensitive lipase,HSL)[32]等;2)围脂滴蛋白(perilipin,PLIN)家族,共有5个家族成员,包括PLIN1~PLIN5。PLIN家族在稳定脂滴结构、整合营养调控信号、调控脂质分解以及在脂滴与其他细胞器接触位点锚定功能蛋白等生物学过程中发挥重要作用[33-35];3)与脂滴形态调整相关的蛋白质,参与调控脂滴的融合及在细胞中的转运,主要包括诱导细胞凋亡DFF45样效应因子(cell death-inducing DEF45-like effector,CIDE)[36]、微管蛋白及其他细胞骨架蛋白[37],以及可溶性N-乙基马来酰亚胺敏感蛋白受体(soluble N-ethylmaleimide-sensitive protein receptor,SNARE)[38]等,其中CIDE家族蛋白有CIDEa、CIDEb和CIDEc这3个成员,在脂肪组织中高表达,主要介导脂肪细胞中脂滴的相互融合[39-41];4)参与蛋白质降解的相关蛋白,包括泛素特异蛋白酶33(ubiquitin specific protease 33)[42]、原始广泛存在蛋白1(ancient ubiquitous protein 1,AUP1)[5]、UBX结构域蛋白8(UBX domain-containing protein,UBXD8)[43-44],这些蛋白质存在于脂滴表面说明脂滴也参与细胞中蛋白质的降解;5)促使脂滴与其他细胞器形成稳定接触位点并建立物质传递通道的蛋白质[45-46],例如Ras相关GTP结合蛋白(Ras-related GTP binding protein,RAB)与N-乙酰-β-葡萄糖苷酶(N-acetyl-beta-glucosaminidase,NAG)、Rad50整合蛋白1(Rad50 interactor 1,RINT1)和Zeste White 10(ZW10)形成复合体可使脂滴和内质网建立紧密接触以保障脂滴的生长[47-48],微管切割蛋白Spastin可通过与ATP结合盒亚家族转运蛋白D1(ATP binding cassette subfamily transporter D member 1,ABCD1)结合使脂滴与过氧化物酶体接触,通过招募内体分选转运复合物-Ⅲ(endosomal sorting complex required for transport-Ⅲ,ESCRT-Ⅲ)蛋白建立通道促使脂肪酸向过氧化物酶体转运[49];6)其他蛋白质,这些蛋白质大多是折叠错误或待降解的蛋白质,在这里脂滴扮演了蛋白暂存库的角色,以协助内质网启动未折叠蛋白反应(unfolded protein response,UPR)来消除蛋白质毒性胁迫[50-51]。另外,已在多种生物的脂滴表面检测到了组蛋白[52-54]。需要说明的是,由于对脂滴的生物学功能仍缺乏全面、清晰的认识,很多脂滴蛋白的功能仍待进一步研究。随着相关研究结果的积累,以上分类可能会进一步细化和扩展。
2.2 脂滴蛋白与脂滴膜的定向结合
脂滴蛋白研究需要阐明的另一个问题是,这些蛋白质是如何定向结合到脂滴膜上的。序列分析结果表明脂滴蛋白普遍缺乏信号肽的引导,所以其与脂滴膜的定向结合机制可能不同于其他细胞器膜蛋白。已有的研究结果表明,脂滴蛋白分别来自内质网和细胞质[55],不同来源的蛋白质与脂滴膜的结合方式亦不同(图2)。

图2 脂滴蛋白与脂滴膜的定向结合
来自内质网膜的蛋白质具有一个发卡状的疏水跨膜结构域[56],此类蛋白质一般先与内质网的外侧膜结合,然后再转运至脂滴膜上,由于内质网和脂滴膜蛋白组的构成存在明显差异,推测这种蛋白转运并非自由进行,但相关调控机制尚未明确。Puza等[57]通过微流控技术制作了磷脂双层膜结构以模拟内质网的膜结构。将该膜结构与微脂滴混合,发现微脂滴会自发嵌入双层膜中形成晶状体样的结构,但在微脂滴膜和双层膜结构分界面上观察到明显的磷脂扩散屏障,该屏障可能在限制脂滴膜和内质网膜之间磷脂和蛋白的转运中发挥重要作用。有研究揭示了脂滴蛋白UBXD8的转运机制,该过程由过氧化物酶体生物合成因子Peroxin 19(PEX19)和Peroxin 3(PEX3)介导,细胞质中的PEX19首先与UBXD8蛋白的疏水片段结合,然后PEX19通过与定位在内质网膜上的PEX3结合而将UBXD8定向转运至内质网膜表面,UBXD8通过其发卡状的疏水跨膜结构域插入内质网外侧膜,随后被转运到脂滴膜上[58]。PEX3聚集的区域是否是脂滴发生的区域,以及UBXD8定向转运的机制是否也适用于其他脂滴蛋白值得进一步研究[2,56]。Song等[59]的研究结果显示,来自内质网的膜蛋白分别通过2个途径转移到脂滴膜上,一是在脂滴形成阶段通过由Seipin及其附属蛋白组成的脂滴组装复合体(lipid droplet assembly complexes,LDACs)转移至脂滴膜上,这类膜蛋白一般是GPAT4、ACSL3等膜蛋白产生的一些片段;而完整的GPAT4及其他一些蛋白需要通过另一条途径,即通过膜融合机制在成熟脂滴膜和内质网膜之间建立桥状结构,使这类膜蛋白可以从内质网膜转移至脂滴膜上,至于哪些膜蛋白分别通过这2种途径完成转移,以及是否还存在其他转移途径尚待进一步研究。
来自细胞质的脂滴蛋白一般认为由细胞质中的核糖体合成,然后直接插入到脂滴膜中,主要包括PLIN家族蛋白、CIDE家族蛋白和磷脂酰胆碱胞苷转移酶(choline-phosphate cytidylyltransferase,CCT)等。这类蛋白大多具有两亲的α螺旋结构,可以通过其亲脂侧链向外、亲水侧链向内而形成1个外侧整体亲脂的螺旋,进而插入到脂滴膜中[60]。另有研究结果表明,与其他细胞器的磷脂双分子层膜相比,脂滴的磷脂单分子层膜更为不稳定。脂滴球形结构的表面张力,以及内部中性脂肪趾突状结构的扰动更是加剧了其膜的不稳定性,但这也为脂滴膜蛋白两亲α螺旋的插入创造了很好的条件[61-62]。PLIN家族蛋白成员肽链末端均有11个氨基酸残基构成的重复序列,用于形成两亲的α螺旋结构[63]。PLIN4的11个氨基酸残基重复序列形成了至少包含60个氨基酸残基的超长两亲α螺旋,可穿过脂滴膜与核心的甘油三酯结合,从而起到稳定脂滴单层膜结构的作用[64]。PLIN1~PLIN3 C端的4个两亲α螺旋捆绑形成的结构域也可能通过同样的机制发挥作用[63]。另有一些脂滴蛋白通过其肽链上大量的疏水氨基酸残基插入并结合到脂滴膜上[65]。还有部分脂滴蛋白通过棕榈酰化、豆蔻酰化和异戊烯化等脂肪酸修饰而获得一个亲脂侧链并借此锚定在脂滴膜上[66-68]。由此可见,来自细胞质的脂滴蛋白亦是通过多个途径结合到脂滴膜上的,至于是否还有其他的定向结合机制仍待进一步研究。此外,不论是两亲α螺旋结构,还是脂肪酸修饰均在细胞内膜蛋白中普遍存在,而且细胞内的膜结构也广泛分布,以上提到的几种脂滴蛋白结合方式也适用于其他细胞器膜蛋白,那么脂滴蛋白是在什么机制的作用下准确定位在脂滴膜上的目前仍未被阐明。
2.3 脂滴形态的动态变化
脂滴是细胞内比较活跃的一个细胞器,随着细胞代谢状态的变化,脂滴的大小、分散状态以及与其他细胞器的接触均会发生相应的调整,并具有重要的生物学意义。在棕色和米色脂肪细胞中,脂滴以多个小脂滴的状态存在,而在白色脂肪细胞中脂滴大都融合为一个大脂滴。Kim等[69]的研究结果表明,脂滴的这种分散状态与脂肪细胞对胰岛素的敏感性直接相关,且脂肪细胞通过调整细胞中肌动蛋白的状态来影响脂滴的分散状态。在棕色和米色脂肪细胞肌动蛋白呈聚合的丝状,葡萄糖转运蛋白4(glucose transporter 4,GLUT4)在胰岛素存在的情况下可被高效转运到细胞膜附近,而在白色脂肪细胞中肌动蛋白解聚成单体状态,葡萄糖转运蛋白的转运受到抑制,所以棕色和米色脂肪细胞吸收葡萄糖的能力要远高于白色脂肪细胞[70]。
脂肪细胞中脂滴可以通过相互融合而不断生长,CIDE家族蛋白成员在介导该过程中发挥重要作用[71]。CIDE通过其C端的两亲α螺旋结合在脂滴膜上,当2个脂滴接触时,其表面的CIDE相互结合而形成1个连接结构将它们稳定地结合在一起,该结构可能是1个孔状或者管状的结构,较小脂滴中的甘油三酯在内部压力和表面张力差的作用下通过该结构进入较大脂滴[40]。在白色脂肪细胞中,脂滴的这种融合事件会持续发生,最终在细胞内形成一个大脂滴。同时CIDE可以显著抑制HSL在脂滴表面的定位,进而在促进脂滴融合的同时降低了脂质的水解,从而实现了脂滴的不断生长[72]。PLIN1和RAB可以促进脂滴间脂质的转运及脂滴的融合[41,73]。CIDE在脂滴间接触位点处形成的复合体结构,以及该结构是否还有其他蛋白参与尚待进一步研究。另外,该结构无法介导脂滴膜磷脂和蛋白的转运。小脂滴中的脂质转入大脂滴后,其脂滴膜和膜蛋白是如何融入大脂滴的目前仍没有明确结论。
脂滴的融合是一个可逆的过程,当细胞的代谢状态发生变化时,大脂滴仍可以裂解成小脂滴。采用“天花板培养法”(ceiling culture)培养的成熟脂肪细胞会发生去分化(dedifferentiation),细胞中的大脂滴会逐步裂解为小脂滴,并最终几乎完全消失,脂肪细胞也随之转变为成纤维样细胞,称之为去分化脂肪细胞(dedifferentiated fat,DFAT)。在适当的培养基中,DFAT细胞又可再次分化为脂肪细胞,脂滴又重新出现并再次融合[74]。成熟脂肪细胞在去分化的过程中脂滴的清除机制目前仍待研究,脂质分解的加速在该过程中发挥一定作用,但脂滴的清除似乎还有其他途径。笔者前期的研究结果显示,部分脂滴是通过类似于乳腺上皮细胞顶浆分泌的方式直接被排出细胞外的。脂肪细胞的这种可逆的去分化在体内亦可发生。Wang等[75]的研究结果表明,小鼠乳腺中的脂肪细胞会随着小鼠妊娠、哺乳和断奶的转变而反复出现去分化和再分化。在肝细胞脂质代谢中,脂解和脂噬一般协同进行,大脂滴首先在ATGL等脂类分解酶的作用下裂解为一些小脂滴,以使溶酶体能够顺利将其内化,以进行进一步酶解[76]。
细胞还可以直接将小脂滴释放到组织中发挥其生物学功能[77-78]。Flaherty等[77]的研究发现,组织脂肪细胞中的大脂滴以出芽的方式产生小脂滴并释放到组织中,通过促进组织巨噬细胞的分化而发挥免疫调理的作用。健康小鼠每天通过这种方式释放的脂质几乎是肥胖小鼠的2倍,这可能与肥胖动物通常具有较低的免疫力有一定关系。牛奶中的脂肪球是由乳腺上皮细胞合成分泌的。脂滴由乳腺上皮细胞内质网合成后进入细胞质,期间脂滴也会发生融合事件。泌乳时这些脂滴被转运到上皮细胞顶端细胞膜附近,然后以顶浆分泌的方式被释放到乳汁中。脂肪球的大小受多种机制的调控,并与牛奶的品质直接相关[78],但是到目前为止,人们对上述过程的具体细节及其调控机制仍缺乏深入的理解。
3 脂滴与其他细胞器的相互作用及其生物学功能
脂滴几乎可以与细胞中所有的细胞器通过相互接触而建立联系(图3),这是脂滴发挥其生物学功能的结构基础。已有的研究结果表明,脂滴膜蛋白和其他细胞器膜蛋白相互结合而形成桥状结构,是二者建立联系并发挥生物学功能的关键,该过程一般不会引起膜的相互融合。但是到目前为止,有关参与相互作用的蛋白质,以及该过程的调控机制仍知之甚少,以下仅介绍近年来研究较多的一些相互作用。

carnitine shuttle:肉碱穿梭;FFA:游离脂肪酸 free fat acid;TAG:甘油三酯 triglyceride;lipolysis:脂类分解;Pah1:磷脂酸水解酶1 phosphatidic acid hydrolase 1;acyl-CoA:酰基辅酶A;Faa1:脂肪酸酰基辅酶A合成酶1 fatty acid acyl-CoA synthetase;Tsc13:温度敏感CSG2抑制蛋白13 temperature-sensitive CSG2 suppressor protein 13;DAG:甘油二酯 diglyceride;LD:脂滴 lipid droplet;Mito:线粒体 mitochondria;Lyso:溶酶体 lysosome;ER:内质网 endoplasmic reticulum;Pex:过氧化物酶体 peroxisome;G3P:甘油醛-3-磷酸glyceraldehyde-3-phosphate;LPA:溶血磷脂酸 lysophosphatidic acid;PA:磷脂酸 phosphatidic acid;AGPAT:酰基甘油-3-磷酸酰基转移酶 acylglycerol-3-phosphate O-acyltransferase;SPT:丝氨酸软脂酰转移酶 serine palmitoyltransferase;LCB:长链鞘氨醇激酶 long chain sphingoid kinase;FATP1:脂肪酸转运蛋白1 fatty acid transporter protein 1。
3.1 脂滴与内质网的相互作用及其生物学功能
有研究表明,哺乳动物细胞中约有85%的脂滴仍与内质网保持稳定的联系[80],并在膜蛋白形成的复合体的支持下建立桥状结构。脂滴和内质网的这种持续的接触是如何建立的,有何功能目前尚不完全清楚,推测可能与有利于内质网中脂质及其膜蛋白持续向脂滴转运[59,81],以及高效响应未折叠蛋白反应激活的内质网应激反应[82]等生物学功能有关。ADP核糖基化因子1和包被蛋白复合物Ⅰ(ADP ribosylation factor 1 and coat protein complex Ⅰ,ARF1-COPⅠ)复合体的激活,可能在诱导脂滴和内质网建立桥状结构中发挥重要作用[83],Seipin则扮演着稳定该结构的作用[84]。随后GPAT4、CIDE等其他蛋白从内质网膜转移至脂滴膜上[59],脂质合成相关的酶被招募到内质网和脂滴接触位点持续进行甘油二酯的合成[85],进而促使脂滴不断生长。脂质转运蛋白(lipid-transfer protein,LTP)定位在脂滴和内质网接触位点上,可能在介导脂滴膜和内质网膜磷脂转运中发挥着重要作用。氧化固醇结合蛋白(oxysterol-binding protein,OSBP)及其关联蛋白(OSBP-related protein,ORP)是重要的脂质转运蛋白家族成员,有研究观察到ORP2和ORP5在脂滴和内质网接触位置大量富集,并且ORP5介导了磷脂酰丝氨酸从内质网膜向脂滴膜的转运以及磷脂酰肌醇-4-磷酸从脂滴膜向内质网膜的转运[86]。在脂滴和内质网接触位置还结合着其他一些蛋白质,例如自噬相关蛋白2(autophagy-related protein 2,ATG2)、液泡蛋白分选蛋白13a(vacuolar protein sorting protein 13a,VPS13a)和液泡蛋白分选蛋白13c(vacuolar protein sorting protein 13c,VPS13c)等,可能在介导脂质快速转移中发挥作用[87]。所以,未来应对脂滴和内质网接触位点脂质转运蛋白及其功能进行深入研究,以彻底阐明脂滴形成过程中脂滴膜和内质网膜磷脂转运的机制。
3.2 脂滴与过氧化物酶体的相互作用及其生物学功能
过氧化物酶体在长链脂肪酸的β氧化中发挥重要作用。为了提高长链脂肪酸氧化的效率,使脂滴和过氧化物酶体靠近并建立联系尤为重要[80]。但脂滴和过氧化物酶体如何建立联系并发挥其生物功能,目前仍待进一步研究。由于脂滴和过氧化物酶体都来源于内质网,且均在内质网的同一个位置形成[88],推测二者膜磷脂和膜蛋白构成比较接近,这也能更有利于脂滴和过氧化物酶体建立联系。有研究表明,当油酸成为酵母的唯一碳源时,酵母细胞中的过氧化物酶体迅速增加,并观察到大量脂滴与过氧化物酶体持续接触。脂滴膜与过氧化物酶体外侧膜融合,这可能有利于过氧化物酶体双分子层膜腔室中的酶与脂滴中的甘油三酯充分接触而加快反应速度[89],至于多细胞动物脂滴和过氧化物酶体之间是否也存在这种反应机制尚待研究。Chang等[49]的研究表明,脂滴膜蛋白M1 Spastin可以招募内体分选转运复合物III蛋白形成复合体,通过与过氧化物酶体膜蛋白ABCD1相互作用,使脂滴与过氧化物酶体结合并促进脂肪酸的转运。线虫和小鼠中的研究结果表明,在饥饿状态下过氧化物酶体借助于驱动蛋白C3(kinesin family member C3,KIFC3)沿着微管向脂滴移动并与之接触,同时蛋白激酶PKA磷酸化过氧化物酶体蛋白PEX5,然后磷酸化的PEX5将甘油三酯脂酶空间特异地转移到脂滴上以加速脂质分解,保证有机体能量供应[90]。由于已有的研究结果均来自不同的细胞,所以已发现的脂滴和过氧化物酶体的不同作用方式是由于细胞类型不同造成的,还是每种细胞本身有多种方式仍待进一步研究。
3.3 脂滴与线粒体的相互作用及其生物学功能
在代谢旺盛的细胞中均观察到大量线粒体与脂滴接触[91-93]。当人处于高强度运动状态时,骨骼肌细胞中的脂滴被线粒体夹在中间形成“三明治”样的结构,以确保脂肪酸的高效转运及能量的快速释放[94]。而在成熟白色脂肪细胞中,大量的线粒体通过自噬作用而被清除,线粒体和脂滴的相互作用也大都被解除[95],这也与白色脂肪细胞处于能量储存的细胞状态相适应。当白色脂肪细胞转变为棕色脂肪细胞时,细胞中的线粒体再次大量出现,白色脂肪细胞中的大脂滴逐步分解为小脂滴,并与线粒体大量接触[96]。
有研究发现,与细胞质中游离的线粒体(cytoplasmic mitochondria,CM)相比,与脂滴接触的线粒体(peridroplet mitochondria,PDM)结构和功能均发生了变化。在棕色脂肪细胞中,PDM氧化丙酮酸和苹果酸及生成ATP的能力更强,但氧化脂肪酸的效率下降,且PDM之间不会发生融合事件,即使过表达线粒体融合蛋白2(mitofusin 2,Mfn2),也不会引起PDM间的融合,所以PDM的运动性显著降低[91]。同时,脂滴利用PDM产生的ATP合成脂质,使脂滴体积不断增大[91]。所以在棕色脂肪细胞中就出现了2种相反的代谢过程,CM通过高效氧化脂肪酸供能[91],使脂滴不断分解,而PDM则将合成的ATP提供给与之接触的脂滴用于其脂质合成而使脂滴不断生长。上述过程看似矛盾,但可能是细胞维持能量持久供应的重要保障机制。因为棕色脂肪细胞和米色脂肪细胞大多出现在代谢旺盛、能量需求量大的生理状态,脂质合成和分解同步进行,才可避免储存的脂质快速耗尽,进而更好地保障能量的稳定供应。但这种机制是否也适用于其他细胞目前仍不明确。另外,PDM在不同细胞中表现出不同的代谢状态[91,94]提示其功能可能存在细胞差异。
目前对脂滴和线粒体结合的机制,及其发挥生物学功能的结构基础仍知之甚少。过表达PLIN5会促进脂滴和线粒体的接触[97],且PLIN5可以通过与ATGL的相互作用而抑制脂质分解[98],这与棕色脂肪细胞中PDM脂肪酸氧化能力下调的研究结果相一致,所以推测PLIN5可能介导了脂滴和线粒体的相互作用。DGAT2共定位在脂滴、线粒体和内质网膜上,可以将这3个细胞器直接结合在一起[99],该过程可能还涉及其他一些膜蛋白。由于DGAT2可以高效酯化二酰甘油生成三酰甘油,所以细胞借助DGAT2将线粒体、内质网和脂滴偶联起来,可高效利用线粒体生产的ATP进行脂质的合成,进而实现脂滴的快速生长。这也可从另一个层面解释在棕色脂肪细胞中观察到的PDM功能的转变[91]。在棕色脂肪细胞中,脂滴膜蛋白PLIN1可与线粒体融合蛋白Mfn2互作形成复合体,使脂滴和线粒体结合在一起。敲除Mfn2后脂滴和线粒体的接触将减少50%[100]。Wang等[101]的研究结果表明,在线粒体和脂滴接触位点处,液泡蛋白分选相关蛋白13D(vacuolar protein sorting-associated protein 13D,VPS13D)与肿瘤易感基因101(tumor susceptibility gene 101,TSG101)蛋白配合使脂滴膜发生重塑,进而促进脂滴脂肪酸向线粒体的转运。另外,已有的研究结果表明,在脂滴和线粒体接触位点上的很多蛋白,同时也出现在脂滴和内质网的接触位点上,且已有研究观测到这3个细胞器存在相互接触,提示线粒体和脂滴的接触可能参与脂滴的生成。
3.4 脂滴与溶酶体的相互作用及其生物学功能
脂滴与溶酶体的接触有利于脂滴膜蛋白和脂质的水解,同时脂滴膜也为自噬体的生成提供膜磷脂[102]。脂滴膜蛋白PLIN2和PLIN3通过分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)被溶酶体清除,在此过程中PLIN2和PLIN3的特异性五肽基序借助伴侣蛋白热激同源蛋白70(heat shock cognate protein 70,Hsc70)被溶酶体膜上的受体溶酶体相关膜蛋白2A(lysosome-associated membrane protein 2A,LAMP2A)识别结合,并被转运进入溶酶体内水解[103]。敲除受体溶酶体相关膜蛋白2A的小鼠表现出肝脏脂肪变性[104],而成纤维细胞若缺失受体溶酶体相关膜蛋白2A将导致脂滴数量增加,以及由于脂肪酸氧化效率降低而造成甘油三酯积累等问题[103],其他脂滴蛋白是否也通过该机制清除尚待阐明。此外若PLIN2的特异性五肽基序发生突变将阻断脂滴和溶酶体的接触,进而导致脂滴分解停滞以及大量脂滴的聚集[103]。由此推测,PLIN2和PLIN3可能先借助分子伴侣介导的自噬将脂滴和溶酶体结合在一起,然后再启动PLIN2和PLIN3的内化和水解。另有研究证实,GTP酶RAB7可以调控溶酶体与脂滴的接触,但RAB7是否通过分子伴侣介导的自噬发挥作用尚待研究[105]。
4 脂滴的其他生物学功能
脂滴核心中除了储存甘油三酯和固醇酯以外,还包含脂溶性维生素和脂类信号分子前体等成分。肝星状细胞脂滴中储存了占整个有机体70%~80%的维生素A(视黄醇),以避免维生素A摄入不足对相关生理活动的影响,以及缓冲短期维生素A过量摄入造成的毒性。储存在肝星状细胞脂滴中的视黄醇酯在水解酶的作用下释放出视黄醇,然后转运至肝细胞中发挥作用[106],但是水解视黄醇酯的酶,以及视黄醇转运的机制仍待进一步研究。另外,脂滴中还包含哪些脂溶性维生素及其调控机制目前仍缺乏认识。脂滴内的疏水环境还为固醇类激素和脂肪酸类信号分子前体的储存及其加工提供了良好的条件,同时脂滴蛋白组学的研究结果表明脂滴含有固醇类激素和脂肪酸信号分子加工所需的相关酶类,也从另一个侧面证实了脂滴可能在该类信号分子调控中的作用[107-108]。
脂滴还对细胞应对各类应激具有重要意义。细胞会由于游离脂肪酸过量、营养匮乏或者氧化还原反应失衡等因素而遭受各类应激反应,此时脂滴可以通过隔离过量脂质、维持膜磷脂稳定性等帮助细胞应对应激反应造成的结构损伤和机能失调[109]。相关研究表明,当细胞内活性氧(reactive oxygen species,ROS)的水平超过了谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)、超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)等酶类的处理能力时,细胞就会遭受氧化应激反应的损伤,在癌症和非酒精脂肪肝等病变中均可观察到与氧化应激相关联的脂滴集聚[110],但其功能尚未得到深入的阐释。氧化应激往往导致自噬作用上调,进而导致氨基酸、脂肪酸等大量释放,为了缓解其对细胞的损伤,部分脂肪酸迅速被重新酯化并转入脂滴储存,这可能是导致脂滴数量增加的重要因素[111]。
脂滴通过协助病毒衣壳蛋白的组装而在促进病毒感染中发挥着重要作用。登革热病毒进入宿主细胞后首先诱导脂噬作用上调,大量脂质的氧化为病毒的复制提供了充足的能量,同时其衣壳蛋白在宿主细胞内质网中合成后转移到脂滴表面组装成为病毒粒子[112]。丙型肝炎病毒感染细胞后病毒RNA首先转录出1条多肽链,进而水解为10种病毒蛋白,这些蛋白大部分与内质网相结合,但核衣壳核心和一部分非结构蛋白NS5A与脂滴结合[113]。结合在内质网上的NS5A形成双层膜结构的小囊泡(double-membrane vesicle,DMV),该位置可能同时是病毒RNA复制的位点。另外,推测在NS5A的介导下脂滴和内质网相结合,并最终协助完成病毒粒子的组装[114]。但脂滴促进病毒粒子组装的详细机制仍未被阐明,脂滴可能在该过程中发挥富集衣壳蛋白的作用,因为丙型肝炎病毒蛋白可以诱导脂滴向病毒复制位置集聚,进而更有利于病毒粒子的高效组装[115]。
脂滴参与组蛋白的暂时储存。动物卵细胞在发育过程中除了要将大量的脂质储存在脂滴中,以满足早期胚胎发育的能量需求,同时还会储备足量的组蛋白,以支持早期胚胎细胞迅速分裂时染色质的组装,其中组蛋白H2A和H2B通过Jabba蛋白的介导而被大量储存在脂滴表面[116]。与脂滴结合的组蛋白可能从2个方面发挥作用:一是满足胚胎发育早期染色质的快速组装;二是通过结合部分组蛋白而避免组蛋白快速合成而导致的组蛋白过量[116-117]。此外,在家蝇、小鼠等多种动物的卵母细胞以及早期胚胎脂滴表面也检测到了组蛋白。但由于组蛋白在细胞内大量存在,部分研究中检测到的与脂滴结合的组蛋白,也有可能是提取过程中造成的污染。
脂滴还在机体对抗细菌感染方面发挥作用。Bosch等[118]研究发现,不论是通过注射脂多糖诱导感染的小鼠,还是细菌确实感染的小鼠,均检测到细胞中脂滴数量的迅速增加。且与正常小鼠细胞中分离的脂滴相比,从感染小鼠细胞中分离的脂滴对体外培养的大肠杆菌具有更强的抑制性。另外,在受大肠杆菌感染的人巨噬细胞中也观察到了同样的现象。进一步研究发现,受到病原体感染后,脂滴表面脂质代谢的相关蛋白数量下调,但抗菌肽等与免疫相关的一些蛋白数量上调,进而表现出其抗菌活性,所以脂滴可能是细胞抵抗病原微生物入侵的第一道防线[52,118]。此外,脂滴蛋白PLIN5被磷酸化后,还可以作为脂肪酸结合蛋白与来源于脂滴的单不饱和脂肪酸结合,并将其转运至细胞核中,通过激活Sirtuin1(SIRT1)而增强过氧化物酶增殖激活受体γ共激活子1α(peroxisome proliferators activated receptor γ coactivator 1 alpha,PGC-1α)/过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor alpha,PPARα)信号通路加速细胞的氧化代谢[119]。
另外,脂滴参与细胞内一些蛋白质的周转。载脂蛋白B-100(apolipoprotein B-100,ApoB-100)和3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMG-CoA)还原酶在被转运至蛋白酶体前,首先与脂滴结合并在其表面累积,这可能是防止待降解的蛋白在细胞中任意聚集的一种机制。随后这些蛋白被泛素化修饰后由脂滴转运至蛋白酶体降解[48]。由于载脂蛋白B-100和3-羟基-3-甲基戊二酰辅酶A还原酶在脂质代谢调控中发挥重要作用,细胞可能通过脂滴介导其降解而更为精准地调控脂质代谢。至于脂滴还参与哪些蛋白的周转,以及该过程是细胞内独立的蛋白质周转路径,还是作为蛋白酶体清除路径失效后的一个备用的方案,或者是细胞借此调控某些蛋白质生物学功能的一个手段仍未有明确结论。
5 小结和展望
在过去很长一段时间里,脂滴都仅被作为一种储存脂质的细胞器进行研究。近年来,随着人们对脂滴生物学功能认识的不断深入,以及与脂质代谢相关疾病的发病率日益增高,脂滴多样化的生物学功能也日益引起人们的关注。但是到目前为止,与其他细胞器相比人们对脂滴的认识仍相对有限,其很多生物学过程仅有初步了解,而对其细节仍知之甚少,部分仍待进一步阐释的问题已在文中提出,在此不再赘述。未来随着组学技术的快速发展,以及针对脂滴的特异性荧光探针开发[120]等相关研究手段的改进,人们对于脂滴的生物学功能必然会有一个更为深入的认识,这将对畜牧业中畜禽肉品质的改善,以及人类脂质代谢相关疾病的治疗产生积极的推动作用。
