外源供给硬脂酸对工蜂10-羟基-2-癸烯酸合成的影响
2024-04-02胡希怡李馥霞宋美英胥保华
胡希怡 王 颖 李馥霞 宋美英 胥保华*
(1.临沂大学农林科学学院,临沂 276000;2.山东农业大学动物科技学院,泰安 271018;3.临沂市农业科学院,临沂 276002)
蜂王浆是由工蜂咽下腺和上颚腺分泌的乳状物,是供给将要变成蜂王的幼虫的食物,也是蜂王终身的食物[1-3]。蜂王浆具有抗炎、抗菌、抗氧化和其他多种药理活性,被广泛应用于制药、化妆品和食品工业[4-5]。由于蜂王浆具有抗肿瘤、抗过敏、抗炎、调节免疫等多种生物活性[2],可作为功能性食品和膳食补充剂[6],备受人们青睐。我国作为蜂王浆的最大生产国,每年向日本、欧盟、美国等发达国家和地区出口蜂王浆1 400多t,约占全球贸易额的90%[7]。
蜂王浆是一种复杂的混合物,由水(50%~60%)、蛋白质(18%)、碳水化合物(15%)、脂质(3%~6%)、微量矿物质、水溶性维生素、游离氨基酸和许多其他不明化合物组成[8]。蜂王浆的pH在3.6~4.2[9],其脂质主要由中链脂肪酸组成,含有8~12个碳原子,主要是羟基或二羧酸[10]。蜂王浆的脂质中有80%~90%的稀有游离脂肪酸,主要脂肪酸是10-羟基-2-癸烯酸(10-HDA)[11-12]。蜂王浆中的脂质还包括癸二酸[13]、8-羟基辛烷、3,10-二羟基癸二酸、9-羟基-2-癸二酸、3-羟基癸酸、2-癸烯-1,10-二甲酸和少量甾醇[7,12]。
10-HDA是蜂王浆中特有的活性物质[14]。10-HDA化学稳定性,因此10-HDA含量被认定为评价蜂王浆质量和新鲜度的国际标准[15]。饲料来源、蜜蜂的生理和代谢状态、幼虫日龄和蜂种均影响蜂王浆的组成[16]。有研究表明,硬脂酸是10-HDA合成的最适前体[17]。首先,硬脂酸在ω位发生羟基化,生成ω-羟基硬脂酸,羟基化的硬脂酸进行不完全的β-氧化,功能基团修饰,最终生成10-HDA[18-19]。目前,有关食物(尤其是脂肪酸)供应对工蜂上颚腺中10-HDA合成影响的研究较少。本研究以由原种意大利蜜蜂(Apismelliferaligustica)选育而来的高产品种浆蜂为研究对象,通过在饲粮中添加硬脂酸,探讨外源供给硬脂酸对浆蜂群势、封盖子数量、蜂王浆产量与10-HDA含量以及10-HDA合成相关基因表达的影响,以期为高品质蜂王浆的生产提供技术指导。
1 材料与方法
1.1 试验时间及蜂群
试验于2021年4—5月在山东农业大学动物科技学院试验蜂场(36.16°N,117.16°E)进行,试验蜂群为浙江浆蜂(引进意大利蜜蜂经过长期选育后的王浆高产蜂种)。4月份最高温度平均为19 ℃,5月份最高温度平均为24 ℃,以多云和晴天为主。蜂场位于城市边缘区,周围3 km内有零星野花,无大宗蜜粉源植物。
1.2 试验设计
本试验选取群势一致、健康无病的浙江浆蜂10群(大致群势11框蜂,3张子脾,4张蜜脾,越冬后2月10日放王产卵),随机分为2组,即对照组和硬脂酸组,每个组5群。试验开始前,将蜂群群势调整至一致,并将群内粉脾移走,根据群势情况补充子脾或者空巢脾。对照组饲喂基础饲粮,硬脂酸组饲喂在基础饲粮中添加2%硬脂酸(纯度为98%)的饲粮。整个试验期75 d,其中预试期15 d,正试期60 d。预试期开始前,各组蜂群安装脱粉器,以控制外勤蜂采进花粉。基础饲粮组成及营养水平见表1。试验期间,将粉料、水和蔗糖按一定比例(1.00∶0.68∶1.50)揉制成团,放置在隔王板上供工蜂采食。饲粮每3 d更换2次。

表1 基础饲粮组成及营养水平(风干基础)
1.3 指标测定及方法
1.3.1 蜂群采食量的测定
正式试验期间,记录每次投喂的饲粮重量及剩余饲粮重量,统计试验期间各蜂群的总采食量,并计算出粉料采食量。
1.3.2 蜂群群势及封盖子数量的测定
试验开始前,对每个蜂群的群势进行调整,使每个蜂群的封盖子及成蜂群势基本保持一致。正式试验开始后,每隔12 d(第12天、第24天和第36天)观察并记录各组蜂群群势、封盖子数量。试验采用设计好的木制巢脾框(巢脾框中部被细线分隔成45个大小一致的格子,尺寸为4.6 cm×4.0 cm)记录蜂群群势及封盖子数量。蜂群群势以足框蜂进行统计,并详细记录每张脾上封盖子的面积,计算各蜂群的群势及封盖子数量。
1.3.3 生产蜂群产浆量的测定
于正式试验开始21 d后进行取浆。双排浆条共126个台基,台基预先用少量的蜂王浆湿润。移取1日龄幼虫至台基中,将浆框放于继箱中哺育,大约70 h后钳虫取浆于50 mL离心管中,称重,转入-20 ℃冰箱保存,用于蜂王浆中10-HDA含量检测。本试验共取浆3次,取浆期间对蜂群奖励饲喂糖水,以提高幼虫接受率和刺激蜂群产浆的积极性。
1.3.4 蜂王浆中10-HDA含量的测定
蜂王浆中10-HDA含量参照GB 9697—2008中方法进行测定。蜂王浆样本于室温解冻后,将3次所取蜂王浆样本混合均匀后称取0.5 g置于50 mL容量瓶中,加入1 mL盐酸(0.03 mol/L)和2 mL重蒸馏水,振荡混匀,加入10 mL内标溶液(0.653 mg/mL对羟基苯甲酸甲酯溶液),无水乙醇定容,摇匀后超声15 min,然后离心10 min(3 000 r/min),取上清待测。色谱条件:色谱柱为Agilent C18,4.6 mm×250 mm;检测器为二极管阵列检测器(SPD-M20A);检测波长为210 nm;流动相为甲醇+0.03 mol/L盐酸+水,甲醇∶0.03 mol/L盐酸∶水=55∶10∶35;柱温为35 ℃;流动相流速为1 mL/min。
1.3.5 工蜂头部10-HDA含量的测定
每群采集9和18日龄工蜂各20只,分离头部,液氮速冻后转入-80 ℃保存,用于10-HDA含量的检测。将待测样本置于2 mL离心管中,加入1 mL甲醇和钢珠,组织破碎仪进行破碎。将匀浆液转移至10 mL容量瓶中,加入内标溶液(0.653 mg/mL对羟基苯甲酸甲酯溶液)1 mL,定容后摇匀,超声15 min,用0.45 μm滤器过滤后待测。色谱条件:色谱柱为Agilent C18,4.6 mm×250 mm;检测器为二极管阵列检测器;检测波长为210 nm;流动相为甲醇+0.2%磷酸溶液,甲醇∶0.2%磷酸溶液=55∶45;流速为1 mL/min;柱温为25 ℃。
1.3.6 工蜂上颚腺中10-HDA合成相关基因表达的检测
每群采集9和18日龄工蜂各20只,分离上颚腺于2 mL EP管中,液氮速冻后转入-80 ℃保存,用于10-HDA合成相关基因表达的检测。采用TRIzol法提取工蜂上颚腺总RNA,核酸检测仪测定RNA浓度。使用反转录试剂盒(Evo M-MLV RT Premix for qPCR,购自湖南艾科瑞生物工程有限公司)将RNA反转录为cDNA。采用试剂盒[SYBR ® Green Premix Pro TaqHS qPCR Kit(Rox Plus),购自湖南艾科瑞生物工程有限公司]进行实时荧光定量PCR。目的基因引物序列设计参考NCBI数据库,以rp49为内参,采用Primer 5.0进行引物设计,委托上海生工生物科技有限公司合成引物,引物序列见表2。

表2 引物序列信息
1.3.7 工蜂头部脂肪酸含量的测定
工蜂头部脂肪酸含量的测定参照GB 5009.168—2016。每组随机选3个群,每群选取18日龄工蜂50只,取头部混合作为1个生物学重复,每个组共3个生物学重复。试样水解、脂肪的提取、脂肪的皂化和脂肪酸甲酯化参照国标中方法。色谱柱:CD-2560(100 m×0.25 mm×0.20 μm);升温程序:130 ℃保持5 min,以4 ℃/min的速率升温至240 ℃,保持30 min。进样口温度:250 ℃;载气流速:0.5 mL/min;分流进样,分流比:10∶1;检测器:火焰离子化检测器(FID);检测器温度:250 ℃。
1.3.8 工蜂血淋巴和中肠中三酰甘油(TAG)含量的测定
每群选取9和18日龄工蜂各100只,采用微量采血毛细管吸取胸部血淋巴至200 μL,采集完立即将样品放入-80 ℃冰箱保存待测。每群另取9和18日龄工蜂各5只,分离中肠,去除内容物,液氮速冻后保存于-80 ℃冰箱待测。采用试剂盒(购自上海酶联生物科技有限公司)测定样本中TAG含量。中肠样本中蛋白质浓度采用考马斯亮蓝试剂盒(购自南京建成生物工程研究所)进行测定。
1.4 数据分析
使用SPSS 21.0软件对数据进行统计分析,采用独立样本t检验(t-test)分析2组数据之间的差异显著性,若P<0.05,则差异显著。数据以平均值±标准差表示。
2 结 果
2.1 外源供给硬脂酸对蜂群采食量的影响
由表3可知,与对照组相比,饲粮中添加2%硬脂酸显著降低了蜂群的总采食量和粉料采食量(P<0.05)。

表3 外源供给硬脂酸对蜂群总采食量和粉料采食量的影响
2.2 外源供给硬脂酸对蜂群群势和封盖子数量的影响
由表4可知,与对照组相比,饲粮中添加2%硬脂酸显著降低了第24天蜂群群势(P<0.05),对其他时间点的蜂群群势没有显著影响(P>0.05);饲粮中添加2%硬脂酸对各时间点的蜂群封盖子数量均没有显著影响(P>0.05)。整个试验期,每个蜂群维持大约有12框成蜂和3框封盖子。
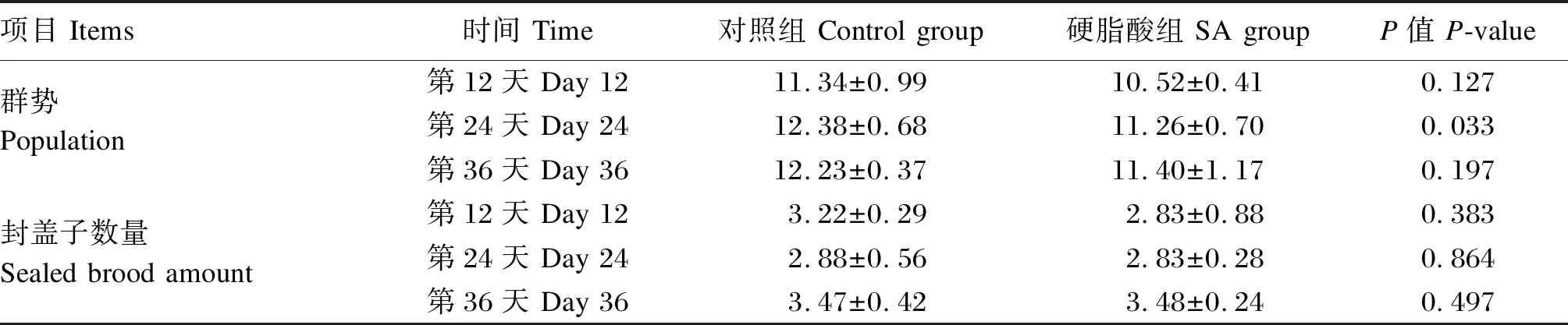
表4 外源添加硬脂酸对意大利蜜蜂蜂群群势和封盖子数量的影响
2.3 外源供给硬脂酸对蜂王浆产量和蜂王浆中10-HDA含量的影响
所有组的蜂王浆样品外观均厚重呈乳状,颜色略带黄色。由表5可知,蜂王浆产量2个组之间没有显著差异(P>0.05);与对照组相比,饲粮中添加2%硬脂酸显著升高了蜂王浆中10-HDA含量(P<0.05),为对照组的1.15倍。

表5 外源供给硬脂酸对蜂王浆产量和蜂王浆中10-HDA含量的影响
2.4 外源供给硬脂酸对工蜂头部10-HDA含量的影响
由表6可知,与对照组相比,饲粮中添加2%硬脂酸显著增加了9和18日龄工蜂头部10-HDA含量(P<0.05),分别为对照组的1.15倍和1.14倍。

表6 外源供给硬脂酸对9和18日龄工蜂头部10-HDA含量的影响
2.5 外源供给硬脂酸对工蜂上颚腺中10-HDA合成相关基因表达的影响
由图1-A可知,与对照组相比,饲粮中添加2%硬脂酸显著增加了9日龄工蜂上颚腺中脂肪酸合成酶(FAS)基因的相对表达量(P<0.05),对载脂蛋白A4(AOPA4)、细胞色素P450 6AS8(CYP6AS8)、酰基辅酶A氧化酶1(ACOX1)、酰基辅酶A氧化酶3(ACOX3)、肉碱棕榈酰转移酶1(CPT1)、电子转移黄素蛋白β肽(ETF-β)和蜂王浆主蛋白1(mrjp1)基因的相对表达量均没有显著影响(P>0.05)。由图1-B可知,与对照组相比,饲粮中添加2%硬脂酸显著增加了18日龄工蜂上颚腺中FAS、CYP6AS8、ACOX1、ACOX3、CPT1、ETF-β和mrjp1基因的相对表达量(P<0.05),对AOPA4基因的相对表达量没有显著影响(P>0.05)。

图1 外源供给硬脂酸对9(A)和18日龄(B)工蜂上颚腺中10-HDA合成相关基因表达的影响
2.6 外源供给硬脂酸对工蜂头部脂肪酸含量的影响
由表7可知,与对照组相比,饲粮中添加2%硬脂酸显著提高了工蜂头部C16∶0、C16∶1和C18∶1n9c的含量(P<0.05),对其他脂肪酸的含量没有显著影响(P>0.05)。
2.7 外源供给硬脂酸对工蜂血淋巴和中肠中TAG含量的影响
由表8可知,与对照组相比,饲粮中添加2%硬脂酸显著降低了9日龄工蜂血淋巴中TAG含量(P<0.05),而显著提高了18日龄工蜂血淋巴中TAG含量(P<0.05);2%硬脂酸的添加对9日龄工蜂中肠中TAG含量有显著提升作用(P<0.05),而对18日龄工蜂中肠中TAG含量没有显著影响(P>0.05)。

表8 外源添加硬脂酸对9和18日龄工蜂血淋巴和中肠中三酰甘油含量的影响
3 讨 论
3.1 外源供给硬脂酸对蜂群群势和封盖子数量的影响
蜜蜂从各种植物中摄取花粉和花蜜,以满足蜂群的动态营养需求。花蜜提供碳水化合物,而花粉提供蛋白质、脂质和许多微量营养素[21]。工蜂成虫在生命的前2周消耗花粉,然后转为采集蜂,以花蜜为主食。与花蜜相比,花粉中含有对成年工蜂发育和健康必不可少的营养物质。工蜂摄取花粉会激活分泌腺咽下腺和上颚腺以及脂肪体的发育。腺体和脂肪体良好发育能够为幼虫和蜂王提供充足的分泌物,这种活动被称为“哺育”。蜂群营养不足时会影响工蜂对幼虫的哺育[22-23]。研究表明,花粉不足时,导致哺育蜂频繁乞食,对幼虫的哺育行为减少,甚至吞食卵和幼虫[24]。另有研究表明,蜂群营养不足时,会导致蜜蜂头部腺体发育受到抑制,增加哺育蜂残食幼虫行为,最终导致封盖子数量下降[25]。封盖子数量通常被用作衡量孵育成功率的指标。已有诸多研究报道饲粮脂质水平对封盖子数量有积极影响。Herbert等[26]研究指出,当喂食脱脂的花粉替代品时,蜂群不能正常孵育幼虫;此外,饲喂含有2%~4%脂质饲粮时蜂群封盖子数量略大于饲喂含6%~8%脂质饲粮时。相似的,有研究发现,当对照组饲粮中脂质含量忽略不计时,饲喂脂质含量为8%的饲粮增加了蜂群封盖子数量[27]。在本研究中,饲粮中添加2%硬脂酸对蜂群封盖子数量无显著影响。这可能是因为基础饲粮中的脂质足以满足哺育蜂头部腺体发育的需要,所以额外添加脂质并没有显示出积极的效果。前人研究指出,饲喂不同种类的蜂花粉可影响蜂群群势,茶花粉和油菜花粉优于荷花粉和玉米花粉[28]。此外,饲粮中维生素(维生素A)含量[29]、脂肪酸(α-亚麻酸)水平[30]以及蛋白质水平[31]均能影响成蜂的群势。上述研究结果说明饲粮结构会影响蜂群发育,可能是因为饲粮中营养结构的改变提高了工蜂的哺育能力,蜂王获得更为全面且丰富的营养,刺激其产卵能力,最终导致群势增强。本研究发现,添加2%硬脂酸并没有对蜂群群势产生显著影响,原因可能与添加剂量有关。
3.2 外源供给硬脂酸对蜂王浆中10-HDA含量的影响
目前,有关饲粮结构及营养水平对蜂王浆中10-HDA含量的影响已开展了广泛研究,有关不同蛋白质水平、不同种类花粉对其影响的研究诸多,而关于脂肪酸对蜂王浆中10-HDA含量影响的研究较少。刘丽等[32]分析比较了饲粮添加不同剂量硬脂酸(1%、5%、10%)或癸酸(1%、2.5%和5%)对工蜂10-HDA合成的影响,发现添加5%硬脂酸或1%癸酸显著提高了工蜂头部10-HDA含量,并且使10-HDA的分泌高峰提前。本团队前期的研究发现,饲粮中添加不同比例(2%、4%、6%和8%)油酸时,添加8%油酸能够显著提高蜂王浆中10-HDA含量[33]。前人研究指出,饲粮蛋白质水平对蜂王浆中10-HDA含量无显著影响[34],该研究结果与王改英[35]的研究结果相一致,说明蜂王浆中10-HDA的含量不受饲粮中蛋白质水平的影响。有关不同来源花粉对蜂王浆中10-HDA含量的影响,有研究发现饲喂不同来源的花粉时蜂王浆中10-HDA含量不同,苦灌木和咖啡花粉优于茶花粉;但也有研究发现不同来源的花粉对蜂王浆中10-HDA含量无显著影响。荀利杰等[36]的研究表明,与自然采粉的蜂群相比,供给油菜和土连翘花粉并没有影响蜂王浆中10-HDA的含量。不同研究所得结果不一致的原因可能与花粉中营养物质组成不同相关。在本研究中,饲粮中添加2%硬脂酸显著提高了蜂王浆中10-HDA含量;此外,9和18日龄工蜂头部10-HDA含量可见显著升高,说明外源供给硬脂酸促进了哺育蜂和采集蜂上颚腺对10-HDA的分泌。
3.3 外源供给硬脂酸对工蜂上颚腺中10-HDA生物合成的影响
FAS是一种多功能酶,负责以乙酰辅酶A为底物从头合成脂肪酸[37-38]。研究发现,FAS在哺育蜂中高表达[39-40]。脂肪酸转运是上颚腺终产物分泌的关键过程[41]。APO A4是昆虫体内重要的脂质转运蛋白[42]。ETF-β是几种线粒体脱氢酶(如中链酰基辅酶A脱氢酶和长链酰基辅酶A脱氢酶)的特定电子受体,负责催化脂肪酸β-氧化[43]。Yang等[43]研究发现,沉默ETF-β基因导致工蜂上颚腺对10-HDA的分泌减少。在蜜蜂中,10-HDA是由硬脂酸ω位羟基化产生的[18],该过程由P450酶催化进行[19]。Fujita等[44]和Wu等[45]的研究已充分证明了CYP6AS8在工蜂10-HDA生物合成的羟基化过程中的重要作用。Mumoki等[46]报道,年龄较大的蜜蜂工蜂CYP6AS8转录本的丰度更高,这可能与上颚腺分泌大量10-HDA有关。在工蜂上颚腺中,β-氧化发生在线粒体和过氧化物酶体[42]。在线粒体系统中,β-氧化的第1步是肉碱棕榈酰转移酶(CPT)对酰基辅酶A的摄取,限制着脂肪酸从细胞质进入线粒体内膜的速度[47]。在过氧化物酶体系统中,酰基辅酶A氧化酶(ACOX)催化β-氧化起始步骤,是该过程的限速酶[48]。本研究中,2%硬脂酸的添加促进了18日龄工蜂上颚腺中上述基因的表达,表明饲粮中添加硬脂酸促进了上颚腺对10-HDA的分泌。TAG是昆虫体内脂质的主要形式,能够在非进食阶段和长途飞行期间供应能量[49],此外,TAG还为其他物质的合成提供前体,如化学信息素[50]。TAG作为重要的中性脂质,包含1个甘油骨架和3个脂肪酸链[51]。TAG水解产生的脂肪酸可作为工蜂上颚腺合成10-HDA的底物。本研究结果显示,饲粮中添加2%硬脂酸显著提高了9、18日龄工蜂中肠和18日龄工蜂血淋巴中TAG的含量,说明硬脂酸为10-HDA的合成提供了底物。
4 结 论
外源供给硬脂酸可提高工蜂上颚腺中10-HDA合成相关基因的表达,促进10-HDA分泌,进而增加蜂王浆中10-HDA的含量。
