小麦4 个WAKs/WAKLs 基因的分子特征及其响应条锈菌侵染的表达*
2024-04-01孔一淅王蕙羽棠刘星辰杨宝菊
孔一淅,乔 梁,王蕙羽棠,刘星辰,杨宝菊
(云南农业大学 农学与生物技术学院,云南 昆明 650201)
类受体激酶(receptor-like kinase,RLK)是植物受体最主要的组成成分,在细胞间的跨膜转导信号中起重要作用,控制植物的繁殖、生长、发育及对各种环境的适应[1]。RLK 家族一般包含胞外结构域(extracellular domain,ED)、跨膜区(transmembrane region,TM)和胞内激酶结构域(Ser/Thr kinase domain,STK)[2]。在植物病原菌互作的信号转导通路中,RLK 作为模式识别受体 (pattern-recognition receptors,PRRs)可以识别病原菌分子模式 (pathogen-associated molecular patterns,PAMPs),从而在细胞膜上响应植物的天然免疫系统(pattern-triggered immunity,PTI),激活植物的抗病能力[3-5]。当外界信号PAMPs 分子被受体类激酶的ED 识别后,通过STK 将信号传导给下游的信号通路,引发一系列免疫反应,包括ROS爆发、MAPK 激活、胼胝质沉淀、钙离子流入、水杨酸积累等[3-5]。如油菜素内酯信号转导通路中,共受体BAK1 和受体FLS2 共同识别病原菌的鞭毛蛋白,BRI1 受体类激酶和BAK1 相互作用并经交互磷酸化形成1 个活跃的受体复合物,从而激活油菜素内酯抵御病原菌。越来越多的RLKs 已被证明是PRRs[3-5]。
细胞壁受体激酶(wall-associated kinases,WAK)及其类基因WAKLs(WAK like genes,WAKLs)属于RLK 家族的亚家族[6],合称为WAK/WAKL 家族。WAKs和WAKLs的结构非常相似,主要是胞外表皮生长因子结构域(epidermal growth factor domain,EGF)、跨膜结构域和胞内STK,但部分WAKLs缺少一些结构域,如WAKL7缺少跨膜域和激酶结构域[7]。在植物防御反应中,拥有胞外结构域的WAKs/WAKLs基因可以作为细胞外界信号接收员,而胞内激酶部位参与胞质信号级联反应[7],并且在生长发育和对非生物压力的耐受性中起作用。WAKs/WAKLs基因在植物防御病原体方面发挥着关键作用,如:AtWAK1编码WAKs 蛋白,与病原菌互作,在拟南芥的防御反应中起重要作用[8];从玉米(Zea maysL.)中克隆的主效数量性状基因ZmWAK可抗玉米丝黑穗病[9];在棉花(Gossypium hirsutumL.)中鉴定到的GhWAK7A参与调节对镰刀菌和黄萎病的反应[10];在山新杨(Populus davidiana×P.bolleana)中过表达克隆到PdPapWAK基因后,其抵抗非生物和生物胁迫的能力进一步增强[11]。
植物WAK/WAKL家族是响应病原菌信号的重要成员。长久以来,基因对基因假说提供了植物抗病模式PTI 与ETI 系统、植物PRRs 与抗病基因(resistance gene,R)的明确界限,但这一界限面临着大量研究的挑战。WAK/WAKL家族作为信号转导途径中的重要受体,可以激活植物的PTI 免疫反应模式,检测到病原菌的效应蛋白,可能原因之一是其在植物R基因与病原菌无毒基因互作过程中发挥“监测”作用[12-13]。在小麦对禾谷丝核菌的防御反应中,鉴定到WAK7的转录丰度升高[14],积极响应了小麦禾谷丝核菌的防御反应。小麦基因组中定位到1 个WAKL4/stb6基因,该基因识别病原菌效应物Avr Stb6,且绕过过敏性反应赋予小麦对枯叶病的抗性,符合基因对基因假说[15]。当过表达OsWAK91时,水稻激活ETI系统,产生H2O2反应并增强相关R基因的表达[16]。SlWAK1通过番茄中的FLS2/FLS3 复合物参与调节PRRs 介导的免疫应答[17]。总之,WAK/WAKL家族在PTI 和ETI 系统中的调控机制很复杂,具体情况尚不清楚。
本研究从课题组前期测定的小麦响应条锈病侵染的转录组数据中筛选出4 个在抗感材料中差异表达的WAKs/WAKLs基因,对其进行基因结构、蛋白基本理化性质、保守结构域、系统进化等生物信息学分析,结合实时荧光定量 PCR (RTqPCR)在抗病和感病材料中分析其响应条锈菌的表达模式,为进一步研究小麦WAKs/WAKLs基因响应条锈菌的侵染作用机制及功能提供参考。
1 材料与方法
1.1 试验材料
供试小麦品种为抗条锈病品种云337 和感条锈病品种云402;小麦条锈菌(Puccinia striiformisf.sp.tritici)为CYR32。将小麦播种在人工培养室中,温度控制在昼16~18 ℃、夜12~15 ℃,每天光照16 h;当小麦生长到二叶期时,将CYR-32 与滑石粉按体积比1∶20 混合后进行撒粉接种;分别采集条锈菌侵染后0、24、48、72、120和168 h 的叶片样本,于-80 ℃保存备用。
1.2 转录组测序及差异基因表达分析
转录组测序由北京百迈客生物科技有限公司完成。文库质检合格的测序数据采用DESeq2 进行差异基因分析,以差异倍数(fold change,FC)≥1.5 且错误发现率(false discovery rate,FDR)<0.01作为差异基因筛选标准,从中挖掘在抗感材料中差异表达的小麦WAKs/WAKLs基因,并对其进行COG 分类、GO 功能富集、KEGG 注释和KEGG 通路富集分析。
1.3 小麦WAK/WAKL 家族基因鉴定
下载拟南芥、水稻、大麦和小麦基因组数据库文件,采用TBtools v1.108 从中比对出差异表达的小麦WAKs/WAKLs基因的同源基因组和氨基酸序列,并筛选同源性较高的基因;利用NCBI 的Batch CD-Search 在线软件(https//www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对筛选得到的候选基因编码蛋白进行蛋白结构域分析。
1.4 小麦WAK/WAKL 家族成员生物信息学分析
利用GSDS 在线软件(http//gsds.cbi.pku.edu.cn/)分析和绘制小麦WAKs/WAKLs基因结构;利用ExPASyProtParam Tool (http//web.expasy.org/protparam)预测蛋白质的等电点和分子质量;利用ExPASy (http//web.expasy.org/protscale)预测蛋白质的亲水性和疏水性;利用MEME 在线软件(https://meme-suite.org/meme/tools/meme)预测蛋白基序。为了研究小麦WAKs/WAKLs 蛋白与其他物种间的系统进化关系,对小麦、大麦、拟南芥和水稻4 个物种中同源性较高的WAKs/WAKLs 蛋白全长序列进行比对,采用DNAMAN V6 比对蛋白质多序列,采用MEGA 7.0 的邻接法构建系统进化树,采用 TBtools 绘制系统进化树与基序预测图。
1.5 小麦WAKs/WAKLs 基因的表达模式分析
根据从转录组筛选出的小麦WAKs/WAKLs基因序列,使用Beacon Designer 8 设计RT-qPCR 引物序列(表1),引物由北京擎科生物股份有限公司合成。采用RNA Easy Fast 植物组织 RNA 快速提取试剂盒(天根生化科技有限公司)提取小麦叶片的总RNA,再采用Aid lab 公司反转录试剂盒(TURE script 1st Stand cDNA SYNTHESIS Kit)进行反转录。以小麦GAPDH基因为内参,使用2×SYBR®Green 预混液(中国DF)试剂盒在Analytikjena-qTOWER2.2 型荧光定量PCR 仪(德国)上进行RT-qPCR 反应。反应体系总体积10.0 μL,包括cDNA 模板1.0 μL,SYBR Green 1 Master 5.0 μL,上、下游引物各 0.5 μL,ddH2O 3.0 μL。反应程序为:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,39 个循环,溶解曲线(60~95 ℃,每个循环增加1 ℃,每次循环时间为4 s)设置2 个生物学重复,并使用2-ΔΔCt[18]计算各个样品及各组中的基因相对表达量。采用Excel 2010 处理数据;采用GraphPad Prism 8.4.2 作图。

表1 供试引物Tab.1 Primers for test
2 结果与分析
2.1 4 个WAKs/WAKLs 基因的结构
经转录组筛选出4 个小麦WAKs/WAKLs基因,分别为TraesCS1B02G004100、TraesCS6B02-G459100、TraesCSU02G079300和TraesCS3A02G-122300基因(图1)。其中,基因组序列最长的是TraesCS6B02G459100,长度为5 117 kb,包含4个外显子和3 个内含子;序列最短的是TraesCS3-A02G122300,长度为2 934 kb,包含3 个外显子和2 个内含子;TraesCSU02G079300和TraesCS1B-02G004100 的长度相近,分别为3 208 和3 194 bp,均包含3 个外显子和2 个内含子。

图1 4 个小麦WAKs/WAKLs 基因的结构Fig.1 Gene structure of four wheat WAKs/WAKLs genes
2.2 WAKs/WAKLs 蛋白的理化性质和亚细胞定位
由表2 可知:TraesCS1B02G004100、Traes-CS6B02G459100、TraesCSU02G079300和Traes-CS3A02G122300编码的氨基酸序列长度分别为714、960、737 和652 aa;蛋白分子质量分别为78.68、106.29、81.86 和69.67 ku;理论等电点分别为8.50、5.98、5.65 和6.25;脂肪族氨基酸指数分别为89.59、85.33、81.38 和90.49;4 个基因的蛋白亲疏水性值均为负值,为亲水性蛋白。亚细胞定位预测显示:4 个基因均定位于细胞膜上,为膜蛋白。

表2 4 个WAKs/WAKLs 基因理化性质Tab.2 Physicochemical properties of four WAKs/WAKLs genes
2.3 WAKs/WAKLs 的系统进化以及基序和功能结构域
小麦、大麦、拟南芥和水稻中同源性较高的43 个WAKs/WAKLs 蛋白质序列按照亲缘关系被分为4 个分支,TraesCS6B02G459100和来自水稻、大麦、拟南芥的成员聚为一类,处于分支Ⅰ,且与水稻Os05g04460亲缘关系最近;TraesCSU-02G079300和TraesCS3A02G122300处于分支Ⅱ,分别与水稻Os02g02120、拟南芥AtWAKL15亲缘关系最近;TraesCS1B02G004100处于分支Ⅲ,与大麦HORVU.MOREX.r3.5HG0503880亲缘关系最近;分支Ⅳ仅包括小麦成员(图2a)。

图2 小麦与拟南芥、水稻、大麦 WAK/WAKLs 基因中保守蛋白质的系统进化关系(a)、蛋白结构域(b)和基序结构(c)Fig.2 Phylogenetic relationship (a),protein domain(b) and motifs structure (c) based on the amino acid sequences of WAKs/WAKLs from Triticum aestivum and Arabidopsis thaliana,Oryza sativa,and Hordeum vulgare
蛋白结构域预测结果显示:小麦、大麦、拟南芥和水稻WAKs/WAKLs 蛋白序列均包括激酶部位(图2b)。在进化分支Ⅰ中,小麦WAKs/WAKLs 蛋白都包括2 个GUB_WAK_bind 结构域,1个EGF 和1 个STK,除水稻Os01g26300和拟南芥AtWAKL16编码的蛋白质不具有胞外结构域外,其他成员均具有胞外结构域。在进化分支Ⅱ中,大部分水稻成员不具备胞外结构域,而其他成员均具备;部分小麦成员还具有跨膜TM_FGFR-like 结构域。在进化分支Ⅲ中,除小麦TraesCS1B02G004100 和大麦HORVU.MOREX.r2.1-HG0004690、HORVU.MOREX.r3.5HG0503880编码的蛋白质具有完整的胞内和胞外结构域外,其他成员均不具备。在进化分支Ⅳ中,只有Traes-CS3A02G049500编码的蛋白质具有胞外和胞内结构域。说明胞内STK 为所有成员共有,预测WAKs/WAKLs家族基因发挥功能与激酶部位有较大关联。
基序预测结果显示:小麦、大麦、拟南芥和水稻的WAKs/WAKLs 蛋白序列共包括12 种基序(图2c)。进化分支Ⅰ包括11 种基序,TraesCS-6B02G459100与大麦HORVU.MOREX.r3.3HG04-99530编码的蛋白质基序相似;进化分支Ⅱ包括10 种基序,TraesCSU02G079300与水稻Os02g0-2120、大麦HORVU.MOREX.r3.7HG0649430编码的蛋白基序高度相似,TraesCS3A02G122300与拟南芥AtWAKL15编码的蛋白基序高度相似;进化分支Ⅲ包括10 种基序,TraesCS1B02G004100与大麦HORVU.MOREX.r3.5HG0503880编码的蛋白基序高度相似;进化分支Ⅳ包括9 种基序,均是来自小麦WAKs/WAKLs 家族的成员,且编码的蛋白基序基本相似。此外,基序1、2、3、4、5、7、8、11 为所有成员共有,均包括STK,预测胞内激酶部位保守性较高,是决定蛋白质功能的关键基序;基序9、10、12 包括胞外EGF 和半乳糖醛酸结合结构域(galacturonic acid binding domain,GUB),说明胞外结构域多样,但具有一定的保守性。
2.4 WAKs/WAKLs 蛋白激酶部位的同源性比对
为了进一步研究激酶部位的保守性,预测其发挥功能的部位,对涉及的成员进行激酶部位蛋白序列同源性比对分析。该部位通常有2 个与激酶发挥功能有关的重要区域,包括蛋白激酶ATP结合位点、丝氨酸/苏氨酸蛋白激酶活性位点和酪氨酸蛋白激酶活性位点(图3),分析结果显示:胞内结构域同源性达73.34%,蛋白激酶ATP 结合位点、丝氨酸/苏氨酸蛋白激酶活性位点和酪氨酸蛋白激酶活性位点保守性强,均符合这2 个结合位点序列构成特征。根据蛋白激酶ATP 结合位点中不变的天冬氨酸(D)附近是否存在保守精氨酸(R),将激酶分为RD 型激酶和非RD 型激酶,由图4 可知:TraesCS6B02G459100和TraesCS3A-02G122300为RD 型激酶,TraesCS1B02G004100和TraesCSU02G079300为非RD 型激酶。

图3 WAKs/WAKLs 蛋白激酶催化域中的保守结构域基序Fig.3 Conserved domain motifs in the catalytic domain of WAKs/WAKLs protein kinases

图4 小麦与拟南芥、水稻、大麦 WAK/WAKLs 基因氨基酸多序列同源比对Fig.4 Homology alignment of amino acid sequences of WAKs/WAKLs genes in T.aestivum and A.thaliana,O.sativa,and H.vulgare
2.5 小麦 WAKs/WAKLs 基因响应条锈病的表达
由图5 可知:4 个基因在小麦接种条锈菌亲和互作和非亲和互作过程中差异表达。侵染0 h,TraesCS1B02G004100和TraesCS6B02G459100在小麦与条锈菌非亲和互作中被短暂诱导表达后下调,随后在侵染早期(24~48 h)上调表达,而TraesCS3A02G122300则表达相反;TraesCSU02G-079300在早期表达量无显著差异。接种48 h 后,TraesCS1B02G004100和TraesCSU02G079300表达受到抑制而下调直至接种168 h;TraesCS6B02-G459100表达则呈上调直至接种120 h。综上所述,亲和互作过程中,TraesCS1B02G004100和TraesCS6B02G459100几乎不表达,TraesCS3A0-2G122300早期表达趋势和非亲和互作一致,TraesCSU02G079300在早期表达量低于非亲和互作。
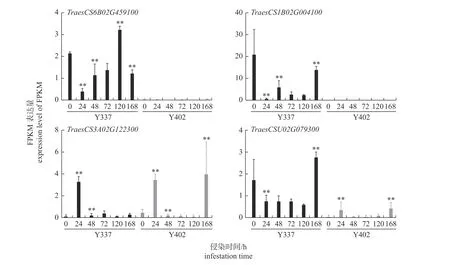
图5 4 个WAKs/WAKLs 基因在抗病品种云337 (Y337)和感病品种云402 (Y402)接种CYR32 后的转录组表达量Fig.5 Transcriptome expression level of four WAKs/WAKLs genes in resistant variety Yun337 (Y337) and susceptible variety Yun402 (Y402) post inoculation with CYR32
由图6 可知:非亲和互作过中,在条锈菌侵染小麦的24~48 h,TraesCS1B02G004100上调表达,TraesCS6B02G459100显著上调表达,Traes-CS3A02G122300和TraesCSU02G079300表达受到抑制而下调;在接种条锈菌48 h 后,TraesCS1-B02G004100和TraesCS6B02G459100先下调后上调表达;TraesCS6B02G459100、TraesCS3A02G-122300和TraesCSU02G079300的表达量分别在接种条锈菌120、24 和168 h 后达到峰值。亲和互作过程中,TraesCS1B02G004100几乎不表达;转录组中几乎未表达的TraesCS6B02G459100,在接种0~24 h 被抑制表达,24 h 后上调表达,168 h 表达量达到峰值,但由于该基因转录丰度较低,可能导致RT-qPCR 检测结果不能有效地反映其实际表达情况;TraesCS3A02G122300和TraesCSU02G079300在接种早期下调表达,接种120 h 后表达上调。综上所述,4 个基因在小麦和条锈菌互作过程中利用转录组和RT-qPCR 分析的表达模式基本一致。
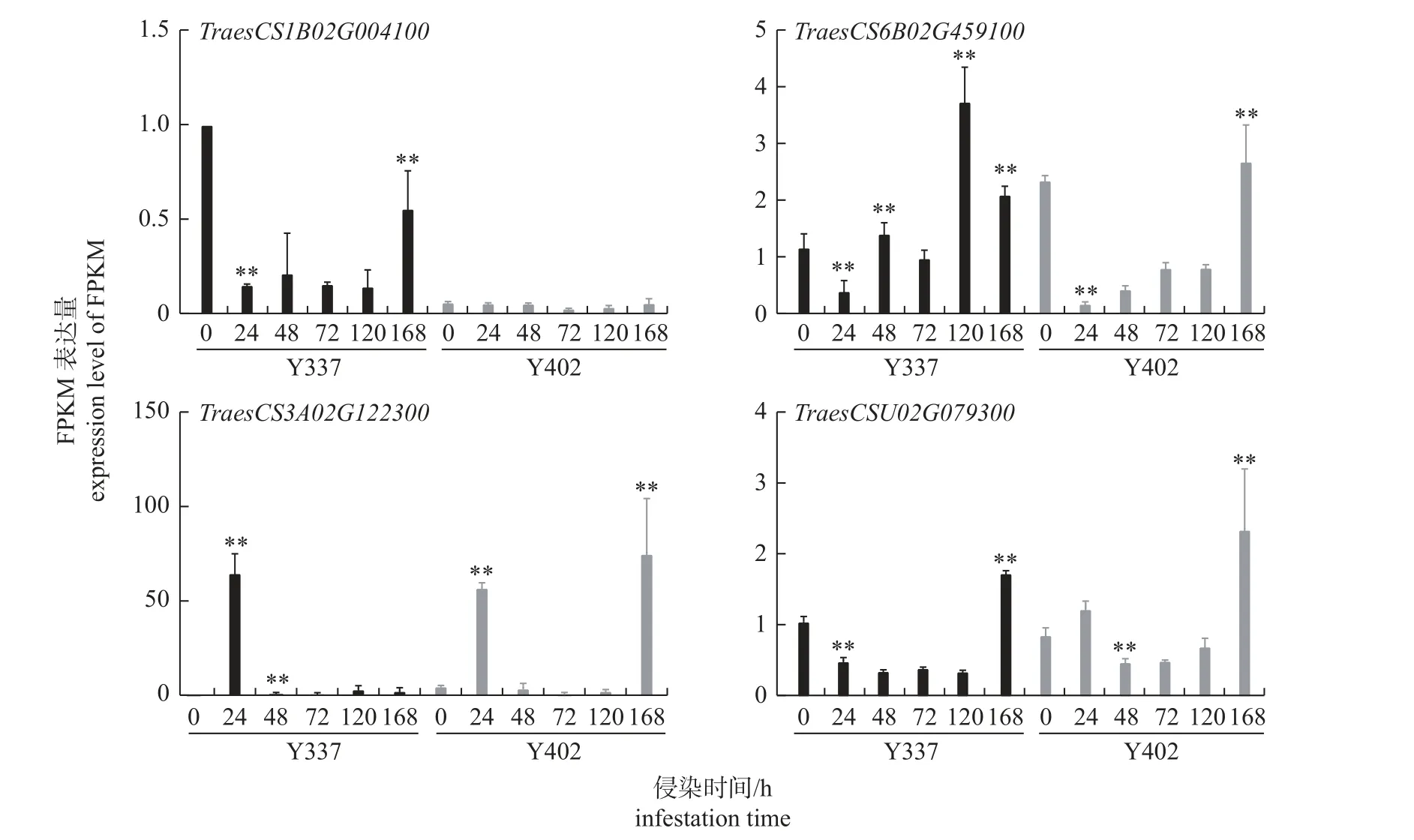
图6 RT-qPCR 验证4 个WAK/WAKLs 基因在抗病品种云337 (Y337)和感病品种云402 (Y402)接种CYR32 后的表达模式Fig.6 Expression patterns of four WAKs/WAKLs in resistant variety Yun337 (Y337) and susceptible variety Yun402 (Y402) post inoculation with CYR32 by RT-qPCR
3 讨论
WAKs/WAKLs基因在植物中属于大家族,目前从拟南芥中鉴定了26 个WAKs/WAKLs基因,水稻中125 个,大麦中91 个,小麦中320 个[19-21],作为病原菌的模式识别受体,它在植物信号转导过程中发挥着重要作用。本课题组从转录组中筛选的4 个WAKs/WAKLs基因,其结构域存在一定差异,暗示这4 个基因功能上存在差异;通过RTqPCR 验证,阐明TraesCS1B02G004100基因参与调控小麦对条锈病的抗性,研究结果为揭示WAKs/WAKLs基因调控抗病性的功能和机制提供了参考。
本研究的4 个WAKs/WAKLs基因具有典型的胞外富含半胱氨酸的GUB_WAK_bind 和胞内丝氨酸/苏氨酸激酶结构域。从进化分支上看,小麦TraesCS6B02G459100与水稻OsWAK91的亲缘关系最近,OsWAK91正向调控水稻抵御稻瘟病菌侵染[16]。已有研究报道:2 个胞外结构域变异的OsWAK10基因以不同的亲和力结合果胶寡糖,以控制水稻次生壁的合成[22],由此可以说明:GUB 作为首先感知到外界信号的受体,可以与果胶结合激活WAKs/WAKLs基因,以调节植物细胞形态。TraesCS6B02G459100与上述2 个水稻WAKs基因同为RD 激酶,由此可以推测,该基因可能编码与调节植物生长发育、抗病相关的激酶,相较于其他3 个基因,其具有的2 个GUB结构域在信号转导过程中的作用机制值得探索。TraesCS3A02G122300与未知功能的激酶聚为同一分支,在抗感材料中都被抑制表达,但在后期感病材料的表达量高于抗病材料,尽管属于RD激酶,但已有报道中也出现能够调控植物抗病反应的RD 激酶,如OsWAK91、OsWAK92、OsWAK94和OsWAK14基因是水稻对稻瘟病菌数量抗性的调节因子[16],因此TraesCS3A02G122300的具体功能机制值得进一步研究。
WAK/WAKL 家族胞内的ATP 结合位点及丝氨酸/苏氨酸结合位点是调节植物先天免疫的重要结构[23],尤其是丝氨酸/苏氨酸蛋白激酶活性位点中保守的天冬氨酸附近是否存在精氨酸很大程度上决定了激酶的功能。已知在先天免疫中作为PRRs 的15 个激酶中有12 个是非RD 型[24],表明所有非RD 激酶可能都参与先天免疫。TraesCS1B-02G004100和TraesCSU02G079300为非RD 型激酶。其中,TraesCS1B02G004100在亲和互作体系中几乎不表达;而在非亲和体系中,该基因早期被诱导,24 h 以后被抑制,这与已报道的OsWAK112d基因表达模式一致,且过表达OsWAK-112d基因及其突变体分别增加了水稻的易感性和抗性,表明其在植物感染期间是抑制基础抗性的负调控因子[16],故推测TraesCS1B02G004100可能是小麦响应条锈菌侵染的负调控基因,并且早期可能被PAMPs 诱导。TraesCSU02G079300与OsWAK11处于同一进化分支,OsWAK11通过GUB 结合果胶并监测果胶甲基化的变化以解毒过量的铜,并且可以调节细胞的伸长率以适应外界环境的变化[25],其转录丰度的趋势与TraesCS1B0-2G004100相似,并且在2 种互作体系中差异表达,该基因可能也在防御反应中发挥作用。
本研究筛选的小麦WAK1基因TraesCS1B0-2G004100和已经在小麦中鉴定到的Snn1基因同源性最高,达99.86%。在腐生病原菌(Parastagonospora nodorum)和小麦互作过程中,SnTox1 作为病原菌分泌的效应蛋白与Snn1基因相互作用,引起小麦细胞程序性死亡并赋予其对叶斑病的易感性,Snn1-SnTox1是小麦和叶斑病互作的多个重要模式之一[26-27]。本研究发现:在小麦与条锈菌非亲和互作过程中,TraesCS1B02G004100基因响应条锈菌侵染且表达受到抑制,而在亲和互作过程中不受条锈菌诱导表达,说明该基因极大可能参与调控小麦对条锈病的抗性。
4 结论
4 个小麦WAKs/WAKLs基因中,TraesCS3A0-2G122300和TraesCSU02G079300在小麦与条锈菌亲和及非亲和互作体系中差异表达;TraesCS6-B02G459100和TraesCS1B02G004100在小麦非亲和互作中特异表达。非RD 型激酶TraesCS1B02-G004100在表达过程中受到抑制,作为病原菌效应蛋白的受体,其在参与调控小麦对条锈病的抗性功能值得进一步研究;其他3 个WAKs/WAKLs基因在植物生长发育过程中的作用也值得探索。
