豆蔻明对肺纤维化的治疗作用及机制
2024-04-01张娟党连生
张娟 党连生

[摘要] 目的 观察豆蔻明(Cardamonin,CDN)对肺纤维化小鼠的作用,并探究其对转化生长因子-β1(transforming growth factor-β1,TGF-β1)/smad信号通路的影响。方法 将小鼠随机分为生理盐水(Sham)组、博莱霉素(Bleomycin,BLM)组、豆蔻明低剂量(low dose of Cardamonin,CDN-L)组、豆蔻明中剂量(medium dose of Cardamonin,CDN-M)组、豆蔻明高剂量(high dose of Cardamonin,CDN-H)组、地塞米松(dexamethasone,DXM)组;单次气管注射BLM诱导肺纤维化,计算肺指数;酶联免疫吸附法测血清肿瘤坏死因子(tumor necrosis factor-α,TNF-α)水平;试剂盒测肺组织羟脯氨酸(hydroxyproline,HYP)含量,苏木精-伊红、马松染色观察肺炎症程度及纤维化情况,RT-PCR法检测肺组织TGF-β1/smad信号通路相关基因表达情况。结果 与Sham组相比,BLM组小鼠肺指数、Szapiel评分、Ashcroft 评分明显升高(P<0.05),肺部炎症程度和纤维化程度严重。血清中TNF-α含量升高(P<0.05)、肺组织HYP水平升高(P<0.05),TGF-β1[(1.02±0.21)vs.(3.25± 0.14)]、smad2[(1.00±0.05)vs.(1.63±0.09)]、smad3[(1.00±0.06)vs.(1.82±0.07)]、α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)[(1.00±0.10)vs.(2.15±0.10)]mRNA表达升高(P<0.05),上皮-钙黏蛋白(E-Cadherin)[(1.01±0.16)vs.(0.57±0.09)]mRNA水平降低(P<0.05)。CDN-M、CDN-H干预可减低小鼠肺指数,减轻炎性和肺纤维化,降低TNF-α、HYP水平(P<0.05),同时下调肺纤维小鼠肺组织中TGF-β1、smad2、smad3、α-SMA 表达,上调E-Cadherin表达。CDN-L无明显治疗效果,CDN-H治疗作用与DXM相似。结论 CDN可能通过TGF-β1/Smad通路介导上皮-间充质转化而发挥抗纤维化作用。
[关键词] 豆蔻明;肺纤维化;TGF-β1/smad信号通路;上皮间质转化
[中图分类号] R 285.5 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.08.019
Therapeutic effect and mechanism of Cardamonin on pulmonary fibrosis
ZHANG Juan1, DANG Liansheng2
1.Department of Geriatrics, the First Affiliated Hospital of Baotou Medical College, Baotou 014010, Inner Mongolia, China; 2.Department of Geriatrics, the First Affiliated Hospital of Baotou Medical College, Baotou 014010, Inner Mongolia, China
[Abstract] Objective To observe the effect of Cardamonin (CDN) on pulmonary fibrosis in mice, and explore the effect of CDN on transforming growth factor-β1 (TGF-β1)/Smad signaling pathway. Methods The mice were grouped into: Sham group, Bleomycin(BLM) group, low dose of Cardamonin (CDN-L) group, medium dose of Cardamonin (CDN-M) group, high dose of Cardamonin (CDN-H) group and Dexamethasone (DXM) group. Injectioning of BLM induce pulmonary fibrosis in mice, the lung index was measured. Enzyme-linked immunosorbent assay kit measured serum tumor necrosis factor-α (TNF-α) levels, the hydroxyproline (HYP) content in lung tissue was detectioned by kits. Pathological changes were observed by Htoxylin Eosin and Masson staining, and the level of genes related to TGF-β1/smad signaling pathway was detected by RT-PCR. Results Compared with the Sham group, the lung index, Szapiel score and Ashcroft score of the BLM group were significantly increased (P<0.05), and the degree of pulmonary inflammation and fibrosis was more severe. The levels of TNF-α in serum and HYP in lung tissue were increased (P<0.05), lung tissue TGF-β1[(1.02±0.21)vs.(3.25±0.14)],smad2[(1.00±0.05)vs.(1.59±0.20)],smad3 [(1.00±0.06)vs.(1.59±0.20)], α-smooth muscle actin (α-SMA)[(1.00±0.10)vs.(2.15±0.10) and E-Cadherin [(1.01±0.16) vs.(0.57± 0.09)] mRNA level decreased (P<0.05). The intervention of CDN-M and CDN-H could decrease the lung index, alleviate the inflammation and Pulmonary fibrosis, and decrease the levels of TNF-α and HYP (P<0.05). The expression of TGF-β1, smad2, smad3 and α-SMA in lung tissue of mice with pulmonary fibrosis was down-regulate. CDN-L had no significant effect, while CDN-H had similar effects to DXM. Conclusion Cardamonin may play an anti-fibrotic role by mediating epithelial-mesenchymal transition through the TGF-β1 /Smad pathway.
[Key words] Cardamonin; Pulmonary fibrosis; TGF-β1/Smad; Epithelial-mesenchy mal transition
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种慢性进展并最终致命的疾病,其特征是肺间质纤维化,引起肺结构破坏,最终导致进行性呼吸困难、气体交换障碍和死亡。IPF男性发病率稍高,诊断的平均年龄为65~70岁,患病率随着年龄的增长而急剧上升,诊断后平均生存期3~6年,病死率为17.8%[1-2]。目前尚无能够治愈IPF的药物,吡非尼酮和尼达尼布可改善轻、中度IPF患者的肺功能,但不能改善生存率或生活质量,肺移植是治疗终末期IPF患者的主要手段,但因其缺乏供体及术后排斥反应,而被限制其的临床应用。因此,急需为肺纤维化治疗提供新方案。肺纤维化典型特征是转化生长因子-β(transforming growth factor-β1,TGF-β1)信号上调,Smad介导的TGF-β信号途径在IPF过程中有着诱导上皮-间质转化(epithelial-to-mesenchymal transition,EMT)的作用。通过抑制TGF-β1/Smad信号通路介导的EMT可有效改善肺纤维化[4-5]。豆蔻明(Cardamonin,CDN)是一种天然黄酮化合物。研究表明,CDN对急性肺损伤具有保护作用,可以降低小鼠肺组织羟脯氨酸(hydroxyproline,HYP)水平[6]。此外,在动物水平,还可以通过TGF-β/Smad信号通路抑制α-平滑肌蛋白(α-smooth muscle actin,α-SMA)表达,促进上皮-钙黏蛋白(E-Cadherin)的表达来抑制肾间质纤维化,但目前关于CDN肺纤维化的作用及其机制所知甚少[7]。
综上所述,本研究通过观察CDN对小鼠肺纤维化的具体作用,探讨TGF-β1/Smads信号通路在肺纤维化的作用机制。
1 材料与方法
1.1 实验动物
48只清洁级10周龄C57BL/6小鼠,雄性,体质量24~28 g,购于中国食品药品检定研究院,精神及活动正常。动物实验包头医学院第一附属医院动物伦理委员会批准(伦审字2023007号)。动物实验生产许可证号:SCXK(京)2022-0002。
1.2 试剂与药物
硫酸博来霉素(批号:F2221238,上海晶纯生化科技股份有限公司,规格5mg);醋酸地塞米松片(国药标准字H41021038,遂成药业股份有限公司,规格0.75mg);CDN(批号:21101510,四川维克奇生物科技有限公司,规格200mg);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α);酶联免疫试剂盒(批号:MM-0132M1,江苏酶免实业有限公司,规格96T);HYP检测试剂盒(批号:20220714,南京建成生物工程研究所,规格48T);总RNA提取试剂盒(批号:R1100北京索莱宝科技有限公司,规格100ml);苏木精-伊红、马松染色试剂盒(批号:G1120、G1340北京索莱宝科技有限公司,规格100ml);HiFiscript gDNA Removal CDNA Synthethesis Kit 试剂盒、MasicSYBR Mixture (批号:147100,康为世纪公司,规格50T);引物(上海生工生物工程有限公司)。
1.3 实验方法
取适量CDN,溶解于0.5%羟甲基纤维素钠。将小鼠随机分为6组,每组8只,即生理盐水(Sham)组、博来霉素(bleomycin,BLM)组、豆蔻明低剂量(low dose of Cardamonin,CDN-L)组(25mg/kg)、豆蔻明中剂量(medium dose of Cardamonin,CDN-M)组(50mg/kg)、豆蔻明高剂量(high dose of Cardamonin,CDN-H)组(100mg/kg)、地塞米松(dexamethasone,DXM)组(1mg/kg),采用单次气管内滴注5mg/kg BLM诱导肺纤维化,具体操作见文献[8]。造模第7天给与相应药物,连续给药21d。称重后进行麻醉,摘取眼球后取血,分离血清,–20℃保存。取肺组织称重,计算肺指数,具体计算公式见文献[9],采取右下肺组织组织固定液固定,余组织分装后–80℃保存。
1.4 指标检测
将固定的组织包埋成蜡块,做成4μm切片,后进行苏木精-伊红、马松染色,观察肺组织相关炎症情况采用文献[9]制定标准。采用酶联免疫法检测大鼠血清TNF-α水平。采用相应试剂盒,进行肺组织HYP水平的检测。
采用总RNA提取试剂盒提取肺脏总RNA,合成cDNA,按照MasicSYBR Mixture说明书进行PCR反应。根据2-ΔΔCt分析相对表达定量。引物见表1。
1.5 统计学方法
采用Graphpad Prism 9.5对所有数据进行Kolmogorov-Smirnov检验符合正态分布,计量数据以均数±标准差(![]() )表示,多組间比较用单因素方差分析。P<0.05为差异有统计学意义。
)表示,多組间比较用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
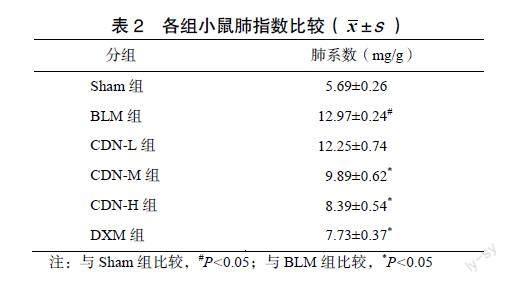
2.1 CDN对肺指数的影响
BLM组小鼠肺指数明显升高,与Sham组比较,差异有统计学意义(P<0.05);CDN-M、CDN-H、DXM组肺指数降低,与BLM组比较,差异有统计学意义(P<0.05);CDN-L与BLM组比较,差异无统计学意义(P>0.05);CDN-H组与DXM组肺指数比较,差异无统计学意义(P>0.05),见表2。
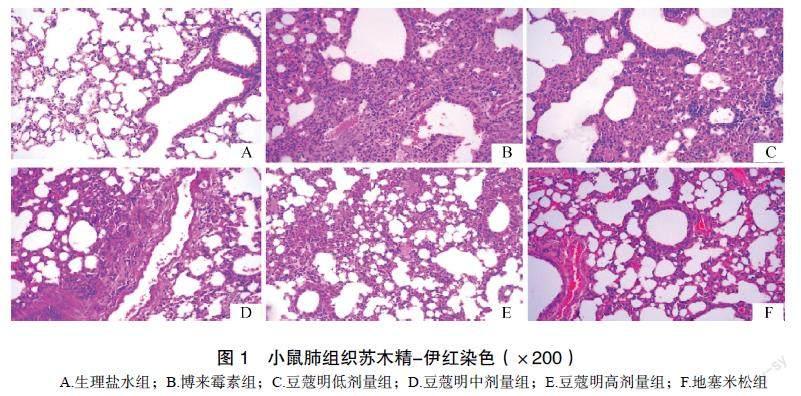
2.2 小鼠病理检查结果
Sham组小鼠肺组织结构完整,肺泡间隔正常。BLM组肺泡壁显著增厚,部分肺泡实变及塌陷不均匀分布,肺泡大小不一,肺泡腔内可见大量炎性细胞浸润及渗出液,间质可见弹力纤维和胶原纤维增生,马松染色可见肺间质大量胶原纤维沉积形成纤维灶。DXM组可见肺结构相对完整,肺间隔明显缩小,间质可见少量炎细胞浸润,肺泡内少量渗出液;马松染色可见支气管周围少量胶原纤维沉积。CDN-L组与BLM组相似。CDN-M、CDN-H组可见不同炎性程度和纤维化程度改善,CDN-H组尤为明显,马松染色胶原纤维面积减少。见图1、图2。
2.3 CDN对小鼠Szapiel、Ashcroft评分与血清中TNF-α水平影响
Szapiel评分结果:与Sham组比较,BLM组小鼠肺组织炎症评分升高(P<0.05);与BLM组比较,CDN-M、CDN-H、DXM组肺组织炎症评分不同程度降低(P<0.05),CDN-L组小鼠肺组织炎症评分稍降低(P>0.05);CDN-H组和DXM组炎症评分比较,差异无统计学意义(P>0.05)。Ashcroft评分:与Sham组比较,BLM组小鼠纤维化评分明显升高(P<0.05);与BLM组比较,CDN-M、CDN-H、DXM组肺组织纤维化评分降低(P<0.05),CDN-L组肺组织纤维化评分稍低(P>0.05);CDN-H组和DXM组纤维化评分差异无统计学意义(P>0.05),见表3。
与Sham组比较,BLM组小鼠血清中TNF-α水平升高,差异有统计学意义(P<0.05);与BLM组相比,CDN-M、CDN-H、DXM组TNF-α水平降低(P<0.05),CDN-L组差异无统计学意义(P>0.05);CDN-H组小鼠血清TNF-α水平稍高于DXM组(P>0.05),见表3。
2.4 CDN对小鼠肺组织HYP水平影响
与Sham组相比,BLM组小鼠肺组织中HYP含量升高,差异有统计学意义(P<0.05);与BLM组相比,CDN-M、CDN-H、DXM干预降低肺组织HYP含量(P<0.05),CDN-L组肺组织HYP含量稍降低(P>0.05);与DXM组比较,CDN-H组小鼠肺组织HYP含量升高,差异无统计学意义(P>0.05),见表4。
2.5 CDN对小鼠肺组织TGF-β1、smad2、samd3 mRNA水平的影响
与Sham组相比,BLM组TGF-β1、smad2、smad3
mRNA表达明显升高(P<0.05);与BLM组相比,CDN-M、CDN-H、DXM组 TGF-β1、smad2、smad3 mRNA水平降低,差异有统计学意义(P<0.05),CDN-L组小鼠TGF-β1、smad2、smad3 mRNA变化降低,差异无统计学意义(P>0.05);与DXM组比较,CDN-H组小鼠TGF-β1、smad2、smad3 mRNA表达升高,差异无统计学意义(P>0.05),见表5。
2.6 CDN对小鼠肺组织α-SMA、E-Cadherin mRNA水平影响
与Sham组相比,BLM组α-SMA mRNA水平明显升高,E-Cadherin mRNA水平减低,差异有统计学意义(P<0.05);与BLM组相比,CDN-M、CDN-H、DXM组α-SMA mRNA表达降低、E-Cadherin mRNA表达升高,差异有统计学意义(P<0.05),CDN-L组小鼠α-SMA mRNA水平降低、E-Cadherin mRNA水平升高,差异无统计学意义(P>0.05);与DXM组比较,CDN-H组小鼠α-SMA mRNA水平升高(P<0.05),E-Cadherin mRNA水平减低,差异无统计学意义(P>0.05),表5。
3 讨论
IPF是一种进行性肺部疾病,病死率高,治疗方案有限。IPF病因不明,发病机制尚未完全确定,炎症在IPF的发展早期具有举足轻重的作用。长期慢性炎症引起肺上皮细胞反复损伤,从而引起其衰老、凋亡,部分上皮细胞EMT[1]。EMT是一种生物过程,上皮细胞失去黏附功能,并获得转移入侵的能力,通过细胞外基质迁移为间充质细胞的现象,在组织学上是通过上皮细胞-细胞黏附分子如E-Cadherin丧失和间充质标志物如波形蛋白或α-SMA的增加来识别的。α-SMA是肌成纤维细胞表达的标志蛋白,纤维细胞和肌成纤维细胞过度分泌胶原蛋白导致细胞外基质沉积是肺纤维化的典型表现。HYP是胶原蛋白特有的主要成分,通过测定其水平反应胶原蛋白的含量,评估纤维化程度[11-13]。
BLM可通过引起DNA链断裂和氧化诱导肺损伤,从而引起炎症细胞在损伤部位的募集,最终导致成纤维细胞活化、细胞外基质沉积[14]。研究表明,BLM可导致小鼠体质量下降、肺指數增加,肺组织大量炎性细胞浸润和胶原蛋白沉积[8]。本研究通过单次气管内注射BLM发现肺组织弥漫性炎症和纤维化,表明肺纤维化模型建立成功。
CDN对肺损伤具有保护作用。伍晓莹等[15]研究表明CDN通过激活腺苷A2A受体减少巨噬细胞介导炎症,从而改善失血性休克诱发大鼠肺损伤。Yang等[16]研究证实,CDN在体内外通过靶向髓细胞分化因子2抑制脂多糖诱导的炎症因子产生与巨噬细胞浸润,预防急性肺损伤。此外,Lee等[17]发现CDN对颗粒物诱导的肺损伤具有保护作用,其机制可能是抑制Toll样受体2、4/髓样分化因子88和哺乳动物雷帕霉素靶蛋白自噬途径有关。最新研究表明,CDN可以改善佛波醇酯类多克隆刺激剂诱导的肺部炎症,其机制与肺泡巨噬细胞中的核因子E2相关因子/血红素加氧酶1信号通路激活有关[6]。然而,CDN对肺纤维化的作用及其机制鲜有文献报道。
TNF-α是由活化的巨噬细胞产生的一种多功能细胞因子,参与正常的炎性反应与免疫反应。同时,TNF-α可促进成纤维细胞分化并产生大量胶原蛋白,与巨噬细胞细胞释放的纤维结合素相互作用形成初期的肺泡炎[18]。最新研究表明,TNF-α可以促进肺驻留间充质干细向肌成纤维细胞分化,其机制与核转录因子-κB信号有关[19]。本研究中CDN可显著抑制肺组织纤维化和炎症改变,降低HYP和血清中TNF-α水平,降低肺指数。这些证据表明,CDN可以改善BLM诱导的炎症并具有抗纤维化作用,且与DXM治疗效果相似。此外,本研究CDN-L组治疗效果不明显,这可能与CDN在体内未达到有效血药浓度有关,CDN口服后具有吸收不良、生物利用度低、清除率高、平均停留时间短等缺点[20]。
一项关于单细胞RNA测序研究表明TGF-β通路是异常肺上皮细胞群中上调最多的通路之一,在IPF肌成纤维细胞中,TGF-β1激活其受体,促进Smad2/3磷酸化与Smad4相互作用并易位到细胞核中激活EMT和纤维化相关基因如纤连蛋白、胶原蛋白等转录合成胶原蛋白,另一方面通过基质金属蛋白酶抑制细胞外基质降解,促进纤维化,在BLM诱导的肺纤维化模型中,滇龙胆草通过调控TGF-β1/Smad2/3信号通路抑制EMT发挥抗纤维作用[21-23]。本研究发现小鼠肺组织中 TGF-β1/Smad2/3 信号在 BLM 诱导的肺纤维化过程中被激活。CDN干预后,小鼠TGF-β1、Smad2、Smad3、α-SMA mRNA表达下降,E-Cadherin mRNA表达升高。由此可见,CDN可能通过下调TGF-β1/smad信号通路介导EMT对BLM诱导肺纤维化小鼠发挥抗纤维化作用。
综上所述,CDN可以抑制肺纤维化的炎症与胶原蛋白沉积,其机制可能通过下调TGF-β1/smad信号通路介导EMT对BLM诱导肺纤维化小鼠发挥抗纤维化作用。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
- MAHER T M, BENDSTRUP E, DRON L, et al. Global incidence and prevalence of idiopathic pulmonary fibrosis[J]. Respir Res, 2021, 22(1): 197.
- FERN?NDEZ-FABRELLAS E, MOLINA-MOLINA M, SORIANO J B, et al. Demographic and clinical profile of idiopathic pulmonary fibrosis patients in Spain: The SEPAR national registry[J]. Respir Res, 2019, 20(1): 127.
- RICHELDI L, COLLARD H R, JONES M G. Idiopathic pulmonary fibrosis[J]. Lancet, 2017, 389(10082): 1941–1952.
- BATLLE E, MASSAGU? J. Transforming growth factor-β signaling in immunity and cancer [J]. Immunity, 2019, 50(4): 924–940.
- 黄莺, 徐芳. 虎杖总蒽醌对肺间质纤维化大鼠上皮间质转化过程中TGF-β1/Smad信号通路的影响[J]. 中成药, 2021, 43(1): 204–207.
- CHEN Y C, CHENG Y K, CHEN J H, et al. Cardamonin attenuates phorbol 12-myristate 13-acetate-induced pulmonary inflammation in alveolar macrophages[J]. Food Chem Toxicol, 2022, 159:112761
- HE J, ZHOU H, MENG J, et al. Cardamonin retards progression of autosomal dominant polycystic kidney disease via inhibiting renal cyst growth and interstitial fibrosis[J]. Pharmacol Res, 2020, 155: 104751.
- 曹敏. 血紅蛋白氧载体对博来霉素致小鼠肺纤维化的治疗作用[D]. 成都: 电子科技大学, 2022.
- 丁慢玲. 柴胡皂甙d抑制博来霉素诱导的肺纤维化小鼠细胞焦亡机制的研究[D]. 镇江: 江苏大学, 2022.
- PENG L, WEN L, SHI Q F, et al. Scutellarin ameliorates pulmonary fibrosis through inhibiting NF- κB/NLRP3-mediated epithelial-mesenchymal transition and inflammation[J]. Cell Death Dis, 2020, 11(11): 978.
- HEWLETT J C, KROPSKI JA, BLACKWELL T S. Idiopathic pulmonary fibrosis: Epithelial -mesenchymal interactions and emerging therapeutic targets[J]. Matrix Biol, 2018, 71: 112–127.
- LACY S H, WOELLER C F, THATCHER T H, et al. Activated human lung fbroblasts produce extracellar vesiles wih anti-frtic prostaglandins[J]. Am J Respir Cell Ml Biol, 2019, 60(3): 269–278.
- JENKINS R G, MOORE B B, CHAMBERS R C, et al. An Official American Thoracic Society Workshop report: Use of Animal BLMs for the preclinical assessment of potential therapies for pulmonary fibrosis[J]. Am J Respir Cell Mol Biol, 2017, 56(5): 667–679.
- TASHIRO J, RUBIO G A, LIMPER A H, et al. Exploring animal BLMs that resemble idiopathic pulmonary fibrosis[J]. Front Med (Lausanne), 2017, 4: 118.
- 伍晓莹, 张加强, 李宏宾, 等.豆蔻明对失血性休克复苏诱发大鼠急性肺损伤的影响[J]. 中华麻醉学杂志, 2016, 36(7): 882–885.
- YANG L, LUO W, ZHANG Q, et al. Cardamonin inhibits LPS-induced inflammatory responses and prevents acute lung injury by targeting myeloid differentiation factor 2 [J]. Phytomedicine, 2021, 93: 153785.
- LEE W, HAHN D, SIM H, et al. Inhibitory functions of Cardamonin against particulate matter-induced lung injury through TLR2, 4-mTOR-autophagy pathways[J]. Fitoterapia, 2020, 146: 104724.
- 田莉, 王献华, 马小兵, 等. TNF-α介导的 NF-κB 信号通路在肺纤维化中的作用[J]. 现代预防医学, 2011, 38(2): 361–363.
- HOU J, MA T, CAO H, et al. TNF-α-induced NF-κB activation promotes myofibroblast differentiation of LR-MSCs and exacerbates bleomycin-induced pulmonary fibrosis[J]. J Cell Physiol, 2018, 233(3): 2409–2419.
- JAISWAL S, SHUKLA M, SHARMA A, et al. Preclinical pharmacokinetics and ADME characterization of a novel anticancer chalcone, Cardamonin[J]. Drug Test Anal, 2017, 9(8): 1124–1136.
- ADAMS T S, SCHUPP J C, POLI S, et al. Single-cell RNA-seq reveals ectopic and aberrant lung resident cell populations in idiopathic pulmonary fibrosis[J]. Sci Adv, 2020, 6(28): Eaba1983.
- DING Q, SUBRAMANIAN I, LUCKHARDT T R, et al. Focal adhesion kinase signaling determines the fate of lung epithelial cells in response to TGF-beta[J]. Am J Physiol Lung Cell Mol Physiol, 2017, 312(6): L926–L935.
- 皮娜, 何琴, 钟燕, 等. 滇龙胆草调控TGF-β1/Smad2/3信号通路抑制肺纤维化小鼠肺上皮间质转化[J]. 中药药理与临床, 2021, 37(6): 58–63.
(收稿日期:2023–04–28)
(修回日期:2023–11–15)
