复发性宫颈癌免疫治疗进展后挽救性治疗的临床意义*
2024-03-29刘超霞王子毅冉晓敏张克强邓玉屏
刘超霞,王子毅,周 萍,冉晓敏,张克强,邓玉屏
(中南大学湘雅医学院附属湖南省肿瘤医院妇瘤科,长沙 410013)
宫颈癌是世界范围内女性最常见的第四大肿瘤,同时也是癌症相关死亡的第四大常见因素[1]。早期宫颈癌预后较好,晚期患者复发风险较高。伴有盆腔淋巴结或腹主动脉旁淋巴结转移的局部晚期宫颈癌5年生存率不超过40%[2]。免疫检查点抑制剂(immune check point inhibitors,ICIs)出现之前,复发性宫颈癌的一线治疗方案为紫杉醇加顺铂联合贝伐珠单抗。2021年5月Colombo等[3]证实帕博利珠单抗联合化疗±贝伐珠单抗能显著提高复发或持续性宫颈癌的疗效。然而随着免疫检查点抑制剂在临床上的广泛使用,免疫治疗后进展的患者逐渐增多,目前还未有指南推荐的标准挽救治疗方案可用。免疫治疗失败的患者如何进行挽救性治疗,选择何种挽救性治疗方案将是亟需解答的问题。本研究通过回顾分析宫颈癌患者免疫治疗进展后的挽救性治疗疗效,从而了解挽救性治疗的临床意义,并探索最佳的挽救性治疗方案。
1 资料与方法
1.1 临床资料 收集2018年2月1日至2022年12月31日于湖南省肿瘤医院就诊的使用免疫检查点抑制剂后进展的宫颈癌患者134例。纳入标准:(1)病理类型为鳞癌、腺癌或腺鳞癌。(2)患者至少接受了2个疗程含免疫检查点抑制剂治疗并评估疗效为进展。(3)ECOG评分0-2分。排除标准:(1)组织学为小细胞(神经内分泌)宫颈癌和黏液性腺癌;(2)仅接受1疗程免疫检查点抑制剂治疗;(3)未进行疗效评价或评价为非进展。根据免疫治疗后是否行挽救性治疗分为治疗组和对照组。收集患者的信息,包括年龄、临床病理特征、治疗方案等,本研究已通过湖南省伦理委员会批准同意。
1.2 方法 患者均接受至少2疗程免疫检查点抑制剂治疗。免疫检查点抑制剂主要为PD-1(programmed cell death protein-1)抑制剂,或PD-1/CTLA-4双抗(cytotoxic T-cell lymphocyte-4)。联合化疗方案:紫杉醇+顺铂/卡铂±贝伐珠单抗或白蛋白紫杉醇+顺铂/卡铂±贝伐珠单抗。口服酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKIs)药物:阿帕替尼、安罗替尼、法米替尼或仑伐替尼。患者在每2~3疗程免疫治疗后行CT或MRI对疗效进行评估为进展。进展后治疗组接受挽救性治疗,挽救性治疗方案分为:免疫治疗进展后接受了化疗±贝伐珠单抗(Chemo组)、化疗±贝伐珠单抗+免疫检查点抑制剂(Chemo+ICIs组)、免疫检查点抑制剂+酪氨酸激酶抑制剂(ICIs+TKIs组)。治疗后每2~3疗程完善CT或MRI进行疗效评估。疗效评估标准参照实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1版。
1.3 随访 采用复诊方式进行随访,无法复诊者微信或电话联系。无进展生存期-1(progression-free survival,PFS-1)定义为免疫治疗开始至免疫治疗后第一次疾病进展或死亡时间。无进展生存期-2(progression-free survival,PFS-2)定义为:首次免疫治疗进展后,肿瘤挽救性治疗开始至疾病再次进展或死亡时间。总生存期-1(overall survival-1,OS-1)定义为免疫治疗开始至死亡或存活者末次随访的时间。总生存期-2(overall survival-2,OS-2)定义为肿瘤挽救性治疗开始至死亡或存活者末次随访的时间。随访截至2023年4月。
1.4 统计学处理 采用SPSS 23.0软件。采用独立样本T检验、χ2检验和Fisher精确检验比较两组间的人口统计学和临床患者特征,采用Kaplan-Meier检验PFS-1、OS-1、PFS-2及OS-2,采用Log-rank检验进行组间比较。P<0.05为差异有统计学意义。
2 结 果
2.1 患者的临床病理特征 共134例患者免疫治疗后出现进展,治疗组65例患者接受挽救性治疗,对照组69例未接受进一步抗肿瘤治疗。患者的临床病理特征见表1。治疗组单药占比27.7%(18/65),而对照组中免疫抑制剂单药占比较高50.7%(35/69);治疗组联合用药占比高于对照组,两组比较差异有统计学意义(P=0.045)。联合化疗方案,紫杉醇+顺铂/卡铂:治疗组23例,对照组10例;白蛋白紫杉醇+顺铂/卡铂:治疗组14例,对照组12例。两组化疗方案占比无统计学差异(P=0.211)。
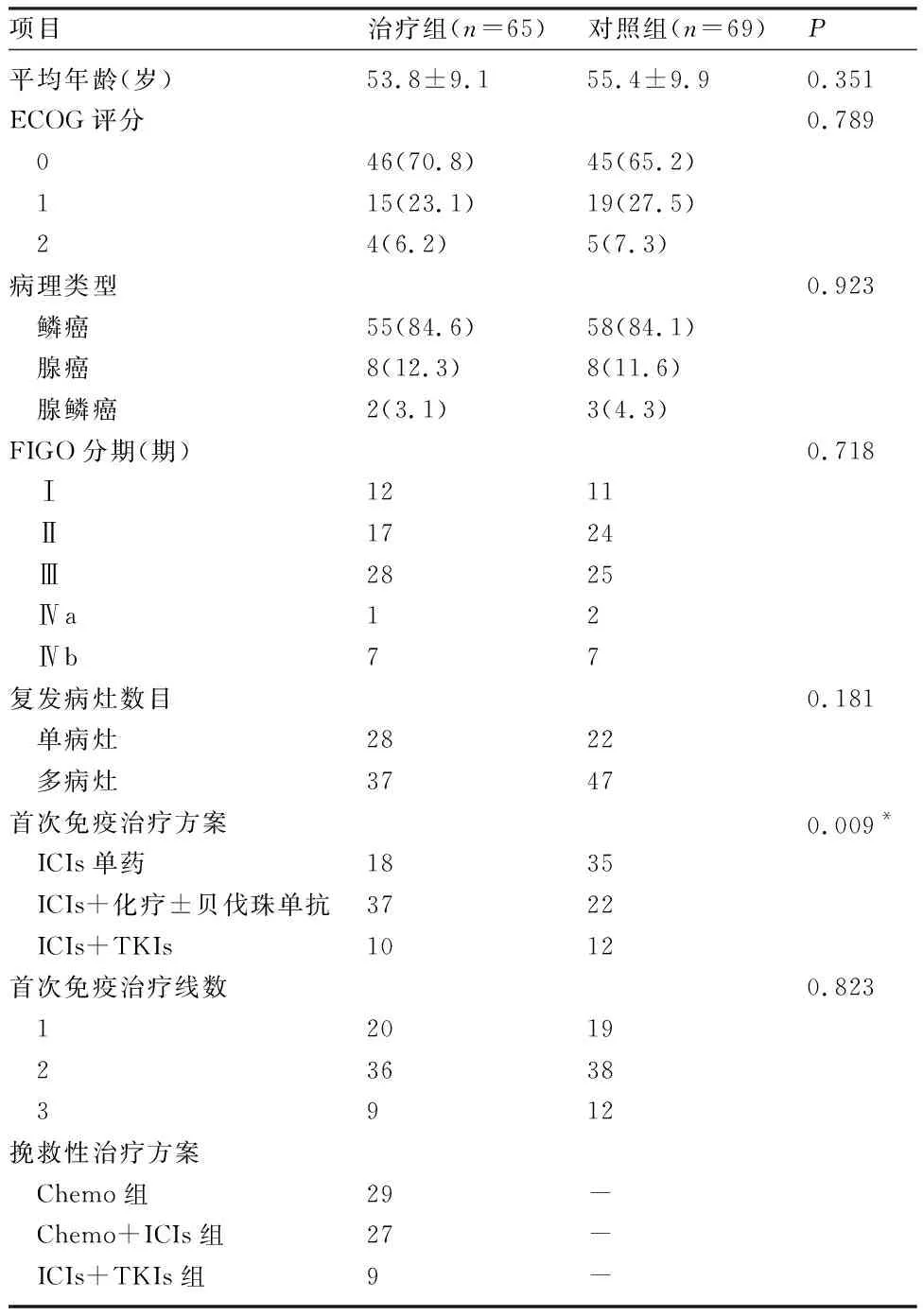
表1 两组患者的临床病理特征
2.2 治疗组和对照组治疗疗效 治疗组和对照组从首次复发开始到免疫启动平均(8.7±10.5)个月和(8.2±9.4)个月,两组比较差异无统计学意义(P=0.777)。中位随访时间37个月。首次免疫治疗开始后,治疗组和对照组的中位PFS-1分别为4.9月(95%CI为2.9~6.9)及4.9月(95%CI为2.8~7.0),两组比较差异无统计学意义(P=0.904),见图1A。截止2023年4月,治疗组及对照组分别死亡28例及52例,两组中位OS-1分别为22.7个月(95%CI为18.7~26.7)和10.9个月(95%CI为8.7~13.1),两组比较差异有统计学意义(P=0.000),见图1B。
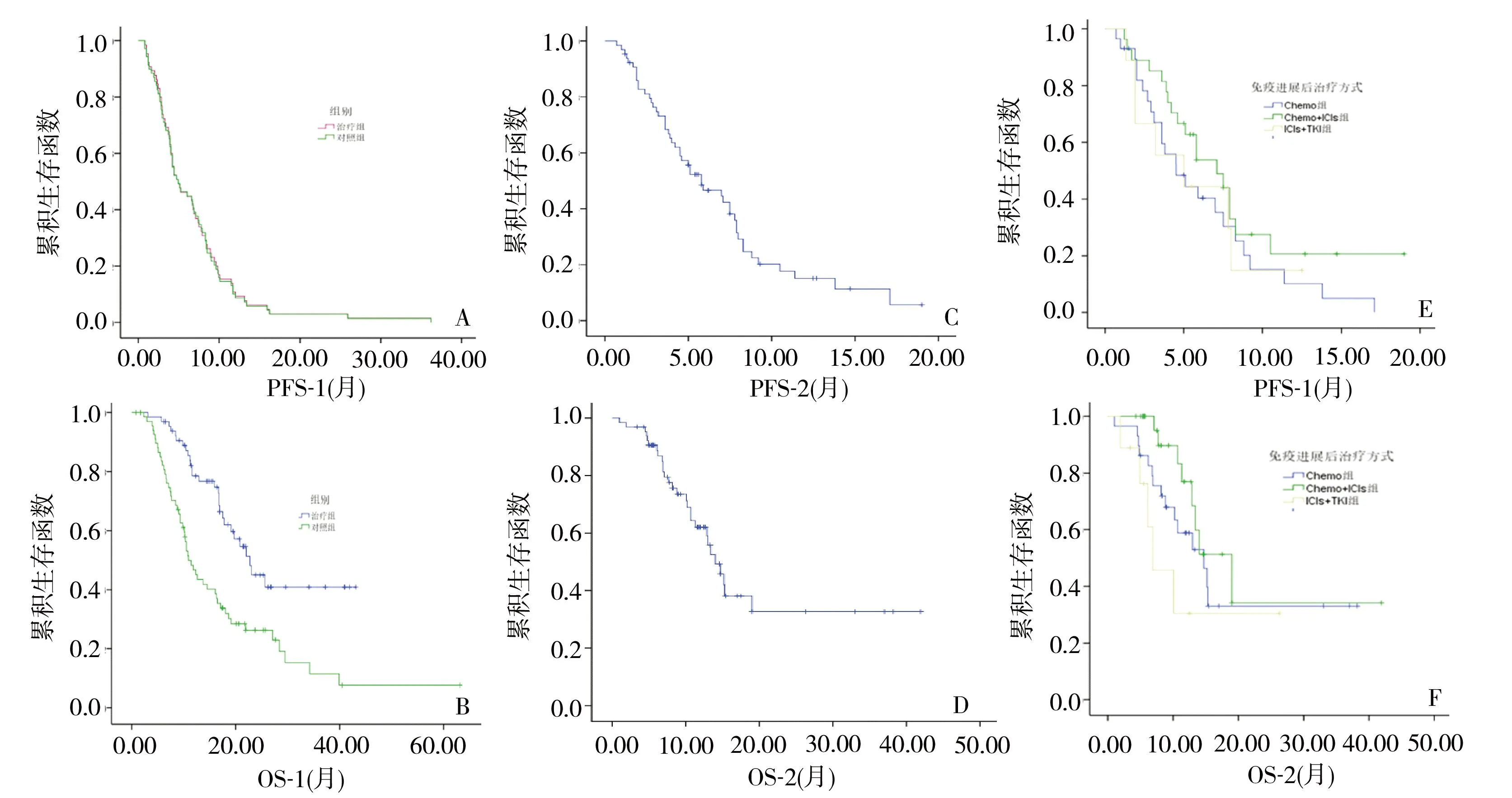
图1 治疗组和对照组的PFS和OSA:治疗组和对照组PFS-1;B:治疗组和对照组OS-1;C:治疗组PFS-2;D:治疗组OS-2;E:治疗组不同方案的PFS-2;F:治疗组不同方案的OS-2
2.3 治疗组挽救性治疗疗效 免疫治疗进展后,治疗组接受了挽救性治疗,治疗方案为:化疗±贝伐珠单抗(Chemo组)29例,化疗±贝伐珠单抗+ICIs(Chemo+ICIs组)27例,免疫检查点抑制剂+口服酪氨酸激酶抑制剂(ICIs+TKIs组)9例,见表1。挽救性治疗时的化疗方案:白蛋白紫杉醇±顺铂/卡铂34例,紫杉醇+顺铂/卡铂15例,脂质体阿霉素+顺铂3例,吉西他滨+奥沙利铂2例,依托泊苷胶囊2例。治疗组在接受挽救性治疗65例中,49例进展,疾病控制率为24.6%。中位PFS-2为5.7月(95%CI为3.6~8.0),中位OS-2为14个月(95%CI为11.5~16.5),见图1C、D。
根据治疗组进展后挽救性治疗方案不同,比较Chemo组、Chemo+ICIs组、ICIs+TKIs组3组之间的疗效,3组的中位PFS-2分别为4.5、7.0个月和5.1个月,3组之间差异无统计学意义,见图1E。3组之间中位OS-2分别为14.7、19个月和6.9个月,Chemo+ICIs组的中位OS-2较ICIs+TKIs组长,差异有统计学意义(P=0.029),见图1F。
2.4 治疗组挽救性治疗不良反应 治疗组接受了不同挽救性方案,ICIs联合化疗的白细胞、血小板减少发生率相对于ICIs+TKIs明显较高,尤其是3级以上白细胞及血小板减少,但差异无统计学意义。此外,化疗导致的恶心呕吐及食欲减退患者较多,而ICIs+TKIs耐受性更好。见表2。
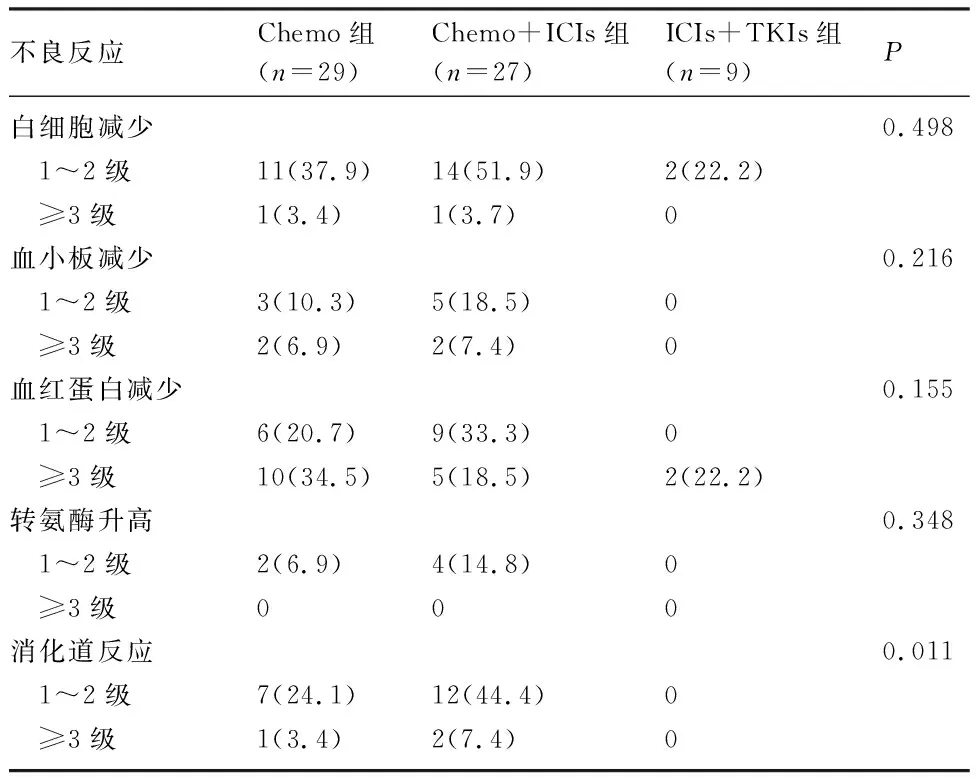
表2 治疗组不同方案的不良反应[n(%)]
3 讨 论
Chung等[4]在KEYNOTE-158试验中证实帕博利珠单抗单药在晚期宫颈癌中的客观缓解率为12.2%。由于单药疗效并不满意,之后很多研究者思考PD-1抑制剂与其他不同的药物组合从而期待达到更大的疗效,如PD-1抑制剂卡瑞利珠单抗与阿帕替尼[5]、信迪利单抗与安罗替尼[6]、PD-1/CTLA-4双特异性抗体卡度尼利单抗,或PD-1抑制剂与不同化疗方案的组合[3]。联合治疗的疗效较单药明显提升。因此在最新版宫颈癌指南中紫杉醇+顺铂±贝伐珠单抗+帕博利珠单抗已推荐为PD-L1阳性患者的一线治疗方案。然而,即使KEYNOTE-826中联用帕博利珠单抗后其PFS从8.2个月提升到10.4个月,而实际上其12月PFS率也仅从33.5%提升到44.7%[3],提示仍有一大半患者出现进展。免疫治疗后进展是当前免疫治疗时代必须面对的难题。目前对于免疫治疗后进展的研究多见于肺癌[7-8]、恶性黑色素瘤[9]、尿道上皮癌[10]或肾癌[11]。在宫颈癌上尚未见类似报道。
本研究通过回顾分析我院134例复发性宫颈癌免疫进展后的患者疗效,了解真实世界中免疫进展后接受挽救性治疗的意义。2018~2020年患者多接受单药治疗,其中多数为临床试验招募患者,这也与临床医生对于免疫治疗的逐步认识以及市面上的药物研发上市相关。随着免疫药物在临床的全面上市以及新的指南更新,2021年开始患者多接受免疫治疗联合化疗或口服抗血管生成药物。治疗组患者接受联合治疗方案高于观察组,但是两组患者首次免疫治疗至免疫后第一次进展的中位时间均为4.9个月,明显低于KEYNOTE-826中的10.4个月,原因可能是:(1)本研究中治疗组27.7%(18/65),对照组50.7%(35/69)患者均为单药治疗,而单药治疗疗效本来就低。Oaknin等[12]研究证实,即使PD-1与CTLA-4双检查点抑制剂联用的客观缓解率也仅仅为26.3%,中位PFS为5.1个月。而PD-1抑制剂单药的有效率则更低。(2)本研究中,治疗组69.2%(45/65)、对照组72.5%(50/69)的患者免疫治疗为二三线治疗。Chung等[4]发现,在二三线复发性宫颈癌中的中位PFS仅为2.1月。而Ma等[13]研究认为,免疫检查点抑制剂在早期加入对疗效有更明显的提升。虽然两组免疫治疗进展后PFS-1类似,但治疗组接受了挽救性治疗,其中位OS-1达到22.7个月,明显长于对照组的10.9个月,在接受挽救性治疗后患者的中位OS-2达到14个月,提示即使经免疫治疗后进展的患者,进一步的挽救性治疗对于延长患者的生存期仍具有重要意义。
治疗组患者免疫治疗后,PFS-2达到5.7个月,提示挽救性治疗有一定的临床意义。在挽救性治疗方案中,发现更多的患者采用了白蛋白紫杉醇±铂类方案,可能基于Li等[14]研究发现白蛋白紫杉醇联合奈达铂在复发性宫颈癌一线治疗中的客观缓解率达到50%,PFS达到9.1个月,高于紫杉醇+顺铂。
虽然挽救性治疗方案为患者带来了不错的疗效,然而,挽救性治疗三组方案中的中位PFS-2并无统计学差异,仅Chemo+ICIs组的OS-1 19个月长于ICIs+TKIs组的6.9个月,可能化疗+免疫±贝伐珠单抗的三药联用疗效还是相对更加强效,这也有待于进一步研究。Zaremba等[15]认为,恶性黑色素瘤免疫治疗进展后如再次启动免疫治疗,选择PD-1抑制剂联合其他药物的缓解率优于PD-1抑制剂单药治疗。Calabretta等[16]认为,霍奇金淋巴瘤免疫治疗进展后可通过化疗进行挽救,但最佳挽救性治疗方案还需进一步研究。免疫治疗进展后应用化疗挽救时需严密注意患者的化疗副反应,尤其是血象变化,患者在多线治疗后,随着疾病的进展,易出现疼痛、食欲差、贫血等一系列变化,从而机体耐受欠佳,尤其是白细胞及血小板下降。本研究中Chemo组及Chemo+ICIs组均出现了≥3级的白细胞及血小板下降,最严重的患者血小板下降至2×109/L,经多种方法处理无法缓解而放弃治疗,而ICIs+TKIs组耐受性更好。因此,挽救性治疗时,务必在每疗程对患者进行重新评估从而制订合适的补救治疗方案。
由于免疫检查点抑制剂在宫颈癌治疗应用的时间不长,目前对于复发性宫颈癌免疫进展后的治疗还未得到更多的重视,本文为回顾性研究,无法完全匹配不同挽救性治疗患者的基线。而且ICIs+TKIs组病例数较少,未来随着免疫检查点抑制剂在临床实践中的大量使用,可能会出现更多的随机双盲的三期临床试验。
综上所述,复发性宫颈癌免疫进展后,患者接受挽救性治疗可延长患者的PFS及OS,提示挽救性治疗的必要性,化疗+免疫±贝伐珠单抗的疗效可能更好。但目前仍有一些问题尚需解决,如挽救性治疗的最佳化疗方案、疗程、剂量等,希望更多的针对性的前瞻性研究或多中心大样本回顾性研究来验证和扩展本研究。
