胎盘微生态与子痫前期的相关性研究*
2024-03-29吕振楠孙晓敏王翠秀
吕振楠,孙晓敏,王翠秀
(1.内蒙古医科大学,呼和浩特 010010;2.内蒙古医科大学附属医院妇产科,呼和浩特 010010)
子痫前期(pre-eclampsia,PE)是一种以妊娠期新发血压升高为主要临床表现的多器官、多系统功能受累的复杂临床综合征[1]。全球发病率为2%~8%[2]。其多因素、多机制、多通路的发病特点始终是妇产科研究领域的热点。近年来,有学者提出PE发病机制“两阶段”学说,即第一阶段,在孕早期,由于遗传、免疫等因素造成滋养细胞侵袭不足,子宫螺旋动脉重塑障碍,导致子宫动脉血流阻力增加,胎盘灌注降低;第二阶段,胎盘缺血缺氧,过度氧化应激,继发的母体多系统受损[3]。目前,临床工作中大多采用血管生成因子及抗血管生成因子作为预测PE的风险指标,但因其缺乏特异性,目前临床中仍缺乏较为准确的筛选工具及有效预防措施。目前PE的治疗以降压、解痉为主,而最为有效的治疗方法是提前终止妊娠,娩出胎盘[4]。因此,积极寻找PE的发病机制,可为临床治疗提供新的靶点,并有效改善母婴预后及相关近远期并发症。
近年来,随着“胎盘有菌”这一观点被大多数研究证实后[5],有学者进一步指出,胎盘微生物可能影响妊娠结局,其可通过产生抗原或其他炎症因子引发感染和炎症反应,最终导致PE、早产、妊娠期糖尿病等不良妊娠结局[6]。与此同时已有大量研究证实,肠道菌群与PE有一定的相关性[7],而胎盘菌群的来源之一便是肠道菌群,因此“肠道-胎盘”轴可作为PE研究的又一途径,由此找出失调的菌落及致病菌并通过靶向调节菌群以改善妊娠结局。
1 胎盘微生物的发现及来源
近年来,随着多重组织学、高通量测序研究和分子生物学技术的发展,胎盘微生物的存在已在众多研究中得到证实。并且一些研究表明,正常妊娠胎盘菌群主要由变形菌门(数量最多)、放线菌门、梭杆菌门、厚壁菌门和软壁菌门组成,其中软壁菌门是胎盘特有的菌群[8]。那么,胎盘微生物从何而来?又如何定植呢?目前的研究提出了许多假设,包括泌尿生殖道-胎盘途径(菌群从下消化道移位至生殖道并逆行透过胎盘屏障);胃肠-胎盘途径(肠道渗漏);口腔-胎盘途径和血液循环途径等[9-10]。
1.1 胎盘微生物的发现 2014年提出的全球人类胎盘计划(human placenta project,HPP),其目的是阐述胎盘发育对于人类长期健康和疾病的影响,并最终希望能应用于临床,进一步表明胎盘研究的重要性。胎盘作为母胎之间的“沟通桥梁”,对维持胎儿正常生长发育和母体健康十分重要。很多年前,学者普遍认为,除外感染的发生,胎盘是无菌的。如今,这一说法受到了质疑。1982年,国外学者首次在胎盘中发现了细菌的存在[11]。随后相关的研究通过收集、提取刚分娩产妇的胎盘组织进行DNA样本序列检测,进一步揭示了胎盘中存在微生物[8]。因此,胎盘不再被认为是严格无菌的器官,而是蕴藏着一个独特的微生物群的器官,这种微生物群的存在可能是正常的,也可能与不良妊娠结局有关。
1.2 胎盘微生物的来源
1.2.1 来源于口腔 人类口腔和胎盘微生物群落之间的相似性此前已被提出。文献报道,胎盘内的微生物菌群与口腔微生物菌群的结构存在高度一致性,推测胎盘菌群大概率是由孕妇的口腔所起源的[10]。此外,有研究将胎盘微生物群与孕妇阴道、肠道及口腔的微生物群对比后,发现胎盘微生物与口腔微生物二者的菌群构成有较多的相似性,也证实了上述猜想的正确性[12]。综合以上研究成果,可推断胎盘微生物菌群一部分来源于口腔微生物。
1.2.2 来源于肠道 有报道称,人类在妊娠期间尤其是孕晚期肠道菌群的结构和组成发生了显著变化,肠黏膜上皮会出现低度炎症反应,这种炎症可能会将微生物生态失调驱动到一个正反馈循环中,从而改变宿主反应,导致肠道细菌易位增加[13-14]。根据一些学者提出的“肠道-胎盘菌群轴假说”[14],推测肠道菌群可能通过某些方式易位至胎盘,并在此定植[15]。在一个实验动物模型中,在胎盘中检测到了引入妊娠小鼠肠道的特异性标记细菌[16]。另有实验将肠球菌等肠道菌群给妊娠小鼠口服,同样在羊水、胎盘和胎儿检测了该菌[17]。此外,Satokari[18]与其团队成员在经剖宫产术分娩的胎盘中,检测到了双歧杆菌和乳酸杆菌等肠道菌群的脱氧核糖核酸(Deoxyribo Nucleic Acid,DNA),并且研究出细菌的DNA可能经胎盘从母体水平转移到胎儿并在其肠道内定植。这种定植机制可能是通过树突状细胞完成的,树突状细胞可穿透肠黏膜上皮,找到和大肠杆菌活性相似的共生菌并与之结合,通过体循环传播到全身各处[19]。综合以上研究成果,可推断胎盘微生物菌群一部分来源于肠道微生物。
1.2.3 来源于生殖道 生殖道的微生物上移也是胎盘微生物的来源之一。相关研究表明,胎盘中的细菌群落与阴道中的细菌群落具有相似的结构。目前,研究发现,胎膜早破的孕妇是由于生殖道菌群紊乱,致病菌及其代谢产物分解胎膜的基质和胶质引起的[20]。因此通常认为早产是阴道细菌上行感染至胎盘引起。国外学者也观察到新生小鼠肠道微生物的构成与母体阴道微生物保持高度一致[5]。借此推测阴道微生物可通过胎盘定植到新生小鼠体内。其次,某研究利用生物发光技术在哺乳动物的胎盘、胎膜、羊水中均检测到了来自生殖道的大肠杆菌,由此进一步证实了微生物能从生殖道逆行至胎盘[21]。
综上所述,胎盘微生物的来源主要包括微生物从阴道逆行性感染,以及母体肠道和口腔微生物通过血行扩散到胎盘或通过母体循环进入胎盘,并在早期血管化和胎盘形成期间定植。
2 胎盘微生物与PE
人类微生物组包括数百种不同的微生物,它们寄生在人体内,与人体相互影响、互利共生,共同维持人体内微生态平衡。而在妊娠期间,这种影响将进一步扩大且这种影响不局限于某个部位或器官,是多个部位和器官的相互调节,从而共同维持微生态平衡。当微生物多样性发生改变、菌群比例出现失衡或外界病原体侵入机体,均可能引起局部微生物失衡,从而引起机体局部环境改变。
目前越来越多关于PE微生物组的研究支持细菌在妊娠期高血压疾病多因素发病机制中的作用。其中,肠道菌群、肠道微生物研究是近年来的研究热点。人体肠道内含有大量的微生物,这些微生物在为人体提供营养、调节代谢功能、维护肠道屏障功能、诱导先天性免疫以及维持肠道微生态平衡等方面发挥重要作用[22]。当肠道微生态的平衡出现紊乱时,便对机体产生不利影响。前期大量研究表明,人类50多种以上的疾病与人体的菌群失调相关[23],其中包括妊娠期相关疾病,如PE、妊娠期糖尿病、代谢综合征、早产等[24]。大量研究发现,肠道菌群组成的改变可能引起免疫耐受、炎症反应、糖脂代谢异常及氧化应激等不良结果,并最终导致PE的发生发展[14]。由于肠道菌群作为胎盘菌群的来源之一,推测“肠道-胎盘”轴与PE存在一定相关性,并将其作为研究PE发病机制新的切入点。
2020年,随着“肠道-胎盘”轴这一假说的提出[14],让我们对胎盘菌群的认知上了一个新的台阶。何胜悦等[25]研究表明,肠道菌群失调可能通过p38MAPK途径介导细菌移位到胎盘组织中,激活缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)并靶向调控可溶性fms样的酪氨酸激酶1(soluble fms-like tyrosine kinase 1,sFlt-1)、可溶性内皮糖蛋白(solubleendo glin,sEng)基因转录启动子区域缺氧反应元件,这些元件有助于增加外周血sFlt-1和sEng水平,导致PE发病。此外,陈夏等[14]研究发现,PE患者胎盘的微生物量高于健康孕妇,其中梭杆菌属可能是PE发生发展过程中的关键调节因子。其原因可能是梭杆菌属可破坏肠道上皮细胞,导致肠道渗漏,而肠道渗漏的后果是使更多的梭杆菌属和其他致病菌移位至胎盘组织中。转移到胎盘中的细菌通过增加抗血管生成因子的释放,如sFlt-1,减少促血管生成因子的释放,如胎盘生长因子(placental growth factor,PLGF)和血管内皮生长因子(vascular endothelial growth factor,VEGF)[26]。这些都可能促使胎盘抗血管生成状态的发生,进而导致内皮功能障碍和胎盘缺血缺氧,从而导致孕产妇血压升高,最终发展成为PE。由此,推测微生物可通过“肠道-胎盘”轴途径调节sFlt-1、PLGF等因子表达,进而参与PE发生发展。
研究发现,PE患者胎盘微生物主要以拟杆菌门、厚壁菌门等为主要优势菌,而PE患者肠道微生物同样主要是由厚壁菌门、拟杆菌门等组成[27],验证了我们的猜测是有实践性的。上述研究结果与Amarasekara等[28]研究结果一致,这类菌群可能通过感染触发炎性细胞及炎性因子间的失衡,导致滋养层功能受损,引起局部炎症反应。并指出胎盘微生物群的失调增加了致病菌的生长,破坏了子宫内微生物群、滋养层和免疫细胞之间的共生关系,导致炎症级联反应。而相较于正常妊娠中的适度炎性反应,PE是一种持续存在的炎症反应状态,妊娠母体中任何一个器官的炎症激活都可能对PE发病起重要作用[29]。这与大多数研究者们多倾向于母胎界面的炎症反应诱导PE发病这一说法相一致[14]。
在生理条件下,胎盘微生物分别从革兰氏阴性菌和革兰氏阳性菌中释放脂多糖(lipopolysaccharide,LPS)/脂蛋白(lipoprotein,LPP)等细菌产物,由toll样受体(toll-like receptors,TLR)连接,并由位于滋养层表面的TLR4激活[30]。这反过来激活调节细胞因子,促进耐受微环境(母胎免疫耐受),并在正常妊娠中维持能量稳态[31]。然而,当胎盘微生物群的组成、数量或比例发生改变时(即胎盘微生态失衡),如拟杆菌增多占主导地位,乳酸杆菌减少,这会改变宿主的免疫反应,导致微生物驱动炎症,最终导致早产、妊娠期糖尿病、PE等妊娠并发症[32]。另有相关研究观察到PE患者体内的LPS生物合成途径显著增强[26]。并有研究人员通过动物实验发现,将LPS注射到啮齿类动物体内可产生如高血压、蛋白尿、母体炎症反应等PE样症状[33]。产生这类症状的原因可能是LPS注射可导致胎盘螺旋动脉重塑不足以及全身和局部炎症反应。其具体机制:来自革兰氏阴性菌的LPS可能激活TLRs,特别是TLR3、TLR4、TLR7和TLR8,诱导核转录因子κB(nuclear factor Kappa-B,NF-κB)—一种炎症介质;而来自革兰氏阳性菌的LPP或肽聚糖能激活TLR2,进而通过一系列中间步骤激活NF-κB,其可启动相应靶基因的转录、翻译和蛋白合成,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-8(interleukin-8,IL-8)、IL-6等多种炎症因子,从而引发、维持和调控炎症免疫反应[34]。由此共同启动了包括胎盘异常和母体综合征在内的PE的发病机制。通过以上实验表明微生物可能通过“肠道-胎盘”轴途径导致胎盘微生态失衡,进而介导局部及全身炎症反应,从而引起PE。
此外,胎盘中细菌群落似乎在代谢上富含与脂肪酸(特别是短链脂肪酸)、色氨酸和苯甲酸盐代谢相关的基因[35]。其中,胎盘中色氨酸的分解代谢增强了母胎免疫耐受的建立和维持、抗感染抗菌活性的调节以及促进胎儿神经发育。此外,胎盘细菌还富含编码脂肪酸(特别是短链脂肪酸)代谢相关基因,胎盘代谢组研究发现PE的胎盘内脂肪酸含量高于正常的胎盘,且升高的脂肪酸以花生四烯酸为主[36]。PE患者脂肪动员的增加表明,脂质代谢异常与PE有密切联系。机体的代谢变化具有一体化、联动性的特点,肠道微生物与胎盘微生物代谢相互影响、互相作用,形成炎症失调状态,由此进一步证实了“肠道-胎盘”轴在PE发病机制中的重要作用。一旦“肠道-胎盘”轴中出现菌群紊乱,均可导致色氨酸和脂肪酸的代谢障碍,进而引起母胎能量稳态受损,这可能引发或加剧PE事件,特别是在妊娠晚期,从而导致严重的PE[37]。
综上所述,胎盘微生物可通过多种途径参与PE的发病(图1)。反过来,PE状态下胎盘处微生物的构成可能是母胎胎盘屏障处细菌类型、功能和机体状态共同决定的结果,并由此形成一个“恶性”循环,最终导致母胎的严重并发症及不良预后。
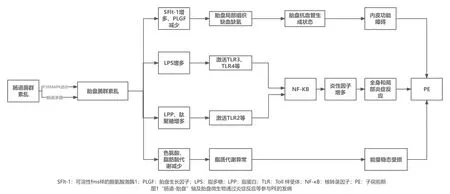
图1 “肠道-胎盘”轴及其通过炎症反应等参与PE的发病
3 结 论
由于PE的异质性和复杂性,目前治疗方式十分有限。本文将胎盘微生物作为出发点,以“肠道-胎盘”轴为切入点探讨PE发病机制。通过对比大量研究结果,力求找出PE与正常妊娠胎盘菌群的差异性及致病菌,从而通过某些措施在妊娠期调节母体微生物组的菌群失调,进而改善PE的不良妊娠结局。近些年研究发现,妊娠期妇女口服益生菌(双歧杆菌和乳酸杆菌等),可调节胎盘和胎儿肠道中Toll样受体的表达[38],减少母胎界面炎症反应刺激。基于上述研究,“口腔-胎盘”轴、“生殖道-胎盘”轴亦可作为改善PE的不良预后的另一措施,但目前相关研究较少。综上所述,正确总结分析胎盘菌群在PE发病中的影响,以胎盘菌群为靶点可能有效改善PE的发病情况以及减少对母婴的有害影响,为PE的发病机制提供一个全新的方向。
