黄曲霉对不同含水量新疆鲜食核桃活性氧代谢的影响
2024-03-28王园梦白羽嘉冯作山王洁喻苹
王园梦,白羽嘉*,冯作山,王洁,喻苹
(1.新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐 830052;2.新疆果品采后科学与技术重点实验室,新疆 乌鲁木齐 830052)
核桃,又称胡桃、万岁子等,属胡桃科胡桃属植物[1]。中国核桃栽培面积居世界第一,年产量在10 万t以上[2]。核桃仁营养成分均衡,并具有健胃、补血、润肺、益肾和补脑等多种功效[3]。新疆核桃虽然面积和产量优势不明显,但其已经建成以“温185”、“新2 号”品种为主的全国最大的薄皮核桃产区[4]。目前,去掉青皮直接出售的鲜食核桃因其口味新奇、口感细腻,且营养价值较高,越来越受到人们的喜爱。在中国,鲜食核桃的消费热度和需求量越来越高,销售量每年都不断增加。研究发现,干制核桃的营养价值、含水量及代谢水平均低于鲜食核桃,在自然条件下影响霉菌生长繁殖的主要因子是环境水分和环境温度,所以在自然环境下鲜食核桃受到霉菌污染而变质的可能性比干制核桃更高[5],这大大降低了鲜食核桃的营养价值和市场价值。
黄曲霉菌(Aspergillusflavus)是一种真菌,它的重要代谢产物黄曲霉毒素(aflatoxin,AFT)因其致癌、致畸、致突变性,已成为国民健康的重要威胁。黄曲霉是自然环境中较为常见的霉菌,其孢子可扩散至空气传播[6],经常在种植、贮藏、加工和运输过程污染玉米、花生等富含脂肪酸的粮食及各类坚果[7-8],在适宜的环境条件下会产生多种次级代谢产物[9]。当前关于黄曲霉菌对花生、玉米等粮食产物的抗病性的研究及报道较多[10],但很少有学者研究黄曲霉菌对核桃侵染后的变化。故研究黄曲霉菌污染后鲜食核桃的某些生理代谢机制至关重要,可为进一步控制鲜食核桃采后病害提供科学依据。
在合适的生理条件下,植物体内活性氧的各种相关酶及其他水溶性、脂溶性的抗氧化剂等物质可形成自身抗氧化防御系统,使氧化性损伤与抗氧化防御系统处于一种动态平衡[11]。当外界环境发生变化时,会导致植物体内的动态平衡被破坏,活性氧累积会导致膜脂发生过氧化反应,不断攻击植物细胞,导致植物细胞膜发生不可逆损害,从而导致植物体受到伤害[12-13]。为从生理生化方面解释植物的抗性机理,近年来,人们越来越重视研究植物的抗病性与活性氧及细胞内保护酶系统的关系,先后发现黄瓜、水稻、小麦、玉米、茭白等多种植物受到病原微生物感染后,其体内活性氧代谢及防御酶系统的活性发生变化,并与植物的抗病性相关[14-15]。本研究以新疆薄皮鲜食核桃为试材,将黄曲霉菌接种于不同含水量的新疆薄皮鲜食核桃上,研究黄曲霉菌侵染采后新疆薄皮鲜食核桃的活性氧代谢,分析活性氧代谢关键酶活性变化规律,从活性氧的角度解释新疆薄皮鲜食核桃抵御病原菌侵染的作用机制,以期为黄曲霉菌侵染采后鲜食核桃发生病变的发生机理以及采后防病害、保鲜提供理论参考。
1 材料与方法
1.1 材料与试剂
鲜食核桃:来自于新疆阿克苏地区温宿县的“新2”薄皮核桃,采摘后在无菌条件下剥去青果皮和外壳,取无菌状态的新鲜核桃仁。黄曲霉菌:分离于自然霉变的核桃仁果实上,纯化后马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)保存。
冰乙酸、氢氧化钠、氨水、无水乙醇、无水乙酸钠、双氧水(均为分析纯):天津市致远化学试剂有限公司;α-萘胺、乙二胺四乙酸、乙二胺四乙酸二钠、还原型辅酶Ⅱ二钠、聚乙烯吡咯烷酮-K30、聚乙二醇辛基苯基醚、氯化硝基四氮唑蓝、氧化性谷胱甘肽(均为分析纯):上海生工生物工程技术服务有限公司。
1.2 仪器与设备
NBCJ-B 型无菌操作台、MHP-250 型恒温霉菌培养箱:上海鸿都电子科技有限公司;LDZX-50KBS 型立式压力蒸汽灭菌器:上海申安医疗器械厂;FA2104N型电子天平:上海民桥精密科学仪器有限公司;XHFDY 型高速分散器:宁波新芝生物科技股份有限公司;TGL-16G 型高速冷冻离心机:上海安亭科学仪器厂;TU-1810PC 型紫外-可见分光光度计:北京普析通用仪器有限公司;DHS-16 卤素水分测定仪:上海菁海仪器有限公司。
1.3 方法
1.3.1 新疆薄皮鲜食核桃仁预处理
对照组:随机抽取100 组鲜食核桃仁测量初始含水量后,根据初始含水量,采用烘干的方式,将核桃仁的含水量调整至30%、25%、20%、15%、10% 并置于4 ℃恒温冰箱24 h 使含水量平衡。将同一含水量的核桃仁分别称取20 g、3 组放入灭好菌的组培瓶中,作为平行样品。将称取好的不同含水量核桃仁接种0.4 mL无菌水。接种后放入(28±1)℃霉菌培养箱进行培养。培养至第3 天开始取样,每隔1 d 取样1 次,取至第15 天,用于后续测量指标。
试验组:测量鲜食核桃仁的初始含水量,根据初始含水量将核桃仁用烘干的方式,将核桃仁的含水量调整至30%、25%、20%、15%、10%,放入4 ℃恒温冰箱24 h 使水分平衡。将同一含水量的核桃仁分别称取20 g、3 组放入灭好菌的组培瓶中,作为平行样品。将称取好的不同含水量核桃仁接种0.4 mL、浓度为1.0×106cfu/mL 的黄曲霉菌孢子悬浮液。用移液枪接种后放入(28±1)℃霉菌培养箱进行培养。培养至第3 天开始取样,每隔1 d 取样1 次,取至第15 天,用于后续测量指标。
1.3.2 丙二醛和O2-产生速率的测定
丙二醛(malondialdehyde,MDA)含量:每克核桃仁样品中MDA 的含量,以µmol/g FW 表示,具体方法参考曹建康等[16]的测定方法。超氧阴离子产成速率的测定参考曹建康[16]等的测定方法。
1.3.3 活性氧代谢相关酶活性的测定
过氧化物酶(peroxidase,POD)活性、过氧化氢酶(catalase,CAT)活性、超氧化物歧化酶(superoxide dismutase,SOD)活性、抗坏血酸过氧化物酶(aseorbateperoxidase,APX)活性参考曹建康等[16]的方法进行测定。
1.3.4 还原型谷胱甘肽含量与谷胱甘肽还原酶活性测定
谷胱甘肽还原酶(glutathione reductase,GR)活性的测定参考曹建康等[16]的测定方法,还原型谷胱甘肽(glutathione,GSH)含量参考曹建康等[16]的方法测定。
1.4 数据统计与分析
采用Origin 2018b 64Bit 和IBM SPSS Statistics 25处理试验数据并作图,试验组均采用3 次试验,取平均值。
2 结果与分析
2.1 黄曲霉侵染对不同含水量的鲜食核桃仁丙二醛和超氧阴离子产成速率的影响
黄曲霉侵染不同含水量鲜食核桃仁后对MDA 含量的影响如表1 所示。
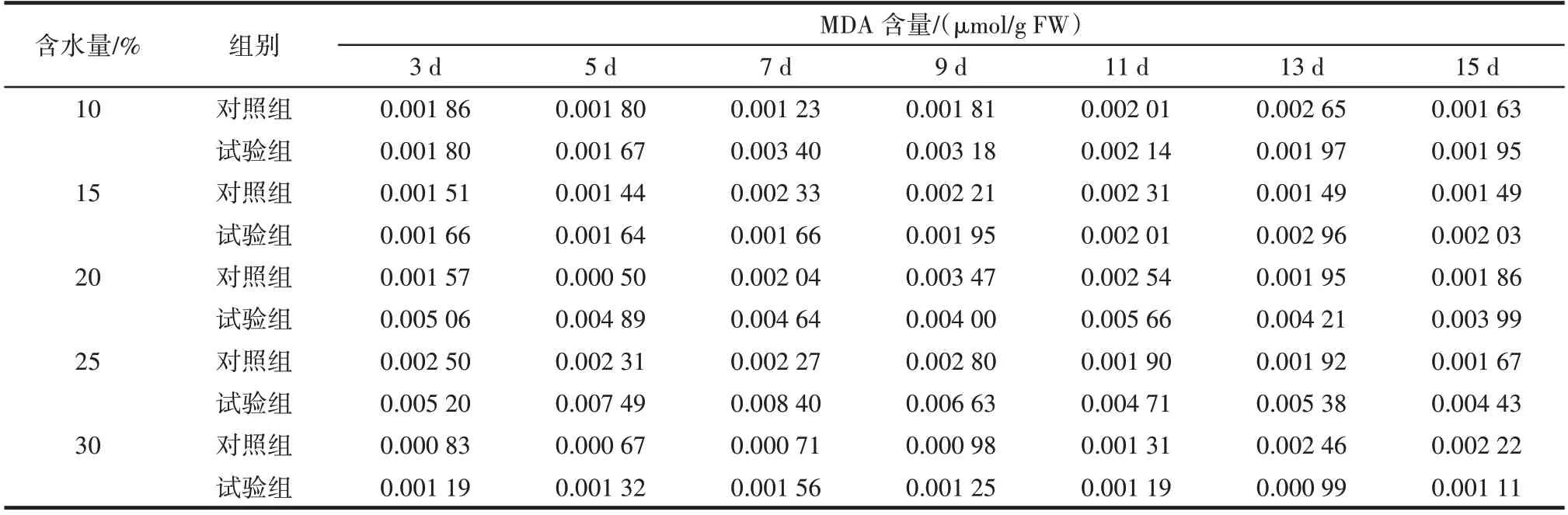
表1 黄曲霉侵染不同含水量鲜食核桃仁后对MDA 含量的影响Table 1 Effect of Aspergillus flavus on malondialdehyde(MDA)after infecting fresh walnut with different water content
由表1 可知,试验组中,含水量为10%、15%、30%的核桃仁随着侵染时间的延长,MDA 含量整体呈现先上升后下降的趋势,含水量20%的核桃仁随着侵染时间的延长MDA 含量出现先下降后上升最后下降的趋势,含水量为25% 的核桃仁随着侵染时间的延长MDA 含量变化趋势不明显。含水量10%的试验组在第7 天出现峰值,MDA 含量为0.003 40µmol/g FW。含水量15% 的试验组在第13 天出现峰值,为0.002 96µmol/g FW。含水量25%和30%的试验组变化趋势明显,均在第7 天出现峰值,MDA 含量为0.008 40µmol/g FW 和0.001 56µmol/g FW,分别是各对照组同一天MDA 含量的3.70 倍和2.20 倍。对比发现,含水量25%的试验组MDA 含量变化最明显。
黄曲霉侵染不同含水量鲜食核桃仁后对超氧阴离子产生速率的影响如表2 所示。
如表2 所示,不同含水量的核桃仁随着侵染时间的延长超氧阴离子产生速率整体呈现先上升后下降的趋势,且试验组不同含水量鲜食核桃仁的超氧阴离子产生速率均高于对照组。含水量10%和20%的试验组,均在第13 天出现峰值,超氧阴离子产生速率分别为43.79、57.19 nmol/(min·g FW),是侵染初期的2.31、5.53 倍,是各对照组同一天超氧阴离子产生速率的8.02 倍和11.30 倍。含水量15%、25%、30%的试验组均在第11 天出现峰值,超氧阴离子产生速率分别为50.95、89.23、58.70 nmol/(min·g FW),是侵染初期的2.01、4.40、3.51 倍,分别是各对照组同一天超氧阴离子产生速率的11.38、11.64、9.33 倍。综合对比发现,含水量25%的试验组超氧阴离子产生速率变化最明显。
2.2 黄曲霉侵染对不同含水量的鲜食核桃仁活性氧代谢相关酶活性的影响
黄曲霉侵染不同含水量鲜食核桃仁后对CAT 活性的影响如表3 所示。

表3 黄曲霉侵染不同含水量鲜食核桃仁后对CAT 活性的影响Table 3 Effect of Aspergillus flavus on catalase(CAT)after infecting fresh walnut with different water content
如表3 所示,不同含水量的核桃仁随着侵染时间的延长CAT 的活性整体上出现先上升后下降的趋势。说明核桃仁在受到黄曲霉侵染后,为保护自身,过氧化氢酶活性增强。但随着侵染时间延长,受到黄曲霉胁迫强度增强过氧化氢酶活性被抑制,呈逐渐下降趋势。试验组在9~13 d 时出现峰值,CAT 活性分别为32.48、38.67、49.11、133.00、50.89 U。根据CAT 活性峰值的不同,可以看出在核桃仁含水量为25% 时,CAT 活性达到最高,是含水量为10%的核桃仁峰值的4.09 倍,是其对照组在同一天的CAT 活性的5.44 倍。而且在侵染的第13 天出现最高值,说明25% 含水量的核桃仁受到病害的程度最大,抗病性也较强。
黄曲霉侵染不同含水量鲜食核桃仁后对POD 活性的影响如表4 所示。

表4 黄曲霉侵染不同含水量鲜食核桃仁后对POD 活性的影响Table 4 Effect of Aspergillus flavus on peroxidase(POD)after infecting fresh walnut with different water content
由表4 可知,不同含水量的核桃仁随着侵染时间的延长POD 活性整体呈现先上升后下降的趋势。含水量为10%的试验组在第9 天出现峰值,为0.068 33 U,是第9 天对照组的2.77 倍,含水量为15%的试验组在第7 天出现峰值,POD 活性为0.145 63 U,是第7 天对照组的6.24 倍,含水量为20% 和30% 的试验组均在第13 天出现峰值,POD 活性分别为0.186 83 U 和0.092 87 U,分别是对照组第13 天的9.92 倍和3.65 倍,含水量为25% 的试验组在第11 天出现峰值,POD 活性为0.277 93 U,是对照组第11 天的12.79 倍。含水量为25% 的核桃仁POD 活性明显高于其他含水量,与CAT 活性相同。POD 活性的增加是植物组织受逆性被激发的主要表现形式,说明含水量为25%的核桃仁本身抗病性能力较强。
黄曲霉侵染不同含水量鲜食核桃仁后对APX 活性的影响如表5 所示。

表5 黄曲霉侵染不同含水量鲜食核桃仁后对APX 活性的影响Table 5 Effect of Aspergillus flavus on ascorbate peroxidase(APX)after infecting fresh walnut with different water contentt
由表5 可知,试验组含水量10%、15%、20% 的核桃仁随着侵染时间的延长APX 活性整体呈现先上升再下降最后上升的趋势,含水量为25%、30% 的试验组随着侵染时间的延长APX 活性整体呈先上升后下降的趋势。含水量为10%和20%的试验组的APX 活性均在第7 天出现峰值,分别为100.50 U 和123.00 U,含水量为15% 的试验组的APX 活性在第13 天出现峰值,为128.56 U,含水量为25%的试验组的APX 活性在第11 天出现峰值,为140.26 U,其APX 活性最高,是对照组第13 天的4.08 倍,是侵染初期的4.27 倍。说明含水量为25%的鲜食核桃仁抗病性最强。
黄曲霉侵染不同含水量鲜食核桃仁后对SOD 活性的影响如表6 所示。

表6 黄曲霉侵染不同含水量鲜食核桃仁后对SOD 活性的影响Table 6 Effect of Aspergillus flavus on superoxide dismutase(SOD)after infecting fresh walnut with different water content
由表6 可知,不同含水量的核桃仁随着侵染时间的延长SOD 活性大致呈先上升后下降的趋势,且试验组不同含水量鲜食核桃仁的SOD 活性均高于对照组。含水量为10%、15%、20% 的试验组变化趋势平缓,分别在第11 天、第13 天、第13 天出现SOD 活性峰值,为10.43、11.64、14.83 U,与侵染初期相比分别为其1.13、1.34 倍和1.04 倍。含水量为25% 和30% 的试验组变化趋势较为明显,分别在第9 天和第13 天出现SOD 活性峰值,为14.41、13.78 U,是其侵染初期的1.08 倍和1.38 倍,是其对照组同一天SOD 活性的2.93 倍和2.74 倍。
2.3 黄曲霉侵染对不同含水量的鲜食核桃仁GSH 活性与GR 活性的影响
黄曲霉侵染对不同含水量的鲜食核桃仁GSH 活性的影响如表7 所示。

表7 黄曲霉侵染不同含水量鲜食核桃仁后对GSH 活性的影响Table 7 Effect of Aspergillus flavus on sglutathione(GSH)after infecting fresh walnut with different water content
由表7 可知,不同含水量的核桃仁随着侵染时间的延长GSH 活性呈先上升后下降的趋势。含水量为10%、15%、30% 的试验组均在第11 天出现峰值,GSH活性为569.16、847.85、867.56µmol/g FW,分别是侵染初期的1.53、2.70、1.43 倍,含水量为20%、25% 的试验组在第13 天出现峰值,GSH 活性为1 150.90、1 207.17µmol/g FW,分别是侵染初期的1.88、3.43 倍。含水量为25% 的试验组在第13 天的GSH 活性是培养同一天对照组的GSH 活性的4.71 倍。
黄曲霉侵染不同含水量鲜食核桃仁后对GR 活性的影响如表8 所示。
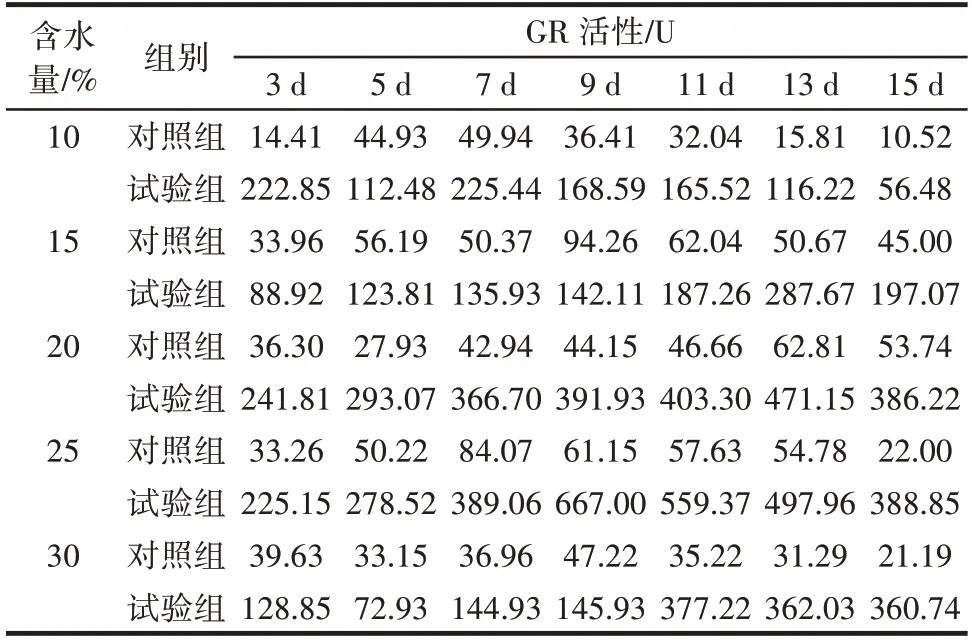
表8 黄曲霉侵染不同含水量鲜食核桃仁后对GR 活性的影响Table 8 Effect of Aspergillus flavus on gluathione reductase(GR)after infecting fresh walnut with different water content
由表8 可知,试验组含水量10%、30% 的核桃仁随着侵染时间的延长GR 活性出现先下降再上升最后下降的趋势,试验组含水量15%、20%、25% 的核桃仁随着侵染时间的延长GR 活性呈现先上升后下降的趋势,且试验组不同含水量鲜食核桃仁GR 活性均高于对照组。含水量10% 的试验组变化趋势不大,在第7 天出现峰值,GR 活性为225.44 U,与侵染初期相比增加了1.16%。含水量15%、20% 的试验组均在第13 天出现峰值,分别为287.67、471.15 U,是侵染初期的3.23、1.95 倍。含水量25% 和30% 的试验组变化趋势明显,分别在第9 天、第11 天出现峰值,GR 活性为667.00 U 和377.22 U,分别是各侵染初期的2.96 倍和2.93 倍,是各对照组同一天GR 活性的10.91 倍和10.71 倍。对比发现,含水量25% 的试验组GR 活性变化最明显。
3 讨论与结论
病原菌入侵会促使植物产生活性氧,破坏植物细胞壁进入内部细胞,造成细胞大量凋零、死亡,给植物带来不可逆的伤害[17]。但同时植物体也可以通过自身的酶促清除系统清除活性氧来减轻自身受到活性氧的伤害并适应不利的环境改变[18]。酶促清除系统在植物体内清除活性氧发挥着不可替代的角色,酶促清除系统中的酶系主要包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)、还原型谷胱甘肽(GSH)等[19]。
本文研究发现黄曲霉侵染新疆薄皮鲜食核桃仁时,CAT、POD、SOD 活性在各含水量都大致呈现先上升后下降的变化趋势。说明各含水量鲜食核桃体内因受到微生物胁迫发生了应激反应,触动了自身的抵御能力来消灭活性氧。但随着侵染时间的延长,各含水量鲜食核桃被黄曲霉侵染程度加深,核桃受损和衰老进程加速,这些酶的活性开始出现下降。当鲜食核桃仁含水量为25%时,这些抗氧化酶活性变化趋势最为明显,增加幅度最大,而且在侵染至9~13 d 时各种酶酶活性都出现了峰值。说明含水量25% 的鲜食核桃最易受到黄曲霉的侵染,造成鲜食核桃的果实的损伤和产业的损失。陈高等[19]研究黄曲霉侵染花生,发现POD 和CAT 活性先出现峰值后逐渐下降的情况。闫彩霞等[20]研究发现黄曲霉侵染花生后,随着侵染时间的延长,CAT 和POD 活性逐渐上升出现峰值后开始下降。吴媛媛等[21]研究发现蓝莓遭受到灰霉菌侵染后,短时间内这些抗氧化酶活性上升到峰值后逐渐下降。番茄受到病原菌的侵染后,一定时间内诱导CAT、POD、APX 和SOD 活性出现先上升后下降的趋势[22]。黄曲霉侵染不同含水量新疆薄皮鲜食核桃,试验组含水量10%、30% 的核桃仁随着培养时间的延长GR 活性呈现先下降后上升再下降的趋势,黄曲霉的生长对水分含量有一定的要求,这两个含水量GR 活性出现较大波动可能是因为鲜食核桃含水量过高或过于干燥,不利于黄曲霉的生长,侵染初期GR 活性出现了下降趋势,等到侵染中期,少量较为活跃的黄曲霉适应了环境开始缓慢生长,对鲜食核桃细胞壁造成伤害,产生活性氧,GR 活性出现了上升趋势;黄曲霉侵染不同含水量新疆薄皮鲜食核桃,GSH 活性均出现先上升到峰值后逐渐下降的趋势,而且试验组始终高于对照组。植物在受到微生物侵害时,植物表皮及细胞壁是抵抗病害菌的首道保护屏障。当植物感受到微生物的入侵时,产生活性氧,进而酶促清除系统开始工作,努力抵抗病原菌的伤害,所以在早期的入侵过程中能有效制止病原菌的伤害,酶促清除系统的关键酶活性也逐渐达到峰值。但随着病原微生物的大量繁殖,侵染程度加深,植物细胞大量凋亡,自身的抵抗能力减弱,抵抗活性氧的酶活性也会随之下降。刘馨怡等[23]研究发现,油梨受到油梨蒂腐病菌侵害时,第2 天GSH 含量上升到峰值后开始缓慢下降。王瑾等[24]研究发现,伽师瓜遭受到链格孢侵染时,GSH 活性在第15 天出现了峰值后开始下降;在黄曲霉侵染不同含水量的新疆薄皮鲜食核桃时,超氧阴离子产生速率均出现先上升到峰值后逐渐下降的趋势,而且试验组始终高于对照组。鲜食核桃受到黄曲霉胁迫的初期,超氧阴离子累积量缓慢增加。随着黄曲霉的生长繁殖侵染程度加深,超氧阴离子过度累积达到峰值,鲜食核桃细胞遭到破坏,病原菌大量入侵使鲜食核桃受损严重。超氧阴离子累积量下降。梁炫强等[25]在探究花生人工接种黄曲霉菌后活性氧代谢与抗病性的关系中发现,随着接种时间的加长花生的超氧阴离子产生速率呈出现峰值后缓慢下降的走向。裴冬丽等[26]研究发现给番茄接种枯萎菌后,超氧阴离子含量出现峰值后缓慢下降,且试验组的番茄超氧阴离子含量始终高于对照组;黄曲霉侵染试验组各含水量核桃仁随着培养时间的延长MDA 含量变化稍有差异,但整体呈现先逐渐上升直至出现峰值后再下降的趋势。黄曲霉接种到核桃仁上后,生长繁殖需要适应[27],生长较为缓慢,破坏核桃仁质膜的能力较弱,侵染中期黄曲霉适应了环境条件,大量繁殖后快速破坏核桃仁的质膜,使MDA 含量达到峰值。后期植物细胞死亡产生MDA 的量减少。丁玉梅等[28]把枯萎病菌接在南瓜上,测量丙二醛的含量与抗病性的关联性,发现丙二醛含量呈先上升再下降最后上升的趋向。
根据以上分析得出,不同含水量的鲜食核桃遭受到黄曲霉侵染后,在侵染前期,各含水量的鲜食核桃体内活性氧迅速累积,酶促清除系统被激活,不同的抗氧化酶为抵御病原微生物的侵染活性开始有明显的升高并达到峰值;黄曲霉侵染含水量25% 的鲜食核桃时,酶促清除系统的抗氧化酶活性相比于其他含水量的鲜食核桃都高。说明黄曲霉在含水量25% 的鲜食核桃上更易生长繁殖,破坏能力也更强;同时,含水量25%的鲜食核桃的抗逆性也较强,但随着侵染时间的延长,受到侵害的鲜食核桃组织大量死亡,酶促清除系统清除活性氧的能力减弱,受到侵染的鲜食核桃因为活性氧的大量积累细胞膜结构被破坏,加快了果实的老化、腐烂。
