陆地棉叶片干质量的发育遗传研究
2024-03-28宋佳何良荣郭伟锋胡守林陈含静曹新川
宋佳 何良荣 郭伟锋 胡守林 陈含静 曹新川

摘 要 采用基因型与环境互作的加性-显性-母体遗传的非条件与条件分析即ADM遗传模型,研究7个陆地棉亲本及21个正交F1代在3种密度 (2.4×105株/hm2、1.8×105株/hm2、1.2×105株/hm2)种植下,叶片干质量(LDW)发育遗传规律,探讨陆地棉叶片不同发育时期干质量、发育特征值与发育时间的关系,为优质亲本选育提供依据。结果表明:显性及其与环境互作效应存在于整个叶片干质量累积过程,在叶片不同发育时期或时段也存在较大的加性或母体效应影响,加性及母体与环境互作总体来说影响较小,叶片发育过程中以遗传主效应为主,而遗传主效应表达受环境调控较大;叶片干质量表现出明显杂种优势且易受环境条件影响的特点。不同发育时期或时段叶片干质量对最终叶片干物质的累积均有较大正向作用,但其遗传机制却各不相同。第20天、第30天对叶干质量具有较好选择效果。叶片干物质累积与叶片生长发育特点及亲本的选择有关,可根据各亲本的遗传效应预测值、环境稳定性进行陆地棉叶型育种。7个亲本中,大叶型育种时选择P5为亲本,小叶型育种时选择P2为亲本,以保证营养物质的有效储存与运输。
关键词 陆地棉;叶片干质量;ADM;发育遗传
棉花(Gossypium spp)是新疆主要的经济作物,近年来,棉花受自然环境影响,棉苗生长缓慢,甚至影响植株生长发育及产量形成[1-3]。叶片作为棉花机体与外界环境进行物质交换的营养器官,是表征植物资源利用、能量分配以及生长对策权衡的重要指标[4],直接影响后期营养物质运输以及植株生长发育。叶干质量作为叶片的重要指标,可同时反映植物光合能力和对土壤中水分以及营养物质的吸收能力[5],增大叶片生物累积量可提高资源的吸收和同化速率,使植株个体对不同生境形成较高适应性[6]。近年来,发育遗传模型已逐渐应用于油菜(Brassica napus L.)[7-9]、棉花[10-12]、水稻(Oryza sativa L.)[13-16]、小麦(Triticum aestivum L.)[17]等作物的数量性状发育遗传研究。叶片的发育是一个动态累积过程,前人多以叶片稳定时的表型值估算遗传效应值来反映众多基因在不同时期表达的综合效应,而对于发育过程的遗传效应变化涉及较少。因此,研究叶片的发育遗传将有助于了解叶片在不同发育时期中遗传变异的特异性,明确叶片干质量形成规律,对丰富叶片影响棉花产量形成具有重要指导意义。
本研究采用基因型与环境互作的加性-显 性-母体遗传的非条件与条件分析方法,研究棉叶干物质累积在整个叶片发育过程中遗传规律差异,了解不同发育时期,控制叶片发育基因所产生的各遗传主效应与环境互作效应对干质量的影响,同时预测亲本在叶片不同时期的遗传效应值,为棉花叶片干质量遗传育种提供一定理论依据。
1 材料与方法
1.1 材 料
本试验材料为7个亲本:新陆中37(P1)、99B/R9(P2)、新陆中51(P3)、德0905/R2//无号卡(P4)、德0905/R2(P5)、新宇7号/R6(P6)、德0905/R2//新宇7号/R6(P7),以Griffing-II方式配置杂交组合21个,于2021年4月13日将7个亲本及F1代种植于新疆阿拉尔市12团11连。试验小区行长4 m,行距配置为(10+66+10+ 66+10)cm。种植方式为人工点播。分别设置3种密度2.4×105株/hm2、1.8×105株/hm2、 1.2×105株/hm2,采用随机区组设计,设置2次重复。肥水管理同大田生产。
于5月31日在田间对刚展平的第4或5真叶挂线进行标记处理,并同时采集叶片,每个小区采6片叶,以后每隔5 d对标记叶片进行取样一次,直至叶形基本稳定为止(共采集7次)。每次将采集叶片置于105 ℃烘箱杀青30 min,然后调至80 ℃恒温24 h,待叶片烘干后进行叶干质量测量。
1.2 统计分析
采用ADM遗传模型的统计方法[20],分析第t时刻的平均叶干质量,非条件表型值可分解为:y(t)=μ(t)+A(t)+D(t)+M(t)+AE(t)+DE(t)+ME(t)+ε(t),式中μ(t)为第t时刻群体平均值,A(t)为第t时刻加性效应,D(t)为第t时刻显性效应,M(t)为第t时刻母体效应,AE(t)为第t时刻加性与环境互作效应,DE(t)为第t时刻显性与环境互作效应,ME(t)为第t时刻母体与环境互作效应,ε(t)为第t时刻随机机误。
t-1→t时段的条件表型值可分解为y(t-1→t)=μ(t-1→t)+A(t-1→t)+D(t-1→t)+M(t-1→t)+AE(t-1→t)+DE(t-1→t)+ME(t-1→t)+ε(t-1→t),运用无偏估算法估算方差分量,对不同时期及特征值的非条件与条件的遗传相关性进行分析,并预测各亲本遗传效应值。运用Jackknife计算相关系数估计值及标准误并进行t测验[21]。采用朱军教授提供的QGA Station软件运算数据,整理结果并进行制图[22]。
2 结果与分析
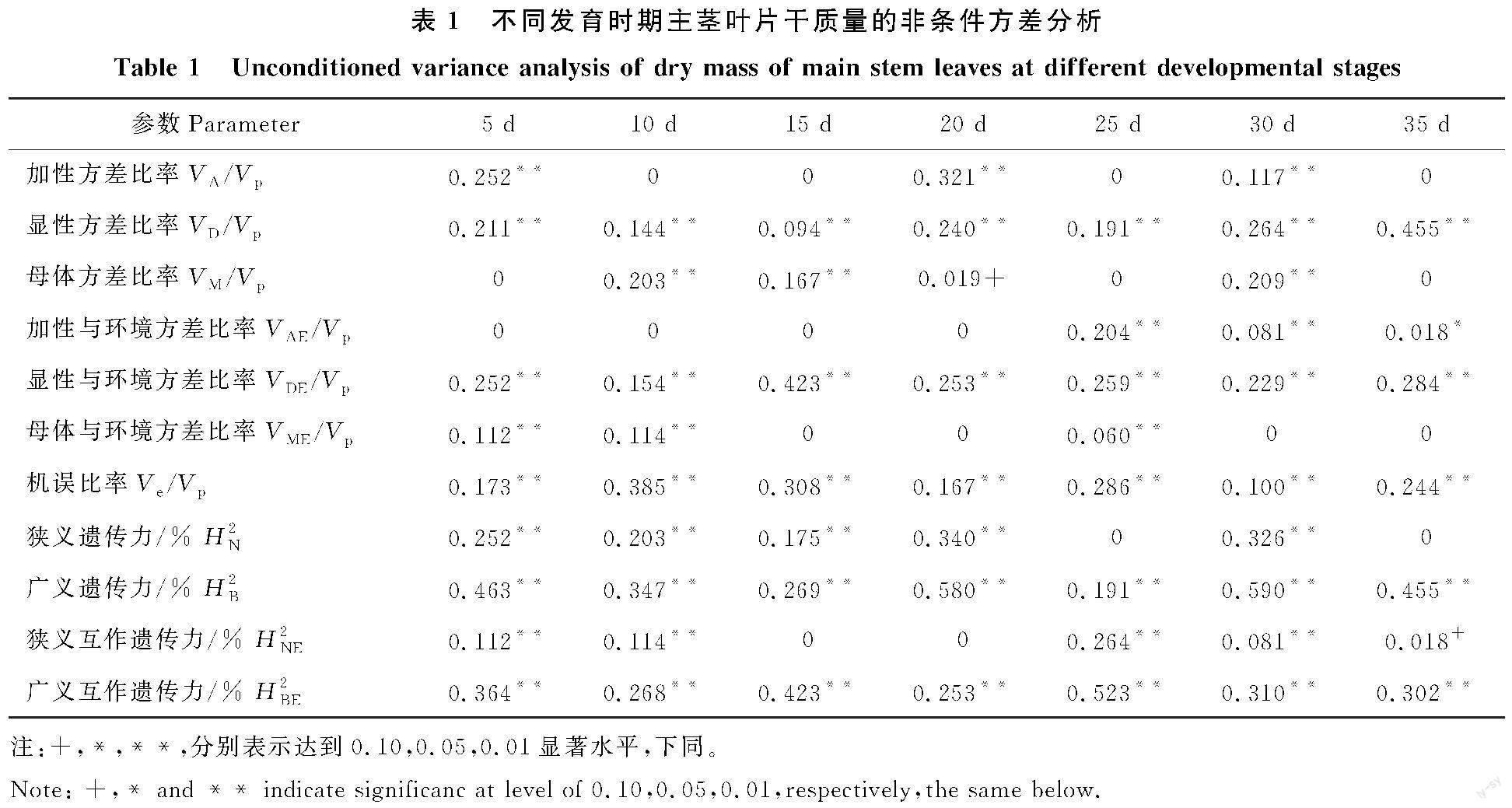
2.1 陆地棉主茎叶不同发育时期叶片干质量的非条件和条件方差分析
2.1.1 非条件方差分析 非条件遗传方法可分析不同发育时期主茎叶片干质量的遗传效应随发育时间的变化进程(表1),从表中可看出,叶片干质量在整个发育时期均存在极显著显性方差,且在第35天最大(占总变异的45.5%);在第5、20、30天检测到极显著加性方差,其占表现方差比例分别为25.2%、32.1%、11.7%,变化趋势存在较大波动;在第10、15、20、30天检测到显著或极显著母体方差,其在第30天所占比例最大 (20.9%)。与环境互作效应中,第25、30和35天检测到加性与环境互作方差,且呈下降趋势,表明加性效应受环境影响越来越小;整个时期均存在显性与环境互作方差,其中第15天最大(占总变异的42.3%)。第5、10和25天检测到母体与环境互作方差,其中第5天、第10天所占比例较大,因此在适宜环境条件下母体基因型的表达对早期叶片干质量发育影响较大。第5天遗传主效应占46.3%,遗传与环境互作效应占36.4%,第10天分别为34.7%和 26.8%,第15天分别为26.9%和42.3%,第20天分别为58.0%和25.3%,第25天分别为19.1%和52.3%,第30天分别为59.0%和 31.0%,第35天为45.5%和30.2%,表明叶片干物质累积早期(第5、10天)、晚期(第30、35天)主要受遗传主效应影响,而遗传主效应表达受环境调控较大;经分析遗传率发现,在第20天、第30天对叶干質量具有较好的选择效果。
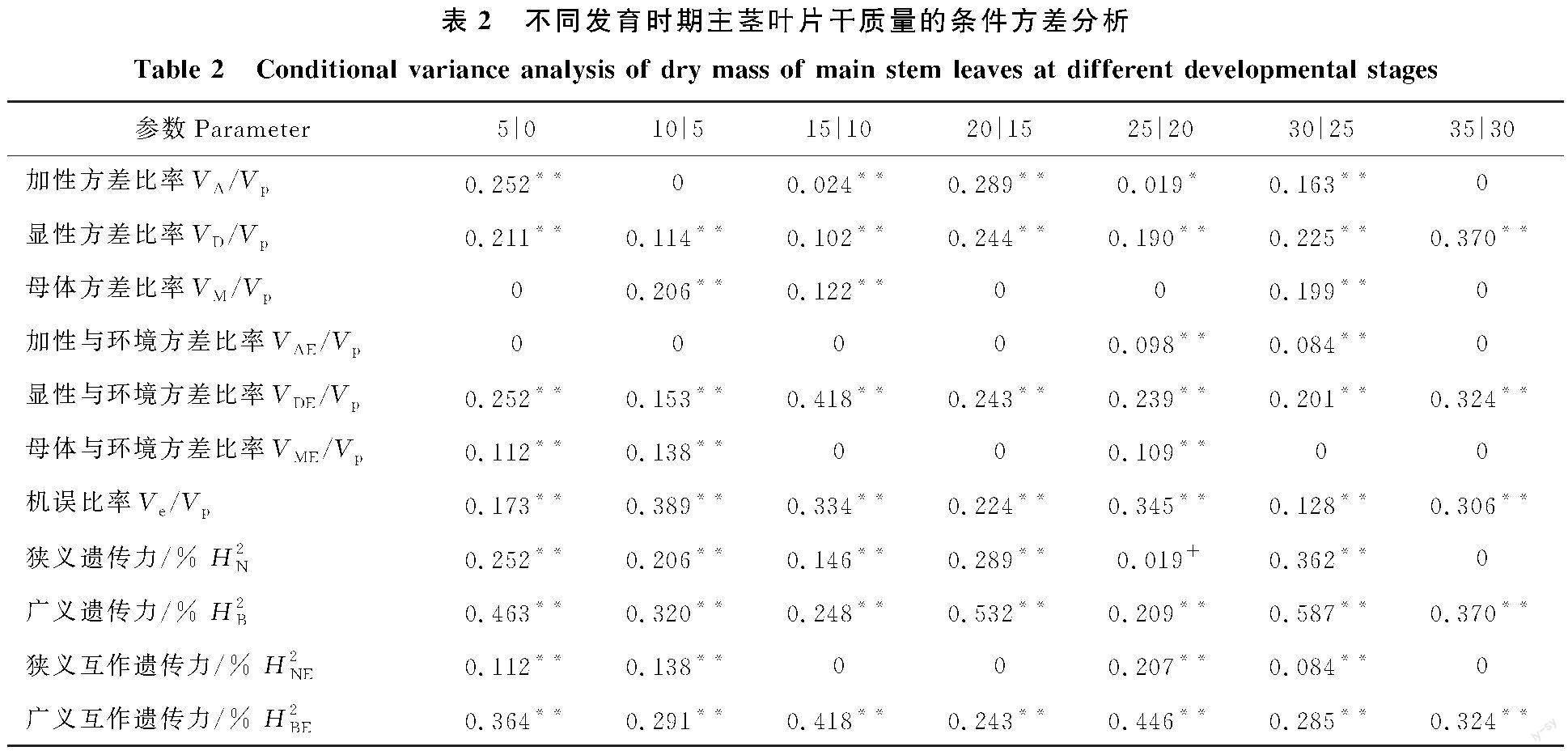
2.1.2 条件方差分析 条件方差代表性状在某一时间段(t-1→t)的净遗传效应,可以有效解释不同发育时期遗传效应的动态变化(表2)。在主茎叶干物质重发育的第5~10天、第30~35天未检测到条件加性方差,其余发育时段均存在显著或极显著基因加性效应,且在第0~5天、第15~20天、第 25~30天占较大比重;在第5~10天、第10~15天、第25~30天这几个时段检测到极显著母体效应,且这几个时段均发挥较大作用;叶片发育整个时期各时段均存在显著条件显性方差。基因型与环境互作效应的条件遗传方差分析表明,在主茎叶干物质重发育的第20~25天、 25~30天这两个时段存在极显著的加性与环境互作方差,但其所占比重不大;条件显性与环境互作方差在整个发育时期各时段均存在,表明基因显性效应表达容易受到环境条件变化影响。第 0~5天、第5~10天和第20~25天存在极显著的母体与环境互作方差,可通过母本选择或叶片生长环境的调控影响叶片干物质累积,环境虽会影响中期叶片干质量,但不是决定最终叶片干质量的主要因素。主茎叶各发育时刻的机误方差均达极显著水平,说明环境对叶片发育有着重要的影响。因此主茎叶干物质的累积表现主要受制于基因主效应和环境互作效应,且在大多数时段主要受条件遗传主效应影响;同时条件方差检验结果要早于非条件方法检测结果。
2.2 主茎叶片干质量不同发育阶段非条件和条件及发育特征值的相关性分析
2.2.1 非条件相关性分析 图1表明,第5天叶干质量与30、35天呈显著遗传和表型正相关,其主要受显性及其与环境互作影响,此外第30天还受加性影响,但不受加性与环境互作影响,表明环境条件的变化会影响部分基因表达,改变棉花叶片干质量。第10天叶干质量与第15、20、30天呈显著或极显著正向遗传和表型相关,且主要受母体基因影响,适宜的母本对叶片发育有较大影响。第15天叶干质量与第20、25、30、35天,第20天叶干质量与第25、30、35天均呈极显著的遗传和表型相关,且为正向相关,其主要受显性、显性与环境互作影响,此外第15和第20天还对30天存在加性和母体影响。第25天叶干质量与第30、35天,第30天叶干质量与第35天均呈极显著的遗传和表型相关,且均受显性、加性与环境互作、显性与环境互作影响。综上,不同发育时期控制叶片干质量的遗传效应表达存在较大差异,即可利用加性相关对叶干质量进行间接选择,又可通过母本的选用实现叶片干质量的改良;同时,叶片发育也可利用杂种优势和环境条件变化改变叶片干质量。
2.2.2 条件相关性分析 由图2可知,第5天叶干质量与第25~30、30~35天存在极显著正向表型和遗传相关,且均受显性影响,此外第25~30天还存在加性影响,第30~35天存在显性与环境互作影响。第10天叶干质量与第15~20、20~25和 25~30天存在遗传和表型相关,第20~25天受母体与环境互作影响,第25~30受母体、显性与环境互作影响。第15天叶干质量与第15~20、 20~25和25~30天均受显性及其与环境互作影响。第20天叶干质量与第25~30天存在正向表型相关,主要受加性、显性与环境互作影响。第25天叶干质量与第25~30天受负向显性与环境互作影响。综合来看,显性相关、显性与环境互作相关对叶片干质量整个发育阶段均存在影响,前期影响较小,后期影响较大。
2.2.3 干质量与发育特征值的相关分析 由图3可知,第5天叶干质量与t1、△t、Gt存在显著或极显著正向遗传和表型相关,表明进入快增期时间较晚,维持时间越长,干质量最终累积量越大。第10天叶干质量与Vm存在极显著母体与环境互作影响,t2、△t存在表型相关,主要受母体与环境互作影响,可通过亲本和环境来改变最大累积速率和快增期的持续时间,提高光合产物,进而增加叶片累积量。第15天叶干质量与△t存在正向母体影响,Gt存在显性与环境互作影响,表明在第15天可通过母体来改变叶片发育时间,筛选出杂种优势较好的亲本和环境来增加快增期干物质的累积量。第20天叶干质量与t2和△t存在显著的负向遗传和表型相关,t2和△t越大,叶片干质量累积量越小;与Gt存在正向极显著加性影响,由此可通过遗传改良改变快增期叶片累积量。第25天叶干质量与t1和Gt存在正向基因型和表型相关,且均受显性及其与环境互作影响,可利用杂种优势和环境来筛选叶片进入快增期时间和最大累积量,与Vm和△t存在正向和负向的表型相关,表明最大累积速率和累积时间的同时改良较难。第30天叶干质量与Gt存在正向加性和母体相关,表明可通过间接选择改良快增期干物质累积量。第35天叶干质量与t0、t1、t2、△t存在极显著表型效应,主要受显性、显性与环境互作影响,表明第35天对叶片干质量有较好的杂种优势表现。综上,不同发育时期叶片干质量与其生长发育特点存在密切的联系;叶干质量除与亲本的选择有关,对叶片最终累积量有较好的选择效果,也表现出明显的杂种优势和受环境条件的影响。[FL)]
2.3 各亲本不同发育阶段干质量的非条件与条件及发育特征值的遗传效应预测值
2.3.1 非条件遗传效应预测值 陆地棉叶片干质量不同时期的遗传效应预测值见图4,分析第5天的亲本遗传效应总和(Gt1=A+AE1+M+ME1,Gt2=A+AE2+M+ME2,Gt3=A+AE3+M+ME3)发现亲本P1和P3可以明显减少第5天干质量的遗传效应(Gt1分别-0.000 85和-0.001 17,Gt2分别为-0.000 31和 -0.001 46,Gt3分别为 -0.000 36和 -0.000 81),P6可以明显增加后代第5天的遗传效应。第10天P1、P2、P3、P4、P6在第10天均对其杂种后代具有减效作用,且主要受母体效应影响。第15天和第20天主要受加性和母体效应影响,故在3种环境中的遗传效应总和均相等,其中第15天,P1、P2和P5為明显增效,且Gt1=Gt2=Gt3(分别为 0.012 68、 0.029 03和0.020 82);在第20天,P1、P4、P5和P7表现为明显的增效作用。第25天主要受加性与环境互作、母体与环境互作效应影响,且同一亲本在不同环境中的遗传效应值不同,如在1.8×105株/hm2中,亲本P4、P6和P7为增效作用,在2.4×105株/hm2为减效。第30天只检测到加性及其与环境互作效应,P5为明显增效作用(Gt1为0.044 55,Gt2为 0.081 84, Gt3为0.074 94),P1和P4为减效作用,其中P1在2.4×105 株/hm2中最明显为 -0.064 06,P4在1.2×105株/hm2最明显,为 -0.081 50。第35天只检测到加性与环境互作效应,且在1.8×105 株/hm2中各亲本增效作用较多。分析不同时间各亲本干质量效应预测值发现,P5除第25天存在负向遗传效应预测值外均为正值,可应用于叶片非条件遗传的筛选。部分遗传效应会随环境的变化而发生相应的改变,在育种工作中应注意环境对遗传效应的影响。
2.3.2 条件遗传效应预测值 由图5可知,第 0~5天时,P4、P5、P6和P7在1.8×105株/hm2密度下遗传效应为正值,其中P5增值效应最大,为0.002 49。第5~10天时,P5、P6和P7在 2.4×105株/hm2时的遗传效应预测值为正值,其中P5遗传效应最大,且在1.8×105株/hm2和1.2×105株/hm2中均为正向遗传效应。第10~15天亲本遗传效应预测值只检测到加性效应和母体效应,P4、P5、P6和P7遗传效应总和为负值,且P5在3种环境中的遗传效应均最小。15~20天亲本遗传效应均为加性遗传,故亲本的遗传效应总和不随环境变化而变化,其中P1、P4、P5和P7的亲本遗传效应总和为正值,P7遗传效应预测值总和最大为 0.039 87,P5的遗传效应预测值最小为 0.001 79。第20~25天时,在1.8×105株/hm2密度中亲本遗传效应预测正值较多,分别为P1、P3、P6和P7。在第25~30天时, P5在3种环境中预测值均为正值,且在1.8×105 株/hm2中预测值達到最大。P5除第10~15天外在3种环境中均为负值,其余在3种环境中均为正值,条件遗传预测值较好,可用于叶片干质量的筛选。
2.3.3 各亲本发育特征值的遗传效应预测值 叶片干质量生长特征值遗传效应预测见图6。t0、t1和t2受母体、母体与环境互作影响,且P3和P6在3种环境中的遗传效应预测值均为正值,其中P6增效较明显,进入快增期的时间较早,P2为减效作用,出现最大累积速率时间和结束快增期均较晚。Vm只受母体与环境互作影响,且遗传效应不同,在2.4×105株/hm2和1.8×105 株/hm2中,正向遗传预测值较多。P2、P4和P7在3种环境中对△t存在减效作用(Gt1分别为 -0.089 82、-1.576 94和-0.668 11,Gt2分别为-0.018 74、-0.884 74和-0.744 16,Gt3分别为-0.419 96、-0.983 89和-0.327 84),明显减少叶片干质量增长时间。P6对Gt有明显增效作用,P2为减效。因此P6在3种环境中除Vm均为增效作用,t0、t1、t2和△t在1.2×105 株/hm2中表现出最大的增效作用,Vm在1.8×105株/hm2中为最大增效作用,Gt在2.4×105株/hm2中为最大增效;P2除t1和Gt外在 1.2×105株/hm2中均存在最大减效作用。表明环境的变化会影响发育特征值的遗传效应,适宜的环境将有助于叶片的发育。[FL)]
3 讨 论
3.1 利用非条件和条件方差分析不同发育时期叶片干质量
非条件方差可反映整个发育时期全部遗传效应表达的综合或累加效应,条件方差可具体揭示各时间段数量基因的开启和关闭情况,更准确的获得各时期净遗传效应以及不同发育时期基因的表达和遗传效应的变化过程[20,22]。多位学者发现,叶片干质量不仅能反映单位面积光合产物的积累还能反映植物叶片对资源的利用率和对环境的适应性[23-24]。
经非条件方差可知,陆地棉叶片干质量在发育前期(5 d、10 d)主要受显性、显性与环境和母体与环境互作影响,中期(15 d、20 d、25 d)主要受加性、显性、母体、显性与环境互作影响,在后期(30 d、35 d)主要受显性、加性与环境、显性与环境互作影响。经条件方差可知,第0~5、5~10天主要受显性、显性与环境和母体与环境互作影响,第10~15、15~20、20~25天主要受加性、显性、显性与环境互作影响,第25~30、30~35天主要受到显性、显性与环境互作影响。综上所述,显性及其与环境互作影响着叶片干质量发育过程,可利用杂种优势改变叶片性状,这与何从利[25]、莫泽军等[26]的研究结果一致。
3.2 非条件、条件及发育特征值相关性分析
采用非条件和条件数量遗传两种方法,分析在不同环境下叶片干质量某一发育时间(0-t)或某一段特定发育时间(t-1→t)中不同遗传效应表达对叶片干质量发育的影响。非条件方差相关性分析结果表明,基因型相关和表型相关以遗传主效应为主;条件方差相关性分析揭示不同的发育阶段基因的表达情况[27],大部分第15~20、 20~25和25~30天受到显著的基因型和表型相关;各时期对生长效应值多数为基因型相关,因此可通过改变基因型改变相关系数。
3.3 非条件、条件及发育特征值遗传效应预测值分析
根据各亲本不同遗传效应预测值,可以了解各遗传效应在杂种后代叶片干质量不同发育时期不同环境表现中的作用大小和各亲本品种(系)潜在育种价值,为优化杂交配组中亲本选配提供依据[28]。根据最终叶片重估算的亲本遗传效应值与前几个时间段估算的遗传效应预测值差异,个别亲本会出现前期某一发育阶段遗传效应值为负值(或正值)最后遗传效应表现为正值(或负值)的现象,表明仅利用最终表型值进行遗传分析无法代表整个数量性状发育阶段各个时期基因表达的遗传效应差异。本研究叶片干质量在3种密度下亲本遗传预测值存在差异,其中P5为大叶型育种材料,P2为小叶型育种材料。
本试验以7个亲本及21个正交组合为材料,设置3个密度,分析陆地棉不同时间及生长效应值与不同发育时间的关系,所得结论如下:(1)叶片的发育受显性及其与环境互作影响,在叶片不同发育时期或时段也存在较大的加性或母体效应的影响,加性及母体与环境互作总体来说影响较小;(2)不同时期的相关性以遗传主效应相关为主,而遗传主效应的表达受环境调控较大;(3)不同亲本遗传效应预测值不同。综上,叶片发育会因生理变化而改变叶片干质量,也会因所处环境不同,其基因表达也存在差异;根据本试验中各亲本的预测值,可以选择遗传主效应表现良好且在不同环境中互作效应表现较稳定的P5为大叶型育种材料,P2为小叶型育种材料,以期保证营养物质的储存,为后期生长发育奠定基础,提高棉花产量及品质。
参考文献 Reference:
[1] 傅玮东.终霜和春季低温冷害对新疆棉花播种期的影响[J].干旱区资源与环境,2001(2):38-43.
FU W D.The influence of latest frost and microthermal damage in spring on the cotton's seeding time[J].Journal of Arid Land Resources and Environment,2001(2):38-43.
[2] 赖先齐,刘月兰,徐腊梅,等.北疆棉区棉花低温冷害的初步分析及对策探讨[J].新疆农业科学,2008(5):782-786.
LAI X Q,LIU Y L,XU L M,et al.Preliminary analysis and countermeasures of chilling damage to cotton in the northern of Xinjiang[J].Xinjiang Agricultural Sciences,2008(5):782-786.
[3] 李防洲,辛慧慧,周廣威,等.水杨酸包衣剂包衣棉种对棉花幼苗抗寒性的影响[J].棉花学报,2015,27(6):589-594.
LI F ZH,XIN H H,ZHOU G W,et al.Effects of the seed film coating salicylic acid on the chilling tolerance of cotton seedlings[J].Cotton Science,2015,27(6):589-594.
[4] WANG H,CHEN H.Plant functional groups based on vegetative and reproductive traits in a subtropical forest community[J].Journal of Forest Research,2013,18(6):482-490.
[5] 黎 磊,周道玮,盛连喜.植物种群自疏过程中构件生物量与密度的关系[J].生态学报,2012,32(13):3987-3997.
LI L,ZHOU D W,SHENG L X.Allometric relationship between mean component biomass and density during the course of self-thinning for Fagopyrum esculentum populations[J].Acta Ecologica Sinica,2012,32(13):3987-3997.
[6] 党晶晶,赵成章,李 钰,等.高寒草地甘肃臭草茎-叶性状的坡度差异性[J].植物生态学报,2014,38(12):1307-1314.
DANG J J,ZHAO CH ZH,LI Y,et al.Variations with slope in stem and leaf traits of Melica przewalskyi in alpine grassland[J].Chinese Journal of Plant Ecology,2014,38(12):1307-1314.
[7] 蒋玉蓉,陈国林.不同环境下油菜籽饼粕甘氨酸含量的发育遗传机理研究[J].浙江农业学报,2011,23(3):446-454.
JIANG Y R,CHEN G L.Studies on developmental genetic mechanisms of glycine content of rapeseed meal(Brassic napus L.) in different environments[J].Acta Agriculturae Zhejiangensis,2011,23(3):446-454.
[8] 张 莉,吴建国,Variath M T,等.不同环境条件下油菜籽饼粕蛋白质含量的发育遗传研究[J].中国粮油学报,2010,25(9):45-51,56.
ZHANG L,WU J G,VARIATH M T,et al.Developmental genetics analysis for protein content of rapeseed meal in different environments[J].Journal of the Chinese Cereals and Oils Association,2010,25(9):45-51,56.
[9] 李云侠,Variath Murali-Tottekkaad,吴建国,等.甘蓝型油菜不同发育时期角果重量的遗传分析[J].浙江大学学报(农业与生命科学版),2009,35(1):45-50.
LI Y X,VARIATH MURALI-TOTTEKKAAD,WU J G,et al.Genetic analysis for pod weight at different developmental stages in Brassica napus L.[J].Journal of Zhejiang University (Agriculture and Life Sciences),2009,35(1):45-50.
[10] 莫旺成,汤飞宇,肖文俊.高品质陆地棉铃-叶系统干物质质量的发育遗传研究[J].棉花学报,2012,24(2):140-146.
MO W CH,TANG F Y,XIAO W J.Developmental genetics analysis of dry matter weight of boll-leaf system in upland cotton cultivar with high fiber quality[J].Cotton Science,2012,24(2):140-146.
[11] 郭伟锋,曹新川,胡守林,等.海岛棉单株成铃性状的发育遗传研究[J].棉花学报,2010,22(1):83-88.
GUO W F,CAO X CH,HU SH L,et al.Genetic analysis for developmental behavior of boll number per plant in island cotton[J].Cotton Science,2010,22(1):83-88.
[12] 曹新川,胡守林,韩秀锋,等.海岛棉棉铃阶段性发育与产量品质的关系[J].作物学报,2020,46(2):300-306.
CAO X CH,HU SH L,HAN X F,et al.Relationship of stage development of cotton bolls with yield and qualityin island cotton[J].Acta Agronomica Sinica,2020,46(2):300-306.
[13] 吴志源.水稻大粒种质谷粒重的发育遗传研究[D].福州:福建农林大学,2011.
WU ZH Y.Developmental genetics analysis of grain weight in big-grain germplasm of rice(Oryza sativa L.)[D].Fuzhou:Fujian Agriculture and Forestry University,2011.
[14] 彭 涛,钟秉强,凌英华,等.不同环境条件下籼型杂交稻株高的发育遗传研究[J].中国水稻科学,2008(2):148-154.
PENG T,ZHONG B Q,LING Y H,et al.Developmental genetic analysis for plant height in indica hybrid rice across environmental[J].Chinese Journal of Rice Science,2008(2):148-154.
[15] SHI C H,WU J G,LOU X B,et al.Genetic analysis of transparency and chalkiness area at different filling stages of rice (Oryza sativa L.)[J].Field Crops Research,2002,76(1):1-9.
[16] SHI C H,WU J G,ZHANG X M,et al.Developmental analysis on genetic behavior of brown rice recovery in indica rice across environments[J].Plant Science,2002,163(3):555-561.
[17] 龐红喜.穗重型小麦发育特性及穗粒重性状的遗传模型研究[D].陕西杨凌:西北农林科技大学,2012.
PANG H X.Studies on development characteristics and genetic models traits in high spike weight wheat[D].Yangling Shaanxi:Northwest A&F University,2012.
[18] 周可金,裴训武,江厚旺,等.不同开花期棉铃干物质积累规律研究[J].棉花学报,1996(3):145-150.
ZHOU K J,PEI X W,JIANG H W,et al.Studies on the dynamics of dry matter accumulation law of cotton boll at different flower stages[J].Cotton Science,1996(3):145-150.
[19] LEFFLER H R,HUNTER J H.Reproductive development and seed quality of cotton cultivars as affected by nitrogen fertilization[J].Field Crops Research,1985,10:219-228.
[20] 朱 军.遗传模型分析方法[M].北京:中国农业出版社,1997.
ZHU J.Analysis Methods for Genetic Model [M].Beijing:China Agriculture Press,1997.
[21] ZHU J.Analysis of conditional genetic effects and variance components in developmental genetics[J].Genetics,1995,141(4):1633-1639.
[22] 朱 军.数量性状遗传分析的新方法及其在育种中的应用[J].浙江大学学报(农业与生命科学版),2000(1):3-8.
ZHU J.New a approaches of genetic analysis for quantitative traits and their applications in breeding[J].Journal of Zhejiang University (Agriculture & Life Sciences),2000(1):3-8.
[23] WESTOBY M,FALSTER D S,MOLES A T,et al.Plant ecological strategies:some leading dimensions of variation between species[J].Annual Review of Ecology and Systematics,2002,33(1):125-159.
[24] WRIGHT I J,REICH P B,WESTOBY M,et al.The worldwide leaf economics spectrum[J].Nature,2004,428(6985):821-827.
[25] 何從利.烤烟主要农艺及化学品质性状的杂种优势与相关性分析[D].重庆:西南大学,2013.
HE C L.The analysis of heterosis and correlation on main agronomic traits and chemical qualities of flue-cured tobacco[D].Chongqing:Southwest University,2013.
[26] 莫泽君,娄晓平,孟 军,等.烤烟上部叶叶面积相关性状的遗传及杂种优势分析[J].南方农业学报,2020,51(6):1325-1331.
MO Z J,LOU X P,MENG J,et al.Genetic and heterosis analysis of leaf area related traits in upper leaf of flue-cured tobacco[J].Journal of Southern Agriculture,2020,51(6):1325-1331.
[27] 赵延明,董树亭,严 敏,等.玉米叶片叶绿素含量的发育遗传动态及环境互作效应分析[J].中国生态农业学报,2008(3):649-654.
ZHAO Y M,DONG SH T,YAN M,et al.Developmental genetic of leaf chlorophyll and genotype-environment interaction in maize[J].Chinese Journal of Eco-Agriculture,2008(3):649-654.
[28] 李 蒙.海岛棉氮效率的发育遗传研究[D].新疆阿拉尔:塔里木大学,2015.
LI M.Developmental genetics on nitrogen use efficiency in island cotton[D].Alar Xinjiang:Tarim University,2015.
Study on Developmental Genetic of Leaf Dry Mass of Upland Cotton
Abstract To investigate the relationship between dry mass,developmental characteristics values,and developmental time of land cotton leaves at different developmental periods,and to select high quality parents,the ADM developmental genetic model of genotype-environment interaction was used to study the developmental genetic pattern of seven upland cotton parents and 21 orthologous F1 generations at three densities of 2.4×105 plants/hm2,1.8×105 plants/hm2 and 1.2×105 plants/hm2. The results showed that dominant effect and its interaction with environment directly affected the whole process of leaf dry mass accumulation,the leaf dry mass had the obvious heterosis and was easily affected by environmental conditions through variance analysis,and there was also greater additive or maternal effects in different developmental periods or time of the leaves,the additive-environment interactions and maternal-environment interactions were generally less affected,and the genetic main effect was dominant in the leaf development process,while the expression of the genetic main effect was regulated by the environment; the leaf dry mass had obvious heterozygous and was easily affected by the environmental conditions. The leaf dry mass at different developmental periods or time had a large positive effect on the accumulation of final leaf dry matter,but the genetic mechanisms were different. Day 20 and 30 had better effect on selection of the leaf dry mass.The leaf dry matter accumulation was related to the leaf growth and development characteristics and the selection of parents,the breeding of the land cotton leaf type could be carried out according to the predicted value of genetic effect and environmental stability of each parent. Among the seven parents,P5 was selected as the parent for breeding large leaf types,and P2 was selected for breeding small leaf types, thus ensuring efficient storage and transport of nutrients.
Key words Upland cotton; Leaf dry mass; ADM; Developmental genetics
