基于门脉高压症血流动力学特征的Hassab手术疗效研究
2024-03-26叶德强曹涌高华毛卫谢能文邢毅焦磊明黄义华袁航杜小军
叶德强,曹涌,高华,毛卫,谢能文,邢毅,焦磊明,黄义华,袁航,杜小军
南昌市第九医院普外科,江西 南昌 330002
在临床实践中经常可以发现,一些慢性病毒性肝炎病人尽管抗病毒治疗确切有效,但肝硬化却仍在缓慢进展,有些病人逐渐出现脾肿大、脾功能亢进、胃底食管静脉曲张甚至破裂出血;此外,部分病人甚至逐渐发展为慢性肝衰竭。这些病人通常伴有部分肝功能指标的轻度异常,如胆红素和(或)转氨酶轻度升高、白蛋白轻度降低等。然而,这些病人在实施了脾切除和贲门周围血管离断术(Hassab手术)之后,肝功能各项指标却完全恢复了正常。曾有学者对此进行研究,认为这是由于肿大的脾脏产生了一些细胞因子促进肝纤维化,亦有一些学者用血流动力学改变来解释这一现象,但始终未能达成共识。21 世纪初,众多国内外学者观察到,原位肝移植术后部分病人肝动脉灌注量明显不足,导致移植肝缺血缺氧,胆管上皮和肝细胞受损,最终导致移植肝功能丧失[1]。这种现象被命名为脾动脉盗血综合征(splenic artery steal syndrome,SASS)[2]。早期几乎所有SASS 的临床诊治都是针对肝移植术后病人的,而肝硬化病人的SASS 一直存在争议,相关研究也很少。
自2019 年以来,我们将“肝硬化性脾动脉盗血综合征(cirrhotic SASS,cSASS)”的概念引入临床实践并用于研究失代偿期肝硬化病人。根据SASS的诊断标准,我们对即将接受Hassab 手术的肝硬化门脉高压症和脾功能亢进病人进行了重新评估和筛选,发现几乎所有的肝硬化失代偿期病人均存在不同程度的cSASS,只是严重程度有所不同,而在实施了Hassab 手术之后,这些病人的肝功能和血流动力学指标均可以得到不同程度的改善。本文就Hassab 手术对肝动脉血流动力学的改善情况进行回顾性研究。
资料与方法
一、一般资料
选择2020年1月至2022年12月于我院普外科接受Hassab手术治疗的97例乙型肝炎肝硬化门脉高压症并脾功能亢进病人,其中男性62例,女性35例,年龄32~69 岁,体重52~86 kg。依据SASS 诊断标准进行分组,其中有40 例(男性28 例、女性12 例)符合SASS诊断标准,脾动脉直径明显较肝总动脉粗大,脾动脉直径大于肝总动脉直径1.5倍(图1、图2),被分配到SASS组;其余57例(男性34例、女性23例)设为对照组。所有病例术前Child-Turcotte-Pugh(CTP)分级为A级或B级,美国麻醉医师协会(ASA)分级Ⅰ级或Ⅱ级,所有病例均接受了开放性Hassab手术。所有病人均由临床医师履行术前告知义务并签署了手术知情同意书。本研究经南昌市第九医院医学伦理委员会审查批准[批件编号:〔2022〕伦审字(25)号]。

图1 Hassab 手术前CT 可见脾动脉直径明显较肝总动脉粗大

图2 Hassab 手术前CT 及CT 血管造影(CTA)可见脾动脉直径明显较肝总动脉粗大
SASS 的诊断标准:(1)存在明显的脾肿大;(2)脾动脉明显增粗(直径大于4 mm 或大于肝固有动脉直径的1.5 倍);(3)肝动脉通畅无阻塞,但管径细,血流缓慢,增强动脉期肝实质充盈延迟;(4)脾动脉增粗,血流迅速,脾实质早期填充造影剂;(5)脾静脉和门静脉在成像早期即可显影,甚至在动脉期即可出现脾静脉和门静脉显影。
二、纳入标准与排除标准
纳入标准:(1)术前肝硬化门脉高压症并脾功能亢进诊断明确,经术前评估需行开放性Hassab 手术;(2)术前心、肺、脑、肾功能评估正常,肝功能CTP 分级为A 级或B 级,无恶性肿瘤,全身情况可耐受手术;(3)影像学数据完整,可根据SASS 诊断标准进行筛查;(4)无合并肺结核、获得性免疫缺陷综合征(艾滋病)等全身性疾病;(5)意识清晰,无认知障碍,能够配合调查和评估。
排除标准:(1)术前评估为不适合手术或不能耐受手术;(2)存在严重营养不良;(3)术后出现肝衰竭或需要重症监护治疗,或术后非计划二次手术;(4)曾经接受过脾栓塞或经颈静脉肝内门体分流术者;(5)术后失访或临床数据不完整者。
三、手术方法
所有病例均在气管插管全身麻醉下手术,手术期间使用相同的麻醉诱导药物和麻醉维持药物。麻醉成功后,选用左侧上腹部斜切口进腹,先在胰腺上缘找到脾动脉并用3-0 Prolene 线缝合结扎。常规切除脾脏并实施贲门周围血管离断术。彻底止血,脾窝放置硅胶腹腔引流管。麻醉清醒后转运回病房,术后进行常规护肝对症治疗。
四、观察指标
(1)统计两组病人的术前指标,包括性别、年龄、身高、体重、CTP分级、ASA分级,并记录术前肝肾功能指标,计算术前终末期肝病模型(model for end-stage liver disease,MELD)评分。(2)术前行彩色多普勒超声检查评估记录肝固有动脉起始部直径及其流速。(3)统计两组病人的术中和术后指标,包括手术持续时间、术中出血量、术中输血量、术后第3 天和第7 天的肝肾功能,并分别计算术后第3 天和第7天的MELD评分。(4)术后14 d再次行彩色多普勒超声检查评估记录肝固有动脉起始部直径及其流速[因CT 血管造影(CTA)检查昂贵且需注射显影剂,部分病人不接受CTA 检查,大部分病人术后定期复查只能进行彩色多普勒超声检查]。
五、统计学方法
使用SPSS19.0 软件对上述数据进行统计学处理,正态分布数据采用t检验,描述为±s;非正态分布数据描述为M(IQR),采用Mann-WhitneyU检验。分类数据采用χ2检验。以P<0.05 表示差异有统计学意义。
结 果
SASS 组和对照组术前和术中指标,包括性别、年龄、身高、体重、CTP分级、ASA分级、手术持续时间、术中出血量和术中输血量,差异均无统计学意义(均P>0.05),见表1。
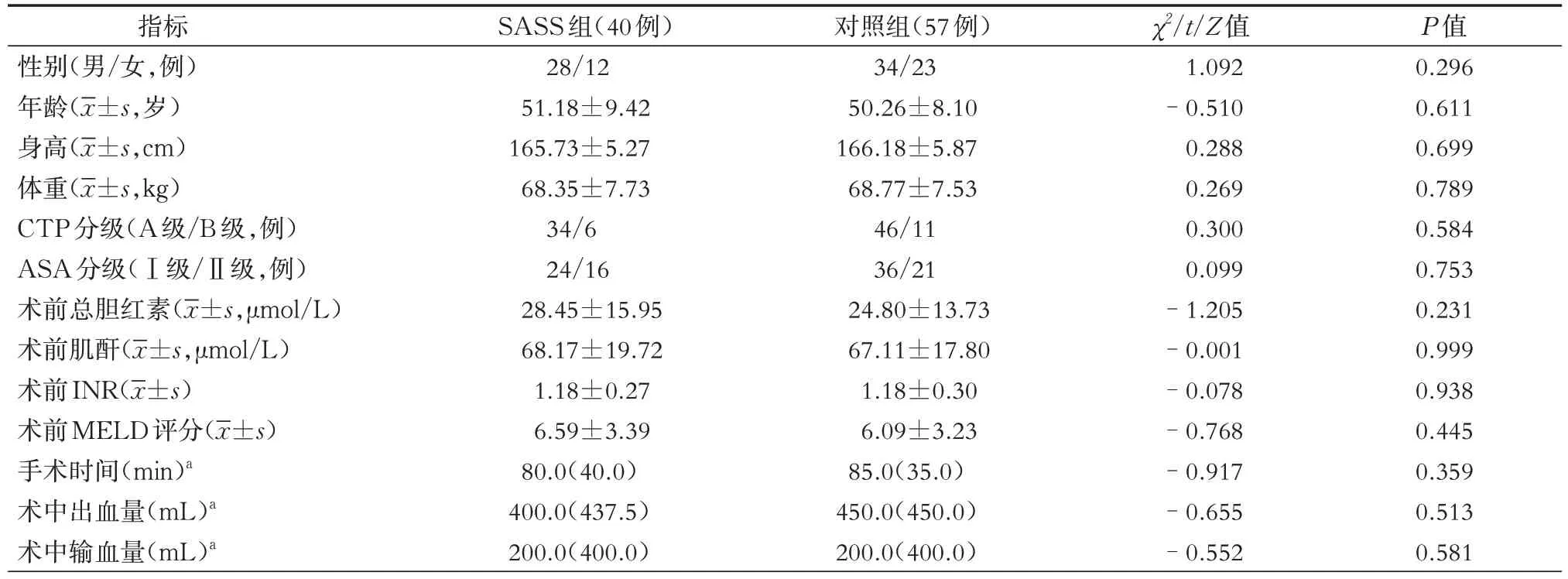
表1 术前和术中各项指标在脾动脉盗血综合征(SASS)组与对照组病人间的比较
SASS 组和对照组的术前肝固有动脉直径、术前肝固有动脉流速、术前MELD 评分和术后第3 天MELD 评分差异均无统计学意义(均P>0.05)。两组术后第3 天的MELD 评分与术前比较,差异均无统计学意义(均P>0.05),两组术后第7 天的MELD 评分均明显优于术前(均P<0.05),见表2。SASS 组术后第7 天的MELD 评分明显优于对照组,差异有统计学意义(P<0.05)。两组病人术后2周的肝固有动脉直径和肝固有动脉流速均明显优于术前(均P<0.05);SASS 组术后2 周的肝固有动脉直径和肝固有动脉流速均明显优于对照组,差异均有统计学意义(均P<0.05)。(表2、图3、图4)
表2 术前、术后肝功能和肝动脉指标在脾动脉盗血综合征(SASS)组与对照组病人间的比较(±s)
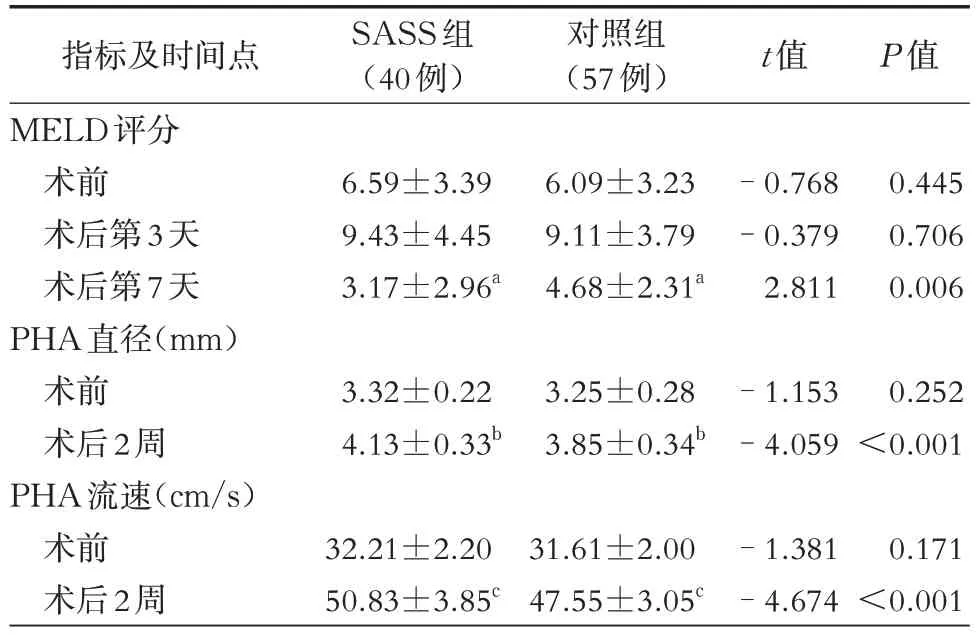
表2 术前、术后肝功能和肝动脉指标在脾动脉盗血综合征(SASS)组与对照组病人间的比较(±s)
注:MELD. 终末期肝病模型评分;PHA. 肝固有动脉;a与术前MELD 评分比较,P<0.05;b与术前PHA 直径比较,P<0.05;c与术前PHA流速比较,P<0.05。
指标及时间点MELD评分术前术后第3天术后第7天PHA直径(mm)术前术后2周PHA流速(cm/s)术前术后2周SASS组(40例)6.59±3.39 9.43±4.45 3.17±2.96a 3.32±0.22 4.13±0.33b 32.21±2.20 50.83±3.85c对照组(57例)6.09±3.23 9.11±3.79 4.68±2.31a 3.25±0.28 3.85±0.34b 31.61±2.00 47.55±3.05c t值-0.768-0.379 2.811-1.153-4.059-1.381-4.674 P值0.445 0.706 0.006 0.252<0.001 0.171<0.001
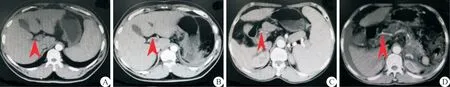
图3 Hassab 手术后CT 可见肝总动脉直径明显较术前增粗
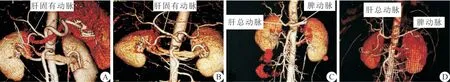
图4 Hassab 手术后2 周CT 血管造影显示肝总动脉及肝固有动脉直径明显较术前增粗
讨 论
肝硬化是各种慢性肝病发展至中晚期的病理过程,其特征是肝脏弥漫性纤维化、肝假小叶形成、肝内外血管增生。肝硬化代偿期可以没有明显的临床症状,而失代偿期的特点是出现门静脉高压和肝功能严重受损[3]。我国目前有4 亿多不同类型的肝病病人,其中肝硬化病人约700 万[4],其中主要是由病毒性肝炎引起的肝硬化。临床上病人往往在已经出现肝硬化相关并发症后才开始就诊,此时病人已处于肝硬化失代偿期,而肝硬化失代偿期病人的中位生存期仅为1.8 年,远低于代偿期病人的12年[5]。因此,对此类病人进行及早、积极的干预将有助于改善其临床预后。
SASS 于1991 年由Manner 等[6]首次描述,并于1992 年由Langer等[7]正式命名。当时SASS 并非用于描述肝硬化病人,而是用于肝移植领域。研究发现,部分原位肝移植后病人的转氨酶和胆红素水平迅速升高,经检查排除了排斥反应,动脉造影显示,虽然肝动脉外观正常,但移植肝的动脉灌注显著减少,肝内动脉分支的造影剂填充延迟,而脾动脉和脾实质的造影剂填充更迅速。有学者推测,粗大的脾动脉“盗走”了原本属于肝动脉的血流,导致肝动脉灌注减少,移植肝缺血缺氧,胆管上皮和肝细胞受损,最终导致移植肝功能丧失,这种现象被命名为SASS。SASS 一直是个充满争议的诊断[2],曾有学者将其描述为“非闭塞性肝动脉低灌注综合征(non-occlusive hepatic artery hypoperfusion syndrome)”[1]。在我国,2003 年首次报道了这一现象[8-9],当时也是用于描述肝移植术后病人。2011 年SASS 的概念开始用于描述肝硬化失代偿期病人,这是国际上首次将SASS 的概念应用于肝移植领域之外,指出这是慢性肝损伤的诱因,并可能加剧肝损伤的病理过程[10-11]。我院于2021 年通过CT 增强和三维CT 血管造影对失代偿期肝硬化病人进行了深入研究,证实了SASS 在失代偿期肝硬化病人中广泛存在,可以引起肝硬化病人长期肝功能轻度异常;在SASS 得到纠正后,这些病人的肝功能指标和CTP 分级可以得到改善[12],因此我们认为SASS 是改善失代偿期肝硬化病人肝功能的有效治疗靶点,但尚未引起临床医生的足够重视。
cSASS 在肝硬化门静脉高压病人中普遍存在,并具有与肝移植后SASS 相同的血流动力学特征。在SASS 病人中,脾动脉直径较粗,血管阻力相对较低,因此从腹腔干分流了更多的血液,导致流向肝动脉的血流量减少,并导致肝脏长期处于缺血和缺氧状态。最终,尽管抗病毒治疗有效,但一些病人的肝脏损伤仍在缓慢进展。SASS 的严重程度与肝动脉缺血的时间呈正相关。因此,及早发现SASS并及时进行诊断和治疗十分重要[12]。Riva 等[13]的研究指出,CT 确定的脾脏体积大于829 mL 时对SASS 的预测准确率为75%。其他研究将CT 测量的脾动脉直径超过4 mm 以及脾动脉和肝动脉直径之间相差6 mm 作为SASS 病人的风险预测因素[14-16]。国内有学者总结了SASS 的诊断标准[10-11],本研究参考了这个诊断标准对病人进行分组。SASS 需要早期治疗,常用的治疗方法包括脾切除、脾动脉结扎和脾动脉介入栓塞[17-21]。有些机构报告SASS 应该用弹簧线圈栓塞治疗。但SASS 病人的脾动脉通常较粗,直径超过5 mm。高速的脾动脉流动往往会将线圈推入脾动脉的分支,从而导致脾脏局部缺血坏死、感染和败血症[17-19]。据报道,栓塞后感染的发生率甚至高达50%[18]。Hassab 手术是临床中最常见、最有效的方法,它不仅降低了门静脉压力,还降低了静脉曲张破裂和出血的风险[22]。
在实施Hassab 手术之前,临床医生必须对病人进行全面的评估。脾肿大以及脾功能亢进程度的确定是评估的重要组成部分。目前脾肿大的分类方法尚未统一。我国外科医生通常采用三度脾肿大分类法:Ⅰ度脾肿大即病人深吸气时脾缘位于左肋缘下2 cm 以内;Ⅱ度脾肿大病人脾缘位于左肋缘下2 cm 以下但未达到脐水平线;脾脏边缘超过脐水平线或超过腹中线为Ⅲ度脾肿大[23]。在此基础上,姜洪池等[24]进一步提出,当脾脏边缘超过髂前上棘水平到达盆腔时,称为Ⅳ度脾肿大,也称为超级巨脾,并在此基础上确定了各级脾肿大的手术指征。欧洲内镜外科协会(EAES)将脾肿大定义为脾脏最大径>15 cm;脾脏最大径>20 cm 或重量>1 000 g为巨脾;脾脏最大径>22 cm 或重量>1 600 g 为超巨脾[25]。Linguraru 等[26]提出,脾肿大时的脾体积为(1 004.75±644.27) mL,并提出了以314.47 mL/430.84 mL 的体积阈值来分别定义轻度/重度脾肿大。Indiran 等[27]提出了脾指数的概念,脾指数是指在CT 上测量的脾脏的长度×宽度×厚度,脾肿大被定义为脾指数>480 cm3。此外还有很多分类方法,各种分类方法也各有利弊,难于统一。然而我们认为不同身高和体重的人在脾脏重量和体积上存在个体差异,因此基于脾脏重量或体积评估脾脏大小可能缺乏准确性和临床意义。
脾功能亢进的分级在国际上罕见报道。根据白细胞计数(WBC)和血小板计数(PLT),我国学者将脾功能亢进分为轻度、中度和重度三级[28-29]:轻度,WBC(3.0~4.0)×109/L,PLT(70~100)×109/L;中度,WBC(2.0~3.0)×109/L,PLT(30~70)×109/L;重度,WBC<2.0×109/L,PLT<30×109/L。侯钰等[30]提出以WBC、红细胞计数(RBC)、PLT、脾静脉直径、脾脏长度和脾脏厚度等6 项指标作为分级依据。当WBC 为(3.0~4.0)×109/L,RBC 为(2.5~3.5)×1012/L,PLT 为(70~100)×109/L,脾静脉直径<1.0 cm,脾脏长度<12 cm,脾厚度<6 cm时,定义为轻度脾功能亢进。中度脾功能亢进:WBC(2.0~3.0)×109/L,RBC(1.5~2.5)×1012/L,PLT(50~70)×109/L,脾静脉直径1.0~1.5 cm,脾脏长度12~16 cm,脾脏厚度6~8 cm。重度脾功能亢进:WBC<2.0×109/L、RBC<1.5×1012/L、PLT<50×109/L,脾静脉直径>1.5 cm,脾脏长度>16 cm,脾厚度>8 cm。本研究参考这种分级方法,只考虑对中度或重度脾功能亢进的病人进行手术。脾切除后,远端被结扎的脾动脉不再分流肝动脉的血流,显著增加了肝动脉血流灌注,改善了肝细胞的供血和供氧,改善了肝脏功能,提高了肝脏再生能力,有效控制了脾功能亢进的症状[31-32]。同时,贲门周围血管离断术可以阻断主要的门静脉侧支,确保更多的门静脉血流入肝脏,并大大改善了肝脏的门脉血液供应。
2002 年,美国正式使用MELD 评分系统作为成人肝移植的标准。从此世界各地的学者开始验证MELD 在判断终末期肝病的肝脏储备功能方面的价值。在准备接受经颈静脉肝内门腔分流术的肝硬化病人的短期生存率方面,MELD 评分显著优于CTP评分,表明MELD评分可以更好地预测慢性重型肝病病人的短期存活率[33-34]。在本研究中,使用MELD 评分系统来评估手术后肝功能的改变,避免了观察多种指标所带来的复杂性和局限性,使观察指标更加简单、直观,观察结果也更加客观。
从本研究结果可以看出,在Hassab 手术后,cSASS 病人的肝动脉明显增粗,肝脏动脉血液灌注显著增加,MELD 评分降低,肝功能改善。手术后肝脏动脉灌注的改善主要是基于两个方面。首先,Hassab 手术导致动脉血流从脾动脉转入肝动脉,从而增加了肝动脉的灌注;其次,可能涉及另一种机制,即肝动脉缓冲反应[35-36]。肝脏独特的双重血液供应是指肝脏血供中存在两条主要供血血管,由门静脉和肝总动脉组成,提供平衡的血液供应。双重血液供应可以确保充足的血液供应,每分钟约1 500 mL,相当于心输出量的1/4。门脉高压灌注可导致肝动脉灌流减慢,动脉血管阻力增加,从多普勒超声检测中可观察到肝阻力指数增加[37]。有研究指出,这可能是腺苷更多存在于门静脉血中,导致肝动脉血管中腺苷浓度相对降低,致使小动脉血管持续收缩和动脉血流量减少[38-39]。这种情况可以通过脾切除减少门静脉过度灌注来逆转[40-41]。脾动脉血流量的减少会自动导致门静脉的血流量降低,通过负反馈机制,最终导致肝动脉的血管舒张、肝动脉灌注血流的改善。因此,Hassab 手术是改变肝动脉血流动力学、将血流由脾动脉重新引至肝动脉的有效治疗方法。然而,本研究中纳入的样本数量有限,尚需要更多的研究来证明本文的观点。
综上所述,我们认为肝硬化门脉高压可导致一系列血流动力学异常,如脾脏充血和肿胀、脾功能亢进、门静脉增宽、食管和胃底静脉曲张以及脾血管血流增加。由于脾动脉与肝动脉均起源于腹腔干,脾动脉血流的增加必将导致肝动脉血流相对不足,致使肝脏缺血缺氧,进而导致肝功能异常。这也是临床上许多肝硬化失代偿期病人肝功能轻度异常的主要原因。脾脏切除后,肝动脉的血流动力学异常得到了明显的改善,肝细胞缺血缺氧情况亦得到缓解,肝功能即随之恢复正常。所有肝硬化失代偿期病人均存在不同程度的cSASS,较严重者即达到SASS 诊断标准,可以引起肝硬化病人长期肝功能轻度异常,在cSASS 得到纠正后,病人的肝功能可以得到改善,因此cSASS 是失代偿期肝硬化病人的有效治疗靶点。我们希望将“cSASS”的概念引入临床,并引起更多临床医生的关注和研究,使更多的肝硬化病人受益。
利益冲突所有作者均声明不存在利益冲突
