离体肝切除和自体肝移植术的手术研究进展
2024-03-26盛嘉麟董青福史武江王健岗崔云甫钟翔宇
盛嘉麟,董青福,史武江,王健岗,崔云甫,钟翔宇
哈尔滨医科大学附属第二医院胆胰外科,黑龙江 哈尔滨 150086
离体肝切除和自体肝移植术(ex-vivo liver resection and autotransplantation,ELRA)是肝脏切除技术与肝脏移植技术的结合,它可切除常规肝切除无法切除的病灶。ELRA 与常规肝切除术相比,它突破了在体肝脏手术的解剖空间限制、肝脏血流阻断的时间限制和血管重建的技术限制;与同种异体肝移植术相比,节约了寻找肝源的时间,术后不需服用免疫排斥药物;其因诸多亮点受到外科医生的青睐。本文对ELRA 的手术进展进行综述,旨在为复杂肝脏疾病的手术治疗提供新的思路
一、ELRA的手术发展历史
1988 年Pichlmayr 团队对1 例胃平滑肌肉瘤肝脏巨大转移的病人完成了世界上第一例离体肝切除术加自体肝移植术[1]。1991 年Hannoun 团队在ELRA 基础上发明了半离体肝切除和自体肝移植术,与ELRA 相比,保留了第一肝门的连续性和完整性;减少了手术中无肝期的时间与血管吻合并发症的发生[2]。1996 年,董家鸿团队对1 例中央型巨大肝癌病人实施了半离体肝切除和自体肝移植术[3]。Oldhafer 等[4]于2000 年发表了1 篇关于22 例行ELRA 的肝脏肿瘤病人的长期治疗结果分析,认为ELRA 术式具有可行性,但术后病人死亡率高,并且有术后肿瘤复发的可能,提醒医生在决定手术治疗肝脏肿瘤时应慎重采取这种高风险的术式。2005年,温浩团队完成了我国的第一例ELRA,成功治疗了1 例肝内胆管细胞癌病人[5]。在使用ELRA 治疗肝脏恶性肿瘤取得成果后,外科医生尝试将ELRA用于终末期肝泡型棘球蚴病(hepatic alveolar echinococcosis,HAE)的治疗。2010 年温浩等[6]报道了1例ELRA 治疗终末期HAE的病例,并在术中对侧支循环丰富的病人使用了临时的门-体静脉分流技术。吐尔干艾力·阿吉和董家鸿等学者发表了69 例终末期HAE 病人接受ELRA 治疗的病例系列报告[7],报道中病人术后30 d 死亡率和总死亡率(>90 d)分别为7.24%(5/69)和11.5%(8/69);在对病人术后随访中,平均随访22.5 个月(14~89 个月),随访病人无复发,幸存者无病生存率为100%,证明ELRA在治疗HAE中是安全可行的[7]。沈舒等[8]通过回顾性研究,对比了ELRA与同种异体肝移植术对HAE的疗效,发现ELRA的效果在治疗HAE上优于同种异体肝移植术。邱逸闻等[9]对ELRA 与非手术方式治疗HAE 的长期疗效进行了统计学分析,行ELRA的手术组病人其长期总生存率远高于非手术组,而短期的结果也表明对于预测12个月后死亡风险大于75%的病人,进行ELRA则会显著获益。
二、ELRA的手术适应证
根据既往ELRA的相关文献,可从以下几方面判断病人是否符合ELRA的手术适应证。
(一)ELRA适应的疾病种类
按疾病适应证划分可将其分为肝脏良性疾病、肝脏恶性疾病,以及其他类疾病。(1)肝脏良性疾病:肝血管瘤、肝囊肿、HAE、肝囊腺瘤、肝腺瘤等;HAE虽为良性疾病但具有恶性肿瘤的侵袭生长特性,在终末期常侵犯了下腔静脉与肝静脉等大血管,常规手术无法治疗[10],文献报道已证实了ELRA 对终末期HAE 具有很好的疗效[10-14]。(2)肝脏的恶性疾病:肝细胞癌、肝母细胞瘤癌、胆管细胞癌、平滑肌肉瘤、血管内皮瘤、肝腺样癌等肝脏原发的疾病;还有原发病为胃癌、胰腺癌、结肠癌等肿瘤的转移性肝癌。部分医疗团队对ELRA 成功根治恶性肿瘤的病例进行了报道[15-21],但Serrablo 等[22]研究表明ELRA 对肝脏恶性肿瘤的治疗效果与HAE 相比较差。(3)其他类型:肝结节增生、肝肉芽肿、肝静脉汇合部和下腔静脉破裂的复杂肝外伤、肾上腺外嗜铬细胞瘤等[23-24]。
(二)ELRA适应的解剖特征
最初行ELRA 治疗病人其病灶的解剖特征粗略为肝脏肿瘤侵犯下腔静脉等大血管,无法行在体肝切除进行根治手术。术前使用磁共振成像和增强CT,以评估病变特征、门静脉、肝后下腔静脉侵袭的长度和直径,并评估是否有肝外转移的证据[25-26];使用三维重建技术计算残余肝脏体积(residual liver volume,RLV),并可视化了血管和胆道解剖结构以及大肿块的空间位置[27]。这些影像学检查对病灶解剖特征的归纳起到了帮助作用。叶啟发教授于2014年将36例行离体或半离体肝切除术病人的肝脏病灶解剖适应证位置归纳为:(1)病灶位于肝右静脉、肝中静脉与肝后下腔静脉构成的三角区;(2)病灶位于肝左静脉、肝中静脉与肝后下腔静脉构成的三角区;(3)病灶位于肝尾状叶及肝4 段;(4)病灶位于门静脉左支、肝中静脉主干与肝后下腔静脉构成的三角区;(5)病灶位于门静脉右支、肝中静脉主干与肝后下腔静脉构成的三角区(图1)。
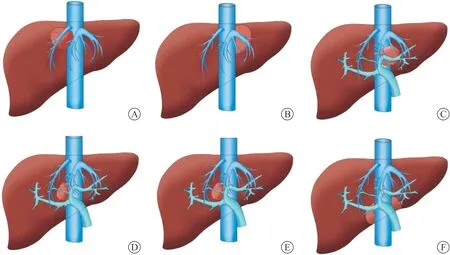
图1 叶啟发教授提出适合行离体肝切除和自体肝移植术的解剖适应证
而可尝试进行ELRA 的复杂肝脏病灶可具体分为:(1)病灶位于肝左静脉、肝中静脉和肝后下腔静脉之间的三角区域内;(2)病灶位于肝右静脉、肝中静脉和肝后下腔静脉之间的三角区域内;(3)病灶位于肝中静脉和肝后下腔静脉之间的三角区域内;(4)病灶位于门静脉左右分支和肝后下腔静脉之间的三角区域内;(5)病灶位于门静脉右支和肝后下腔静脉之间的三角区域内;(6)病灶位于门静脉右支下方二级分支和肝后下腔静脉之间的三角区域内;(7)病灶位于门静脉左支、门静脉主干和肝后下腔静脉之间的三角区域内;(8)病灶位于尾状叶内,围绕下腔静脉;(9)病灶位于门静脉右支、中支和肝后下腔静脉之间的三角区域内;(10)病灶位于第三肝门旁,围绕肝后下腔静脉;(11)病灶位于第二肝门旁,围绕第二肝门静脉[28-29]。
符合解剖适应证分类的病灶往往侵犯了第一、二、三肝门的血管,常规肝切除无法实现R0 切除。邱逸闻等[30]根据ELRA 的手术计划与下腔静脉、门静脉和肝静脉浸润的类型和范围联系起来,确定了4 种类型的解剖损伤特征:Ⅰ型,第一肝门受到严重的侵犯,伴有不同程度的下腔静脉和流出道侵犯;Ⅱ型,侧重于下腔静脉侵犯,包括膈肌甚至右心房;Ⅲ型,病人多处血管浸润,但没有一处血管浸润严重;Ⅳ型,血管浸润较少。Ⅰ型、Ⅱ型和Ⅲ型是ELRA 的绝对适应证;Ⅳ型是ELRA 的相对适应证,术者可尝试进行在体手术,若在体手术无法根治,则仍需进行ELRA术式。这种方式对血管切除重建有着指导作用。而门静脉发生严重海绵样变的病人,如果在体手术难以暴露,也可行ELRA治疗[31]
(三)ELRA的肝脏功能要求
行手术前需评估病人能否耐受手术,根据既往研究,病人肝脏应满足以下要求:(1)使用Child-Pugh 评分为A 级或B 级,无肝硬化;(2)轻中度肝硬化病人,其术后RLV 不小于50%;(3)终末期肝病模型评分(model for end-stage liver disease,MELD)评分小于9;(4)无活动性的乙型肝炎病人,如病毒含量高,则需进行抗病毒治疗,将乙型肝炎DNA含量降至手术允许范围内(一般低于1×103拷贝/mL);(5)行吲哚菁绿试验的病人测定15 min 后残余率小于20%;(6)轻中度脂肪肝病人,脂肪病变部分小于30%;(7)估计的RLV与标准肝脏体积(standard liver volume,SLV)之比至少为0.35[32-34]。
三、ELRA的技术特点
ELRA 的技术主要包括肝脏分离技术、肝脏低温灌注与冷保存技术、静脉转流技术、血管重建技术。
(一)肝脏分离技术
ELRA 采取“奔驰切口”,如病人疾病为转移性肝癌,需寻找原发灶与肝脏病灶,并进一步探查毗邻或远处器官有无其他转移的病灶。探查完毕后解剖第一肝门,对肝动脉、胆总管与门静脉进行骨骼化分离,并一一牵引[35-37]。解剖完毕后,打开肝脏韧带,游离肝脏。游离左叶肝脏时需将下腔静脉左外侧壁暴露,并将左膈静脉离断,保护肝左外侧动脉。游离右叶时,需将下腔静脉右侧壁暴露,并沿其进入下腔静脉后方。肝脏游离后,游离肝后下腔静脉,保证游离出足够的长度便于临时循环建立与术后流出道重建。进一步解剖第二肝门,重点对肝上下腔静脉游离,同样保留适合长度进行管道重建。辨认三支肝静脉,并对保留的肝静脉加悬吊保护。如病灶侵犯第三肝门,则需要离断肝短静脉,而对于一些终末期HAE 病人,病灶侵犯膈肌,则需进行膈肌切除,并准备补片进行膈肌修复。
(二)肝脏低温灌注与冷保存技术
使用器官灌注液通过门静脉对肝脏进行灌注,低温灌注法是目前ELRA 最常用的保存方法。用于ELRA 的灌注液种类有威斯康星大学液(UW液)、康斯特液(HTK液)以及欧洲柯林斯液(Euro Collins,EC液)等。其中HTK液较UW液有价廉、低钾、低黏度等优点。HTK 液的低黏度特性使其冲洗肝脏效果更好,成为肝脏移植中常用的灌注液[38]。一项关于UW 液与HTK液在终末期肝泡型包虫病病人ELRA中疗效比较的研究表明,UW液和HTK液表现出相似的疗效和安全性,但UW 液保存肝脏的病人术后胆道并发症发生率较高[39]。HTK液因其冲洗与灌注速度快,可能会引起自体供肝术后功能的恢复延迟。进行肝脏灌注时需保持灌注液温度在0~4 ℃,同时手法缓慢、均匀,避免因人为因素致使肝脏损伤。
(三)静脉转流技术
建立静脉转流的目的是维持无肝期血流动力学稳定、防止腔静脉系及门静脉系淤血,为离体肝脏病灶切除与肝脏管道的修建提供充分时间。最初的ELRA 静脉转流方法为体外静脉转流体系,通过转流泵将门静脉与下腔静脉的血转流至左腋静脉或颈静脉等血管,最后汇入上腔静脉[40-41]。Kim等[42]于1999 年报道了改进门静脉转流技术。采用暂时门脉系统减压技术,通过降低门静脉压力,减轻肝脏缺血性损伤及腹部其他器官静脉淤血。Azoulay 等[43]于2006 年报道另一种转流方式,采用的肠系膜静脉、右股静脉至左侧颈静脉转流术。但体外静脉转流的方式有着较多并发症。学者们尝试使用非体外转流的方法维持无肝期的血流稳定。张克明等[44]于2012 年对3 例ELRA 病人进行了非体外转流的方法,降低围手术期的并发症。目前采用的方法是使用临时性的肝后下腔静脉重建和门体转流术来维持无肝期的血流动力学稳定,利用自体门静脉与重建的肝后下腔静脉行暂时性的门腔端侧分流。非体外转流可使用同种异体、自体其他静脉或人工血管再建临时性体循环回路。根据肝后下腔静脉阻塞情况,是否有门腔侧支循环形成,进一步确定建立方式。当门腔静脉间有着明显的侧支回流,则可以将门静脉短暂夹闭,不进行门腔端侧吻合。有的病人形成了肝下下腔静脉到上腔静脉的侧支回流,则将下腔静脉夹闭,再根据门腔静脉的侧支循环情况判断是否进行门腔吻合。如肝后下腔静脉可以保留则仅需门腔吻合完成门腔分流。Baimas-George等[45]对既往行静脉-静脉旁路与临时的门腔分流病人进行生存率的比较,在其研究的系列中,术中变量和发病率差异无统计学意义,累积趋势有利于临时的门腔分流。临时的门腔分流组的9 d死亡率明显低于静脉-静脉旁路组[45]。
(四)血管重建技术
血管重建中肝后下腔静脉是否需要重建及重建材料的选择是血管重建中的难点。如病人在术前肝后下腔静脉发生严重阻塞,周围形成了丰富的侧支循环,并在术中离断肝上下腔静脉与肝下下腔静脉后,血流动力学依旧稳定,或病人无法进行肝后下腔静脉的重建,可以考虑不进行肝后下腔静脉的重建。但此方法存在着争议[46]。研究表明,不进行肝后下腔静脉重建的病人,术中血流动力学与其他重建的方式一样稳定;但其术后并发症的发生率相对较高,术后恢复与其他方式相比也更为缓慢[47-49]。
一项对114 例行不同肝后下腔静脉重建方式的ELRA病人研究,其结果同样说明,不进行肝后下腔静脉重建的病人,其术后并发症发生率与住院时间远高于重建的病人,提示不重建肝后下腔静脉的方法应慎重考虑[50]。如果选择进行重建,可选择人工血管、病人自身的血管(如大隐静脉、髂总静脉等)[51-52]、补片或者同种异体血管进行重建。肝圆韧带作为病人自身补片,具有提取方便、无供区损伤、无免疫排斥反应等优点,用于手术的效果很好[53]。人工血管与病人自身血管或同种异体血管相比,其潜在风险在于包括静脉血栓形成、人工血管畸形以及术后肝脏增生导致的吻合口扭曲或狭窄,但其保存条件更简单,贮存时间更长,受到自体移植病人的限制更少,手术时修剪与缝合的速度快,更容易完成管道重建,膨胀聚四氟乙烯人造血管是目前常见的选择,它具有抗压性强且不易断裂的优点,但血栓形成的弊端同样存在,需要长期应用抗凝剂[54]。重建肝后下腔静脉的不同材料并未显著影响术后的结果,对材料的选择应多以术中对肝后下腔静脉重建的策略为重心[55]。重建策略应根据病灶侵袭下腔静脉的范围来调整,当根治性切除后下腔静脉的壁缺损小于管腔周长的120°时,可以直接使用自缝合法,不会影响血管张力或通畅。如果缺损的周长为120°~180°,用自体血管补片修复是最佳选择(如肝圆韧带、颈内静脉等其他静脉)修复管腔缺损,因为在这种情况下直接缝合可能导致术后血管狭窄。如果病人下腔静脉的缺损超过周长的180°且难以用自体补片修复时,应使用人工血管或同种异体血管更换肝后下腔静脉,并且术后必须进行严格的抗凝治疗[50]。而使用人工血管重建下腔静脉,将肝后下腔静脉与人工血管行侧侧吻合的背驮式自体肝移植术,因减少了总的体外循环时间与平均手术时间,也可在满足条件时进行使用[56-57]。
肝静脉的重建是血管重建的另一问题。根据肝静脉受侵情况考虑是否需要进行肝静脉流出道“袖口状”成形和肝静脉-补片修复成形。修复后的肝静脉与下腔静脉吻合,过程中需设计好肝静脉与下腔静脉角度。肝静脉重建时应避免肝静脉口发生充血、拉伸或吻合口狭窄,在肝静脉多个孔口需要修整时更需注意[58-60]。高质量的肝静脉重建有效降低术后肝静脉阻塞等并发症出现的风险,并且重建的肝静脉不宜过长,避免因发生肝静脉吻合的扭曲而导致术后并发症[61]。而对于三支肝静脉全部被侵犯病人,根据侵犯程度选择适合的一条肝静脉重建[62-63]。如重建静脉的病人抗凝后仍出现静脉管腔狭窄,则需接受球囊扩张和支架置入等方式干预治疗。
四、总结与展望
ELRA 操作困难,但它的优点与潜力使其值得被推广。我国在ELRA 治疗HAE 方面已有一定研究,大量病例报道证明了它的良好疗效。目前使用ELRA 治疗肝恶性肿瘤也取得了不错效果[64],但术后的肿瘤复发的风险始终困扰着医生与病人[65-67]。随着放射介入技术、靶向药物与免疫药物、术后辅助化疗的发展,将为ELRA 治疗肝恶性肿瘤带来增益。ELRA 的未来发展应加强针对侵犯肝门结构、常规肝切除不适用的恶性肿瘤。而进一步缩短手术时间,完善无肝期的管理,减少病人住院时间以及预防术后并发症的发生,以降低ELRA的术后死亡率,则需要继续实践探索。
利益冲突所有作者均声明不存在利益冲突
