有机磷酸酯药剂的毒理学机制和生态效应
2024-03-26李正禾郑皓
李正禾 郑皓
摘要:有机磷酸酯药剂产生于战争时期的沙林毒气,后来转入农业害虫防治的应用中,有机磷酸酯杀虫药剂是农业和林业保育中害虫防治最为广谱的药剂。本文在介绍有机磷杀虫剂发展历史的基础上,从有机化学、生物化学和分子毒理学等方面,对有机磷酸酯的化学性质和生物反应进行概述,深入分析了有机磷酸酯的毒理学机制和生态学效应,研究内容可为植物保护和林业管理的有机磷药剂使用提供有机化学的基础理论参考。
关键词:有机磷酸酯;害虫防治;有机化学;毒理学
中图分类号:S482.3+3 文献识别码:A 文献编号:1005-6114(2024)01-003-05
1 有机磷杀虫剂的发展历史
1.1 有机磷化学研究的出现
一八二零年,Lassaigne用磷酸和乙醇进行化学反应,开始了有机磷的化学研究[1]。一八五四年,Clermont合成了四乙基焦磷酸酯,四个乙基对称排列,即是特普(TEPP)药剂[2]。一九三二年,苏黎联邦理工学院的Krueger和Lange首先发现了二烷基一氟磷酸酯的剧毒性。特普药剂曾经在历史上作为有机磷农业药剂大量使用,但是因为毒性非常高而后来被禁用[3]。
一九三七年,德国农业和林业生物研究所的化学家Schrader在寻找具有杀螨以及杀蚜虫活性的酰氟化合物过程中,制成了具有强烈生理作用的撒林,对哺乳动物具有强烈的毒性[4]。一九三八年,Schrader合成了第一个有机磷杀虫剂,叫做四乙基焦磷酸酯[5]。
1.2 战争时期有机磷化学合成的发展和农业应用
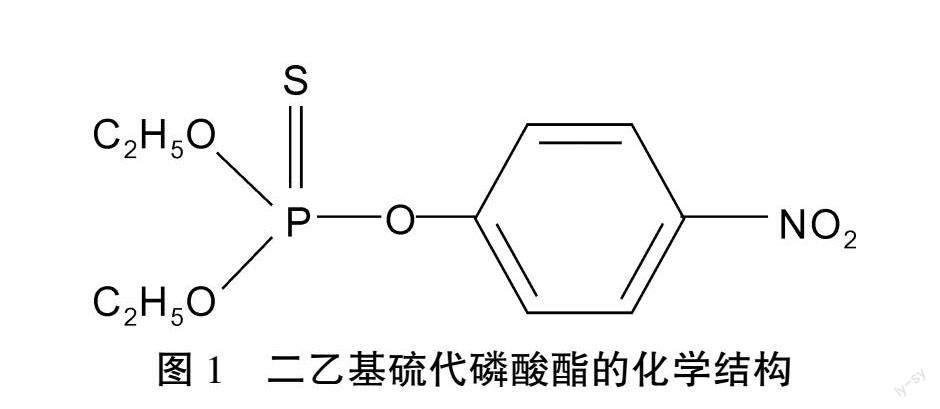
第二次世界大战期间,德国科学家研究有机磷作为投入战争使用的神经毒剂。盟军为了切断德国的战略农业物资补给,使用航空飞行器将大量高繁殖性的科罗拉多马铃薯甲虫空投至德国的占领区,导致叶甲泛滥,使德国的士兵缺少粮食补给[6,7]。德国有机磷相关研究人员将有机磷神经毒素进行改造,变为叶甲的高效杀虫剂,同时在合成有机磷神经毒剂时发现了若干对昆虫毒性较强的化合物。一九四一年,Schrader合成了具有内吸性有机磷杀虫剂-八甲基焦磷酸酰胺(OMPA)和可快速生产的四乙基焦磷酸酯(TEPP)。一九四四年,合成了二乙基硫代磷酸酯(E605),化学结构见图 也就是农业生产上使用的对硫磷,这是农业药剂史上的重大突破。
有机磷上的氧点位用硫来取代,原来的氧点位结構是战争使用的撒林毒气,用硫取代氧点位后成为有机磷杀虫剂。
O-O二乙基的毒性较强,用甲基来取代乙基之后化合物的毒性会降低二分之一,但是仍然具有较高的毒性,农业部门开始采取措施来取代这种杀虫药剂。
通过对二乙基硫代磷酸酯(E605)进行修饰,取得了多个活性良好的类似物,比如氯硫磷、倍硫磷、甲基对硫磷等有机磷农药[8]。一九五零年,美国氰胺公司合成了对哺乳动物低毒的马拉硫磷。一九五二年,Perkow将三氯乙醛和亚磷酸三甲酯进行重排缩合,合成了具有优异杀虫活性的敌敌畏和速灭磷。进入二十一世纪后,不断有新的有机磷杀虫药剂被合成开发出来。
2 有机磷酸酯的有机化学分析
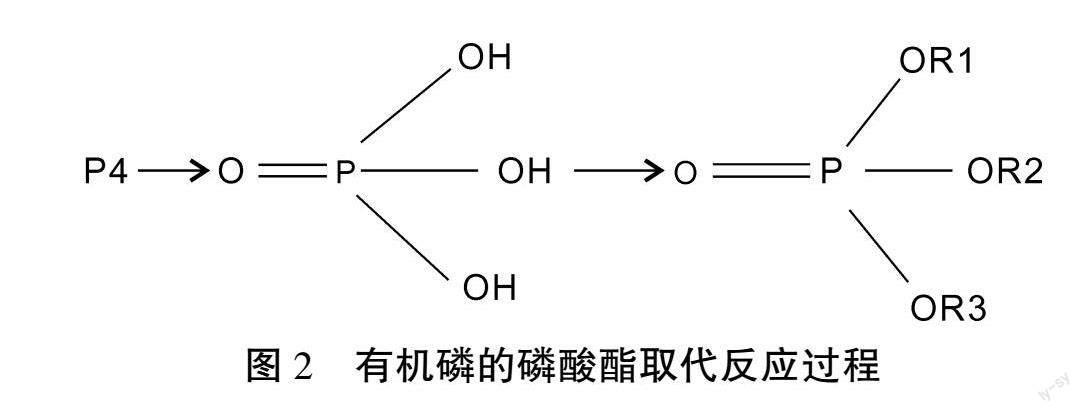
磷元素在生命形成中扮演着重要的角色,肥料施用中氮、磷和钾元素也是农业中的植物生长所需的基本元素。1S22S22P63S23P3从有机磷的外围电子排布进行分析,3S23P3这样的外围电子序列容易形成SP3d的杂化轨道,出现等同性的+5的化合价,从而形成+5价的化合物,最常见的是五氯化磷。在磷被取代后,会出现磷酸,二次取代反应后形成磷酸酯。
从元素磷到磷酸过程中,磷酸属于无机酸,磷酸被OR取代以后成为有机化合物,实现了磷酸从无机物变为有机化合物的转变,磷酸取代后形成酯键,即为磷酸酯(图2)。
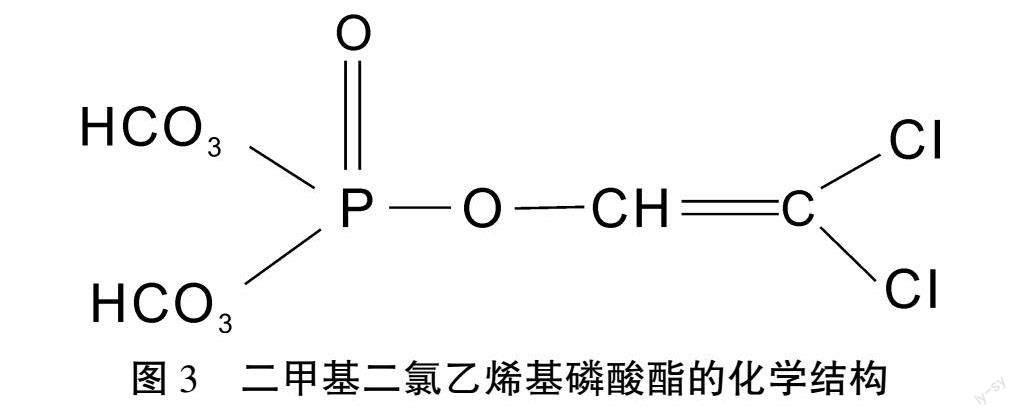
图3为敌敌畏(二甲基二氯乙烯基磷酸酯)的平面化学结构图,敌敌畏的OR取代反应是对称的O-O-二甲基和乙烯基来取代三个氢元素的位置,从而形成有机磷酸酯。敌敌畏曾广泛应用于农业和园林的虫害防治中,敌敌畏的光化学降解速度快,并且没有硫元素的取代,具有酯的芳香气味。
3 有机磷杀虫药剂的类型
3.1 磷酸酯类有机磷
敌敌畏(O-O二甲基二氯乙烯基磷酸酯)和久效磷(甲基氨基甲酰乙烯基磷酸)化学结构中,磷酸上的氢点位被OR基团所取代形成酯键的有机化合物为有机磷酸酯,这些酯类有机磷化合物具有芳香气味。
3.2 硫代磷酸酯类有机磷
在有机磷杀虫药剂中,磷酸分子中的氧原子被硫原子置换,称为硫代磷酸。磷酸酯由于P=O键的关系,氧点位的电负性太强(图4),导致硫代磷酸酯的毒性太强,农业部门要求药剂生产中用硫将氧点位取代。
根据替代的硫原子数目,分为一硫代、二硫代和三硫代磷酸酯。根据硫原子和磷原子的连接方式不同,可以分为硫逐磷酸酯和硫赶磷酸酯两大类(图5)。
双键上的氧点位被硫取代为硫逐磷酸酯,典型就是O-O-二乙基硫代磷酸酯(对硫磷);单键上的氧点位被硫取代为硫赶磷酸酯,典型的是O-O-甲基氨基甲酰甲基二硫代磷酸酯(乐果),通俗上来讲,就是双键上的硫元素被赶到单键上来。
这类药剂的理化性质,多数为油状液体,少数为固体粉末,颜色较深。由于硫元素发生了取代反应,因此硫代磷酸酯类化合物有硫气体的刺激性气味。从一硫代到二硫代和三硫代,随着硫元素在化合物点位中数量增多,硫代化合物的刺激性气味更加的严重,尤其是O-O-二甲基二硫代磷酸酯(马拉硫磷)和O-O-二乙基二硫代磷酸酯(甲拌磷)的有机磷酸酯有两个硫点位发生取代反应,因此农药施用过程中会产生严重的刺激性气味。
3.3 膦酸酯类有机磷
膦酸酯是磷原子直接与氮原子相互键合,乙酰甲胺磷、水胺硫磷和羟基乙基磷酸酯(敌百虫)都属于这一类磷酸酯的化学结构。
药剂的沸点一般都很高,在常温下蒸气压很低,除了敌敌畏的蒸气压较高,其他的硫代磷酸酯物质的蒸气压都很低,不能作为熏蒸剂使用。大多数的磷酸酯不溶于水或者微溶于水,可以溶于有机溶剂中,极少数品种的水溶性较大,比如敌百虫、乐果、甲胺磷、磷胺等。磷酸酯本质上属于脂类的化合物,在碱性条件下容易分解失效,并水解为酸和醇两部分。
4 有机磷药剂的作用机制
有机磷药剂可抑制神经突触传递中的递质水解酶-乙酰胆碱酯酶,在神经冲动传递过程中,使释放到突出间隙的乙酰胆碱大量积累,从而阻断神经系统的信号传递,导致害虫死亡(图6)。在正常生理条件下,当神经受到刺激时,其神经末梢部位会释放出乙酰胆碱,将神经冲动向所支配的效应器官传递[9]。
同时,乙酰胆碱在效应器官中被乙酰胆碱酯酶进行迅速地分解,作为神经递质的乙酰胆碱在胆碱酶的催化作用下,水解为胆碱和乙酸以实现神经系统的生理功能协调和动态平衡。而氨基甲酸酯类和有机磷类型的农药试剂都是乙酰胆碱酶活性的抑制剂,两者均可以抑制胆碱酶的催化活性,导致乙酰胆碱大量局部蓄积,而过度积累的神经递质会刺激胆碱中枢神经系统以及效应器官,引发组织器官的生理功能改变,进而产生一系列的神经毒理症状。
5 有机磷杀虫药剂的特征
5.1 有机磷药剂的酯类化学特征
从有机磷药剂的化学结构来看,有机磷药剂是一种酯类的化合物,酯类化合物的酯键遇水会发生水解反应,在碱性和氨水环境下也会发生分解。随着温度的升高和碱性强度的增加,酯类有机磷的水解速率会变快。农业农村部要求,农药保质期至少两年,两年之内农药能够保持其规定的有效成分含量[10]。因此,有机磷农药试剂配制中需要进行除水的預处理环节。
5.2 有机磷药剂的生物活性特征
在碱性环境下,磷酸酯类有机磷药剂在脱去了氯化氢之后转化为毒性更强的敌敌畏,稻纵卷叶螟等害虫的体内生理环境为碱性环境,害虫在摄入敌百虫药剂之后,会转化为敌敌畏,毒性增强,具有害虫的选择性杀灭效果。
有机磷药剂具有高效广谱的特征,杀虫的速效性也很强,对绝大多数的害虫都有很好的防治效果;作用方式多样,如触杀、胃毒、熏蒸等;在动植物体内持效时间不同,在植物体内可代谢降解,有些持效期短、毒性较低,比如马拉硫磷、辛硫磷,持效期只有几天[11]。
有机磷试剂敌敌畏具有良好的水溶性,对害虫具有极强的击倒能力,在高温环境下可对害虫进行熏蒸杀灭。害虫的生理抗性和抵抗力不同,对有机磷试剂的熏蒸反应不同,免疫能力较差的害虫会直接死亡。类比于对蚊虫击倒能力极强的胺菊酯,有机磷在农业害虫的防治最有效和广谱的药剂就是敌敌畏。
稻纵卷叶螟危害的叶片出现卷曲现象,一般杀虫试剂难以渗入,而有机磷对稻纵卷叶螟具有极强的渗透灭杀活性。因此,渗透性极强的药剂杀螟硫磷,应用于林业保育和农业害虫防治中,也是联合国允许在储粮中使用的农药种类(图7)[1 13]。
部分药物种类的残效期较长,比如甲拌磷,通过拌种使用的话,它的持效期可以达到两个月;有些种类具有内吸作用和很强的渗透作用,施于叶片的正面,可以穿透叶片达到叶片的背面,对叶片背部的害虫也有很好的防治效果;在生物体内以及环境中容易降解,不易产生农药剂量残留,对环境安全[14]。
6 有机磷酸酯药剂的生态学效应
6.1 生物对有机磷杀虫剂吸收和转化
环境污染物进入生物体后,陆续发生吸收(Absorption)、分布(Distribution)、代谢(Metabolism)和排泄(Excretion)等四个关联的过程,统称为ADME过程。在这四个过程中,吸收、分布和排泄都是化学物质穿越生物膜的过程,只在体内发生移位,而结构和性质不变,因此又被称为生物转运过程,而代谢被称为生物转化过程[15]。
有机磷污染物在生物转化过程中,其分子结构和化学特性会发生改变,不同类群生物对环境污染物的吸收、体内分布和排泄的途径与机理不同。有机磷污染物的吸收和排泄,不仅与其生物转运、代谢转化密切相关,而且与其在体内的富集、积累和毒性作用也有密切关系。
6.2 有机磷杀虫剂的生态环境影响
在植物的生长过程中,常使用农药来控制有害生物,促进农作物的生长。但是,农药的滥用对植物多样性造成不良影响,使得植物的丰富度大量减少。有机磷农药的化学毒性在防治害虫方面发挥了巨大作用,但是也给非靶标生物和人类带来了危害,引起一系列生态毒理学问题[16]。
有机磷酸酯类农药试剂作为环境污染物,由于自身的脂溶性会通过生物的细胞膜的磷脂双分子层而被吸收,吸收后快速在体内扩散,并导致有机磷与神经系统中的胆碱酶发生取代反应,从而导致磷酯酰胆碱大量的蓄积,从而造成神经麻痹乃至致死。有机磷酸酯类杀虫试剂在环境中的生态负效应大多数为急性毒性导致的生物多样性减少,短期接触有机磷酸酯的生物会出现血液中磷酯酰胆碱含量迅速增加甚至超标,出现神经麻痹或肌束震颤等不良反应[17,18]。
有机磷药剂在弱碱性或者碱性草木灰的农田或水体中,会造成环境的污染,并对环境中的生物乃至人类造成神经毒性的影响,症状潜伏在2~6 d之间。但是,有机磷酸酯农药具有选择性的毒性,从个别种类的害虫和动物取得的毒理学信息无法推断对其他生物的毒性作用,有机磷药剂的单纯敏感度并不是可靠的环境风险指标。
有机磷酸酯类药剂在生物酶的作用下,会在生物体内或微生物的生物化学作用下快速降解,降解后的有机磷酸酯代谢物活性越来越低,在环境中更安全。有机磷酸酯类农药试剂在受热和弱碱环境下极易水解,在光化学作用下也会发生快速降解为无害物质。因此,在农业和林业中使用有机磷酸酯类药剂,对环境相对较为安全。
参考文献
[1] Mitsunobu O,Yamada M,Mukaiyama T. Preparation of esters of phosphoric acid by the reaction of trivalent phosphorus compounds with diethyl azodicarboxylate in the presence of alcohols[J]. Bulletin of the Chemical Society of Japan,1967,40(4):935-939.
[2] Petroianu G A. Synthesis of tetraethyl pyrophosphate(TEPP):from physician Abbot and pharmacist Riegel to chemist Nylen[J]. Die Pharmazie-An International Journal of Pharmaceutical Sciences,2015,70(6):427-434.
[3] Sliwinski R A. A Study of the Effects of Sodium Monofluorophosphate[J]. 1953.
[4] David W A L,Gardiner B O C. The action of the systemic insecticide fluoroacetamide on certain aphids and on Pieris brassicae(L.)[J]. Bulletin of Entomological Research,1959,50(1):25-38.
[5] Toy A D F. The preparation of tetraethyl pyrophosphate and other tetraalkyl pyrophosphates[J]. Journal of the American Chemical Society,1948,70(11):3882-3886.
[6] LIU Niu,CHE Jun,LAI Duo,WEN Jin-jun,XU Han-hong*(2017). High- level expression and purification of Plutella xylostella acetylcholinesterase in Pichia pastoris and its potential application.Journal of Integrative Agriculture.16(6):1358-1366.
[7] Soltaninejad K,Shadnia S. History of the use and epidemiology of organophosphorus poisoning[J]. Basic and clinical toxicology of organophosphorus compounds,2014:25-43.
[8] Ma Z Y,Xiao M,Li C K,et al. S-( 3-Dioxoisoindolin-2-yl) O,O-diethyl phosphorothioate(SDDP):A practical electrophilic reagent for the phosphorothiolation of electron-rich compounds[J]. Chinese Chemical Letters,2023:109076.
[9] Kaur J,Bandyopadhyay D,Singh P K. A simple and convenient choline oxidase inhibition based colorimetric biosensor for detection of organophosphorus class of pesticides[J]. Journal of Molecular Liquids,202 347:118258.
[10] Xinzhou Wu,Weifeng Li,PengRan Guo,et al(2018). Rapid Trace Detection and Isomer Quantitation of Pesticide Residues via Matrix-assisted Laser Desorption/ionization Fourier Transform Ion Cyclotron Resonance Mass Spectrometry. Journal of Agricultural and Food Chemistry. 66(15):3966-3974.
[11] Hanxiang Wu,Hanhong Xu(2019),Cécile Marivingt-Mounir,Jean-Louis Bonnemain,Jean-Franois Chollet. Vectorizing agrochemicals:enhancing bioavailability via carrier-mediated transport. Pest management science.75(6):1507- 1516.
[12] Trinh K H,Kadam U S,Song J,et al. Novel DNA aptameric sensors to detect the toxic insecticide fenitrothion[J]. International Journal of Molecular Sciences,202 22(19):10846.
[13] Faria M,Prats E,Ramírez J R R,et al. Androgenic activation,impairment of themonoaminergic system and altered behavior in zebrafish larvae exposed to environmental concentrations of fenitrothion[J]. Science of the Total Environment,202 775:145671.
[14] KAUSHIK G. A review on phorate persistence,toxicity and remediation by bacterial communities[J]. Pedosphere,202 32(1):171-183.
[15] Ouyang S,Li Y,Zheng T,et al. Ecotoxicity of natural nanocol-loids in aquatic environment[J]. Water,202 14(19):2971.
[16] Frischknecht R. Lehrbuch der kobilanzierung[M]. Berlin/Heidelberg,Germany:Springer Spektrum,2020.
[17] 陳秋云.有机化学(Organic Chemistry) [M]. 镇江:江苏大学出版社,2018.
[18] 孟紫强.生态毒理学 [M].北京:科学出版社,2019.
